Ишемический инсульт как первое проявление антрациклиновой кардиомиопатии
Автор: Рамазанов Г.Р., Ковалева Э.А., Новиков Р.А., Кузьмина И.М., Клычникова Е.В., Хамидова Л.Т., Рыбалко Н.В., Измайлова А.М.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клинический случай
Статья в выпуске: 6 (60), 2022 года.
Бесплатный доступ
Данная статья посвящена обсуждению кардиоэмболических осложнений антрациклиновой кардиомиопатии. В статье описан клинический случай кардиотоксичности, вызванной агрессивной неоадъювантной химиотерапией у пациентки с раком молочной железы и осложнившейся развитием кардиоэмболического ишемического инсульта.
Криптогенный инсульт, антрациклиновая кардиомиопатия, кардиотоксичность, ишемический инсульт, кардиоэмболия, химиотерапия
Короткий адрес: https://sciup.org/143179591
IDR: 143179591 | УДК: 616.83-61:615.1:001(043.2) | DOI: 10.20340/vmi-rvz.2022.6.CASE.2
Текст научной статьи Ишемический инсульт как первое проявление антрациклиновой кардиомиопатии
УДК 616.83-61:615.1:001(043.2)
Установление патогенетического варианта ишемического инсульта (ИИ) является основой вторичной профилактики. Однако у 20–40 % пациентов с ИИ причину острого нарушения мозгового кровообращения (ОНМК) установить не удаётся. В таком случае принято говорить о криптогенном инсульте (КИ). Установлено, что у большинства пациентов с КИ при детальном обследовании удаётся выявить как минимум один фактор кардиоэмболии среднего риска [1] . Частота развития повторного острого нарушения мозгового кровообращения в течение года у пациентов с криптогенным ишемическим инсультом значительно выше, чем у пациентов с атеротромботическим, кардиоэмболическим и лакунарным инсультом (30 % против 16 %,
14 % и 2 % соответственно) [2]. Криптогенный инсульт значительно чаще диагностируют у пациентов с онкологической патологией, чем у пациентов без таковой (47 % против 12 % соответственно) [3]. Тромбоэмболизм является частым осложнением онкологических заболеваний. Цереброваскулярные события у пациентов с онкологическими заболеваниями верифицируют у 7 % прижизненно и у 15 % патоморфологически [4]. Частота развития инсульта у пациентов с онкологической патологией в 1,5 раза выше, чем в популяции [5]. В настоящее время установлено несколько патогенетических механизмов развития ишемического инсульта у пациентов с онкологическими заболеваниями. К ним относят непосредственную церебральную эмболию опухолевыми клетками (солидные опухоли сердца или лёгких, а также внутрисосудистую лимфому), небактериальный тромбэндокардит, ускорение атеросклероза на фоне химиотерапии, а также коагулопатию, которая может быть связана непосредственно с онкологическим заболеванием либо быть осложнением его лечения [6]. Парадоксальная эмболия также должна быть рассмотрена как один из факторов риска ишемического инсульта у пациентов с онкологической патологией, так как у 1 из 4 пациентов со злокачественным новообразованием присутствует открытое овальное окно, а у 1 из 5 пациентов – тромбоз глубоких вен нижних конечностей [7–9]. Одной из причин инсульта у пациентов с онкологической патологией является антрациклиновая кардиомиопатия (АК), которая развивается на фоне неоадъювантной химиотерапии злокачественных новообразований. Частота развития АК после проведения неоадъювантной химиотерапии варьирует от 1 до 5 % [10].
Цель данной статьи: представить клинический пример развития ишемического инсульта на фоне поздно начавшейся антрациклиновой кардиомиопатии у пациентки после неоадъювантной химиотерапии.
Клиническое наблюдение
Пациентка К., 60 лет доставлена в НИИСП им. Н.В. Склифосовского бригадой скорой медицинской помощи с диагнозом «ОНМК». Из анамнеза заболевания известно, что накануне вечером у пациентки остро возникло несистемное головокружение. У пациентки 10 месяцев назад диагностирован рак правой молочной железы IIIВ cт., Т3N3M0, проведено 8 курсов неоадъювантной химиотерапии (НХТ) (доксорубицин кумулятивная доза 580 мг/м2, трастузумаб 64 мг/кг). Также в анамнезе жизни у пациентки сахарный диабет 2 типа, артериальная гипертензия. При поступлении – сознание ясное, элементы сенсорной афазии, шаткость в позе Ромберга, атаксия в правых конечностях, National Institutes of Health Stroke Scale (NIHSS) – 3 балла. Дыхание самостоятельное, частота дыхательных движений (ЧДД) – 17 в минуту, артериальное давление (АД) – 130/80 мм рт. ст., частота сердечных сокращений (ЧСС) – 85 ударов в минуту. Рост – 167 см, масса тела – 78 кг, индекс массы тела – 27,9 кг/м2. В клиническом анализе крови – снижение гемоглобина (80 г/л), эритроцитов (2,95х1012/л) и гематокрита (25,5 %), лейкопения (1,26х109/л): нейтропения (26,9 %), лимфоцитоз (54,8 %) и эозинофилия (11,9 %); в биохимическом анализе крови – гипоальбуминемия (29,2 г/л), ги-перглобулинемия (42,8 г/л), гипергликемия (11,3 ммоль/л), повышение уровня мочевины (9,12 ммоль/л); в коагулогическом анализе повышены МНО до 1,28 и активированное частичное тромбопластиновое время (АЧТВ) до 32,2 секунд; в общем анализе мочи – без отклонений. На электрокардиограмме (ЭКГ) – синусовый ритм с ЧСС 87 ударов в минуту. При компьютерной томографии (КТ) головного мозга и лёгких патологии не выявлено. По данным эхокардиографии (Эхо-КГ) камеры сердца не расширены, глобальная и региональная систолическая функция левого желудочка (ЛЖ) сохранена, фракция выброса (ФВ) – 59 %, признаков лёгочной гипертензии не установлено (систолическое давление в лёгочной артерии (СДЛА) – 22 мм рт. ст. При дуплексном сканировании брахиоцефальных артерий выявлен стеноз правой общей сонной артерии до 35–40 % по площади. Церебральная МР-ангиография патологии не выявила. В связи с отсутствием факторов кардиоэмболии высокого риска и стенозов инсульт-связанной артерии более 50 % был выставлен диагноз «криптогенный инсульт». С целью вторичной профилактики ИИ назначена ацетилсалициловая кислота в дозе 100 мг в сутки.
На 5-е сутки состояние пациентки с отрицательной динамикой: после сна пациентка отметила слабость и снижение чувствительности в правой руке, был эпизод утраты сознания без судорог продолжительностью менее одной минуты, после которого в неврологическом статусе – сознание ясное, мышечная сила в правой верхней конечности 4 балла, гипестезия правой руки, атаксия в правых конечностях, NIHSS – 4 балла. Дыхание самостоятельное, ЧДД – 17 в минуту, АД – 90/60 мм рт. ст., ЧСС – 85 ударов в минуту. На ЭКГ ритм синусовый с ЧСС 88 в минуту, нагрузка на левый желудочек. На КТ и МРТ головного мозга в динамике патологии не выявлено. По данным суточного мониторирования ЭКГ по Холтеру зарегистрированы эпизод наджелудочковой тахикардии длительностью 2 секунды с ЧСС 155 ударов в минуту и эпизод фибрилляции предсердий длительностью 11 секунд с ЧСС
124 ударов в минуту, выявлено 99 наджелудочковых экстрасистол (из них 4 – парные, 1 – групповая), 511 желудочковых экстрасистол (максимально 210/час). По данным Эхо-КГ выявлены: дилатация предсердий и ЛЖ, снижение глобальной систолической функции ЛЖ за счёт диффузного гипокинеза; диастолическая дисфункция ЛЖ по типу нарушения релаксации и признаки незначительной легочной гипертензии (СДЛА 44 мм рт. ст.). Показатель N-концевого прогормона мозгового натрийуретического пептида (NT-proBNP) – 1350 пг/мл (норма 0–125 пг/мл) – качественный признак наличия хронической сердечной недостаточности (ХСН), маркеры повреждения миокарда отрицательные. Состояние расценено как кардиомиопатия, ХСН Н2А, третий функциональный класс по NYHA вследствие проведённой химиотерапии. Начата медикаментозная терапия: эналаприл – 5 мг/сутки, бисопролол – 5 мг/сутки, спиронолактон – 50 мг/сутки. Патогенетический вариант ИИ у пациентки согласно критериям TOAST – кардиоэмболический (пароксизмальная форма ФП, CHA2Ds2-VASc 4, HAS BLED 1). В качестве вторичной профилактики ИИ назначен оральный антикоагулянт. При ультразвуковом исследовании (УЗИ) плевральных полостей выявлен минимальный двусторонний гидроторакс (разобщение листков плевры по задним подмышечным линиям на уровне синуса справа до 0,8 см, слева – до 0,9 см). На КТ лёгких в динамике – небольшой двусторонний плевральный выпот (толщина на уровне синусов справа – 10 мм, слева – 21 мм).
С целью исключения ишемического генеза кардиальной патологии выполнены сцинтиграфия миокарда – очаговые изменения не выявлены, снижение фракции до 36 %; коронарография – правый тип коронарного кровообращения, контуры коронарных артерий без значимых сужений.
На 14-е сутки состояние пациентки с дальнейшей отрицательной динамикой: возникла одышка, боль за грудиной. Дыхание самостоятельное, ЧДД – 22 в минуту, АД – 90/60 мм рт. ст., ЧСС – 74 удара в минуту, сатурация снижена (SpO 2 89–92 %). В неврологическом статусе данные прежние. По данным КТ лёгких выявлены интерстициальная и альвеолярная инфильтрация по типу отёка лёгких, нарастание двустороннего плеврального выпота (ширина на уровне синусов – 32 мм, объём – 267 см3) и гиповентиляционные изменения (рис. 1). При контрастном усилении данных за тромбоэмболию лёгочных артерий не получено. По данным Эхо-КГ – без существенной динамики, сохраняется дилатация всех полостей сердца, глобальная систолическая функция ЛЖ снижена за счёт диффузного гипокинеза; сохраняются диастолическая дисфункция ЛЖ по псевдонормальному типу и признаки лёгочной гипертензии (СДЛА – 65 мм рт. ст.), разобщение листков плевры справа 2,7 см и слева 3,3 см. Маркеры повреждения миокарда отрицательные. Состояние расценено как кардиогенный отёк лёгких. Начата ингаляция увлажнённым кислородом, терапия фуросемидом (40 мг) под контролем диуреза.
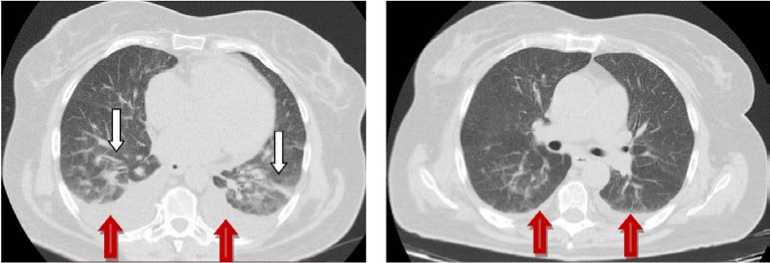
A B
Рисунок 1. Компьютерная томография органов грудной клетки : А - 14-е сутки заболевания: белыми стрелками указаны интерстициальная и альвеолярная инфильтрации по типу отёка лёгких, красными стрелками – двусторонний плевральный выпот; В – 19-е сутки заболевания: красными стрелками показан минимальный плевральный выпот с двух сторон
Figure 1. Computed tomography of the chest organs: A – the 14th day of the disease: interstitial and alveolar infiltrations by the type of pulmonary edema are indicated with white arrows, bilateral pleural effusion is indicated with red arrows; B – 19th day of the disease: red arrows show minimal pleural effusion on both sides
На 19-й день, на фоне проводимой интенсивной терапии, состояние пациентки с положительной динамикой: дыхание самостоятельное, ЧДД – 18 в минуту, АД – 109/70 мм рт. ст., ЧСС – 72 удара в минуту, сатурация в норме (SpO2 99 %). В клиническом анализе крови – нормализация числа лейкоцитов (7,99х109/л), небольшое увеличение количества гемоглобина (82 г/л), эритроцитов (3,2х1012/л) и гематокрита (27,7 %), в биохимическом анализе крови сохраняются гипоальбумине-мия (29,78 г/л), гиперглобулинемия (39,59 г/л) и гипергликемия (8,91 ммоль/л), в коагулогическом анализе и общем анализе мочи патологии не выявлено. По результатам КТ органов грудной клетки отмечена положительная динамика в виде умеренного регресса интерстициальных изменений обоих лёгких, а также уменьшение объёма плеврального выпота с двух сторон (ширина на уровне синусов до 12 мм справа и 11 мм слева) (рис. 1). По данным УЗИ плевральных полостей: уменьшение объёма двустороннего гидроторакса (разобщение листков плевры справа по лопаточной линии на уровне 6–7 межреберья до 1,4 см, по задней подмышечной линии на уровне 6–7 межреберья – до 1,8 см, слева по лопаточной линии на уровне 6–7 межреберья – до 1,3 см, по задней подмышечной линии на уровне 6–7 межреберья – до 1,1 см). На 21-е сутки пациентка в удовлетворительном состоянии и без неврологического дефицита (NIHSS – 0 баллов, mRS – 0 баллов, индекс Бартел – 100 баллов, индекс мобильности Ривермид – 14 баллов) выписана домой.
Амбулаторно на 40-е сутки с момента развития ОНМК выполнена трансторакальная Эхо-КГ, где отмечена положительная динамика в виде уменьшения размеров левого предсердия и ЛЖ, нарастания ФВ ЛЖ до 56 %, а также снижения СДЛА до 35 мм рт. ст. (табл. 1).
Обсуждение
Неоадъювантная химиотерапия рака молочной железы – это системная терапия цитостатиками и/или гормональными препаратами до хирургического удаления опухоли. В рандомизированных исследованиях убедительно показано улучшение прогноза заболевания у пациентов пременопа-узального возраста с наличием метастазов в региональные лимфоузлы [11 –14] .
Кардиотоксичность – группа нежелательных явлений, связанных со снижением ФВ ЛЖ и развитием недостаточности кровообращения, обусловленная медикаментозным лечением онкологического заболевания [15] . Выделено два типа кардиотоксичности: первый тип – необратимая дисфункция миокарда с развитием недостаточности кровообращения, второй тип – обратимая дисфункция миокарда [16, 17] .
Таблица 1. Результаты трансторакальной эхокардиографии Table 1. Results of transthoracic echocardiography
|
Показатель |
Сутки наблюдения |
|||
|
1-е |
5-е |
14-е |
40-е |
|
|
Левое предсердие - диаметр, мм |
40 |
45 |
48 |
38 |
|
- объём, мл |
52 |
122 |
115 |
59 |
|
Правое предсердие - объём, мл |
27 |
61 |
80 |
50 |
|
Правый желудочек - диаметр, мм |
29 |
40 |
39 |
39 |
|
Левый желудочек - конечный диастолический размер, мм |
49 |
53 |
57 |
55 |
|
- конечный диастолический объём, мл |
81 |
155 |
168 |
147 |
|
- конечный систолический размер, мм |
18 |
31 |
39 |
39 |
|
- конечный систолический объём, мл |
33 |
90 |
83 |
65 |
|
Фракция выброса левого желудочка, % |
59 |
42–47 |
45–50 |
56 |
|
Систолическое давление в лёгочной артерии, мм рт. ст. |
22 |
44 |
45 |
35 |
В рекомендациях ESMO 2012 дана классификация кардиотоксичности: 1) острая – возникает менее чем у 1 % пациентов сразу после введения препарата, является обратимой; 2) остро начавшаяся хроническая прогрессирующая – развивается в 1,6–2,1% случаев в период химиотерапии или в первый год после неё; 3) поздно начавшаяся хроническая прогрессирующая – возникает у 1,6–5,0 % пациентов через один год после окончания химиотерапии; 4) отдалённая (поздно возникающая) – развивается через 20–30 лет после окончания химиотерапии [18] . В представленном клиническом наблюдении у пациентки развилась обратимая дисфункция миокарда.
В настоящее время установлены следующие факторы риска кардиотоксичности: кумулятивная доза препарата, комбинированная терапия, лучевая терапия на область средостения или химиолу-чевая терапия, химиотерапия в прошлом, одновременная терапия комбинацией химиопрепаратов, а также общие факторы – возраст старше 50 лет, кардиальная патология в анамнезе, систолическая дисфункция или снижение ФВ ЛЖ менее 55 %, ожирение (ИМТ > 25 кг/м2), артериальная гипертензия, требующая медикаментозной коррекции [15] . Кумулятивная доза доксорубицина является определяющей в плане возможного развития кардиотоксичности. В исследованиях была показана прямая зависимость кумулятивной дозы и вероятности возникновения ХСН: при дозе доксорубицина 300 мг/м2 вероятность развития ХСН составляет 1,9 %, при нарастании дозы до 400 мг/м2 – 4,8 %, при дозе 500 мг/м2 – 15,9 %, при кумулятивной дозе доксорубицина 650 мг/м2 и более частота возникновения ХСН приближалась к 50 % [19] . Дозы полученных препаратов в нашем клиническом наблюдении составили для доксорубицина 580 мг/м2, для трастузумаба – 64 мг/кг. В представленном клиническом наблюдении у пациентки в анамнезе были сахарный диабет, алиментарное ожирение и артериальная гипертензия, требующие постоянного приема гипотензивных средств.
По нашему наблюдению наступление структурных изменений сердца с формированием дилатации полостей левого предсердия и желудочка в дальнейшем привело к аритмогенной активности и пароксизмам ФП. Согласно классификации TOAST, пароксизмальная ФП и снижение сократительной способности ЛЖ являются самостоятельными источниками кардиоэмболии, которые и были основной причиной развития ИИ в данном случае [20].
При целостной оценке клинического случая мы пришли к выводу о том, что тяжесть состояния пациентки была связана с остро начавшейся хронической прогрессирующей кардиотоксичностью, в клинической картине которой, помимо снижения сократительной способности миокарда, развернулась картина острой сердечной недостаточности с отёком лёгких, двусторонним гидротораксом, нарушениями ритма сердца.
Тактика ведения пациентов с выявленной кардиомиопатией предполагает как можно раннюю коррекцию ХСН, направленную на предотвращение дальнейшего ремоделирования миокарда, а именно назначение ингибитора ангиотензинпревращаюшего фермента – эналаприла (5 мг/сутки) [21, 22] , кардио-специфичного селективного бета-адреноблокатора – бисопролола (5 мг/сутки) [23] , антагониста альдостерона – спиронолактона (50 мг/сутки) [16] в сочетании с петлевым диуретиком – фуросемидом (40 мг/сутки). Антикоагулянт (дабигатран 150 мг 2 раза в день) назначен с целью вторичной профилактики ИИ. Терапия начата на 5-е сутки нахождения в стационаре и оценивалась по динамике клинической картины ХСН, Эхо-КГ, суточного мониторирования ЭКГ по Холтеру. На 14-е сутки, при сохраняющейся одышке в покое, двустороннем гидротораксе, дальнейшем прогрессировании дилатации левых отделов сердца, развивается отёк лёгких, а к 19-м суткам, на фоне назначения диуретиков, отмечен регресс одышки, отёков, гидроторакса (по данным КТ органов грудной клетки). Амбулаторно рекомендован дополнительный прием торасемида (5 мг/сутки). К 40-му дню амбулаторного наблюдения, на фоне проводимой терапии, отмечена нормализация ФВ ЛЖ, уменьшение размеров левого предсердия и ЛЖ, клиническое улучшение – отсутствие проявлений ХСН, повышение толерантности к физической нагрузке. Обратимость кардиотоксичности в этом клиническом наблюдении говорит о дальнейшем благоприятном прогнозе.
Выводы
Кардиотоксичность, спровоцированная агрессивной неоадъювантной химиотерапией, вызвала снижение сократительной способности миокарда левого желудочка и, как следствие, пароксизмы фибрилляции предсердий, что послужило непосредственной причиной развития ишемического инсульта. Выявление и своевременное начало лечения ХСН у пациентов, получающих цитостатиче- скую терапию, является единственной мерой первичной профилактикой ИИ. Онкологический анамнез и настороженность врача предупредит кардиоэмболические осложнения кардиотоксичности в редкой ситуации развития ИИ.
Список литературы Ишемический инсульт как первое проявление антрациклиновой кардиомиопатии
- Шамалов Н.А., Кустова М.А. Криптогенный инсульт. Неврология, нейропсихиатрия, психосоматика. 2014;(спецвыпуск 2):42-49. [Shamalov N.A., Kustova M.A. Cryptogenic stroke. Neurology, neuropsychiatry, psychosomatics. 2014;( special issue 2):42-49 (In Russ)]. https://doi.org/10.14412/2074-2711-2014-2s-42-49
- Bang O, Lee P, Joo S, Lee J, Joo I, Huh K. Frequency and mechanisms of stroke recurrence after cryptogenic stroke. Ann Neurol. 2003;54(2):227-234. https://doi.org/10.1002/ana.10644
- Gon Y, Okazaki S, Terasaki Y et al. Characteristics of cryptogenic stroke in cancer patients. Ann Clin TranslNeurol. 2016;3(4):280-287. https://doi .org/10.1002/acn3.291
- Graus F, Rogers L, Posner J. Cerebrovascular Complications in Patients with Cancer. Medicine (Baltimore). 1985;64(1):16-35. https://doi.org/10.1097/00005792-198501000-00002
- Chen P, Muo C, Lee Y, Yu Y, Sung F. Lung Cancer and Incidence of Stroke. Stroke. 2011;42(11):3034-3039. https://doi.org/10.1161/strokeaha.111.615534
- Bang O, Chung J, Lee M, Seo W, Kim G, Ahn M. Cancer-Related Stroke: An Emerging Subtype of Ischemic Stroke with Unique Pathomechanisms. J Stroke. 2020;22(1):1-10. https://doi.org/10.5853/jos.2019.02278.
- Iguchi Y, Kimura K, Kobayashi K, Ueno Y, Inoue T. Ischaemic stroke with malignancy may often be caused by paradoxical embolism. Journal of Neurology, Neurosurgery & Psychiatry. 2006;77(12):1336-1339. https://doi.org/10.1136/jnnp.2006.092940
- Khorana A, Dalal M, Lin J, Connolly G. Incidence and predictors of venous thromboembolism (VTE) among ambulatory high-risk cancer patients undergoing chemotherapy in the United States. Cancer. 2012;119(3):648-655. https://doi.org/10.1002/cncr.27772
- Thompson C, Rodgers L. Analysis of the autopsy records of 157 cases of carcinoma of the pancreas with particular reference to the incidence of thromboembolism. Am J Med Sci. 1952;223(5):469-478. https://doi.org/10.1097/00000441-195205000-00001
- Volkova M, Russell R. Anthracycline Cardiotoxicity: Prevalence, Pathogenesis and Treatment. Curr Cardiol Rev. 2012;7(4):214-220. https://doi.org/10.2174/157340311799960645
- Early Breast Cancer Trialists' Collaborative Group. Systemic treatment of early breast cancer by hormonal, cytotoxic, or immune therapy 133 randomised trials involving 31 000 recurrences and 24 000 deaths among 75 000 women. The Lancet. 1992;339(8784). https://doi.org/10.1016/0140-6736(92)90139-t
- Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries in 2012. Eur J Cancer. 2013;49(6):1374-1403. https://doi.org/10.1016Zj.ejca.2012.12.027
- Siegel R, DeSantis C, Virgo K et al. Cancer treatment and survivorship statistics, 2012. CA Cancer J Clin. 2012;62(4):220-241. https://doi.org/10.3322/caac.21149
- Ewer M, Ewer S. Cardiotoxicity of anticancer treatments. Nature Reviews Cardiology. 2015;12(9):547-558. https://doi.org/10.1038/nrcardio.2015.65
- Гендлин Г.Е., Емелина Е.И., Никитин И.Г. и др. Современный взгляд на кардиотоксичность химиотерапии онкологических заболеваний, включающей антрациклиновые антибиотики. Российский кардиологический журнал. 2017;3(143):145-154. [Gendlin G.E., Emelina E.I., Nikitin I.G., etc. A modern view of the cardiotoxicity of chemotherapy of oncological levania, including anthracycline antibiotics. Russian Journal of Cardiology. 2017;3(143):145-154 (In Russ)]. https://doi.org/10.15829/1560-4071-2017-3-145-154
- Armstrong G, Oeffinger K, Chen Y et al. Modifiable Risk Factors and Major Cardiac Events Among Adult Survivors of Childhood Cancer. Journal of Clinical Oncology. 2013;31(29):3673-3680. https://doi.org/10.1200/jco.2013.49.3205
- Richardson AJ, Leckie T, Watkins ER et al. Post marathon cardiac troponin T is associated with relative exercise intensity. J Sci Med Sport. 2018;21(9):880-884. https://doi.org/10.1016/j.jsams.2018.02.005
- Curigliano G, Cardinale D, Suter T et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Annals of Oncology. 2012;23:vii155-vii166. https://doi.org/10.1093/annonc/mds293
- Swain S, Whaley F, Ewer M. Congestive heart failure in patients treated with doxorubicin. Cancer. 2003;97(11):2869-2879. https://doi.org/10.1002/cncr. 11407
- Adams H, Bendixen B, Kappelle L et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke. 1993;24(1):35-41. https://doi.org/10.1161/01.str.24.1.35
- Правдивцева Е.В., Потешкина Н.Г., Сванадзе А.М., и др. Профилактика кардиотоксического действия антрациклинового антибиотика доксорубицина: роль ингибитора ангиотензинпревращающего фермента периндоприла. Клиницист. 2011;5,3: 55-60. [Pravdivtseva E.V., Poteshkina N.G., Svanadze A.M., etc. Prevention of the cardiotoxic effect of anthracycline anti-biotic doxorubicin: the role of an angiotensin-converting enzyme inhibitor perindopril. Clinician. 2011;5,3: 55-60 (In Russ)].
- Bosch X, Rovira M, Sitges M et al. Enalapril and Carvedilol for Preventing Chemotherapy-Induced Left Ventricular Systolic Dysfunction in Patients With Malignant Hemopathies. J Am Coll Cardiol. 2013;61(23):2355-2362. https://doi.org/10.1016/j.jacc.2013.02.072
- Kalay N, Basar E, Ozdogru I et al. Protective Effects of Carvedilol Against Anthracycline-Induced Cardiomyopathy. J Am Coll Cardiol. 2006;48(11):2258-2262. https://doi.org/10.1016/j.jacc.2006.07.052


