Использование аберрантно метилированных генов SEPT9 и ViM для клинической диагностики колоректального рака
Автор: Бровкина Ольга Игоревна, Гордиев Марат Гордиевич, Ходырев Дмитрий Сергеевич, Никитин Алексей Георгиевич, Аверьянов Александр Вячеславович
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4 (28), 2016 года.
Бесплатный доступ
Определение эпигенетических нарушений имеет большое значение для ранней диагностики колоректального рака (КРР). Для получения модели диагностической тест-системы с высокими показателями чувствительности и специфичности мы определяли частоту метилирования в генах SEPT9 и VIM. При анализе эпигенетических нарушений нами также учитывались мутации в генах семейства RAS. В нашей работе подтверждается наличие аберрантного метилирования в генах SEPT9 и VIM в клетках опухоли. ДНК образцов опухоли была достоверно чаще метилирована, чем ДНК образцов прилежащей ткани (P =8,67E-19 для гена SEPT9 и P=8,68E-19 для гена VIM). В группе пациентов, имеющих мутации в генах KRAS или NRAS, ДНК опухолевых образцов достоверно чаще метилирована в генe SEPT9 (P=0.0018), в отличие от ДНК опухолевых образцов пациентов, не несущих данных мутаций. Нами было продемонстрировано, что использование совокупности маркеров метилирования позволяет улучшить чувствительность тест- систем, используемых в диагностике КРР.
Колоректальный рак, аберрантное метилирование, гены sept9
Короткий адрес: https://sciup.org/143164611
IDR: 143164611
Текст научной статьи Использование аберрантно метилированных генов SEPT9 и ViM для клинической диагностики колоректального рака
Колоректальный рак (КРР) является одним из наиболее агрессивных типов рака и занимает второе место по распространенности в России. Было доказано, что одна из основных причин, влияющих на развитие этого заболевания, – эпигенетические нарушения регуляции генов [1]. Определение эпигенетических нарушений имеет большое значение для ранней диагно- стики раковых заболеваний, так как нарушенная регуляция генов вследствие аберрантного метилирования ДНК является ключевой стадией в развитии опухоли [2]. При этом, метилированная ДНК является достаточно информативным биомаркером и может быть легко измерена в образцах крови или плазмы [3]. Метилирование обширных регионов CpG-островков
– основное эпигенетическое изменение, характерное для процессов канцерогенеза при КРР.
В настоящий момент на рынке представлены зарубежные коммерческие наборы для определения аберрантного метилирования генов SEPT9 либо VIM , однако эти наборы выпускаются разными фирмами и применение в диагностической практике сразу двух генов затруднительно.
Использование лишь одного маркера метилирования зачастую недостаточно для эффективной диагностики заболевания, так как показатели чувствительности и специфичности отдельных маркеров невысоки, поэтому представляет интерес проверка диагностических характеристик модели из нескольких маркеров. Для этих целей мы определяли частоту метилирования в генах SEPT9 и VIM.
Наличие аберрантного метилирования в гене SEPT9 тесно связано с развитием КРР. Даже на ранних стадиях КР отмечается гиперметилирование гена SEPT9 [1]. Септин принадлежит к классу ГТФ-связывающих полипептидов, которые задействованы в большом количестве клеточных процессов [4]. У людей в общей сложности 13 генов септина. Все септины могут образовывать гетеромерные комплексы и участвуют в формировании структур наподобие нитей, колец и клеток. Эти уникальные структуры участвуют в клеточном делении, формируют плазму мембраны, кольца сперматозоидов, основания ресничек и дендритов [5, 6].
Ген SEPT9 расположен на хромосоме 17q25.3, и экспрессируется в большинстве клеток человека. Было показано, что SEPT9 имеет 18 различных транскриптов, которые кодируют 15 полипептидов [7]. Они играют важную роль в динамике актина, в процессах ангиогенеза, в подвижности и пролиферации клеток, цитокинезе, регулировании микротрубочек, и процессах экзоци-тоза Несколько недавних исследований показывают, что SEPT9 занимает концевую позицию в октамерциссептиновом комплексе и играет ключевую роль в полимеризации субъединиц и стабилизации целых гетеромеров [8]. Это также имеет важное значение для окончательного разделения дочерних клеток во время цитокинеза.
Продукт гена VIM , виментин, входит в состав цитоскелета, а также задействован в иммунном ответе и контролирует транспорт липопротеинов низкой плотности. VIM содержит богатый CpG динулеотидами промотерный регион, рядом с которым расположен первый экзон, являющийся мишенью для ДНК-метилтрансфераз.
Было показано, что в 53-84% образцов опухоли и сыворотки больных КРР имеет место метилирование гена VIM [9, 10], таким образом, метилированный ген VIM является потенциальным маркером для диагностики КРР.
Важно отметить, что маркерные молекулы для диагностики заболеваний не всегда лежат в основе развития заболеваний. Данное утверждение в особенности справедливо для маркеров метилирования. В ряде работ было показано отсутствие прямой корреляции между аберрантным метилированием и выраженностью экспрессии генов [11, 12].
При анализе генома пациентов с КРР очень часто выявляются мутации (частота до 40%) [13]. KRAS является геном, кодирующим один из белков, играющих важную роль в сигнальной системе рецептора эпидермального фактора роста (EGFR) — сложного сигнального каскада, принимающего участие в развитии и прогрессировании рака. Белок KRAS регулирует другие белки, находящиеся далее в сигнальной системе EGFR, которые связаны с выживаемостью опухоли, ангиогенезом, пролиферацией и метастазированием [14].
При метастатическом колоректальном раке почти 60% пациентов имеют нормальную сигнальную систему EGFR и дикий тип гена KRAS ; остальные 40% имеют мутантный тип гена [13].
Тестирование генов, кодирующих белки семейства RAS (K-RAS и N-RAS) позволяет отобрать пациентов с диким типом (без мутации) генов RAS, у которых может быть получен ответ при лечении моноклональными антителами, блокирующими EGFR.
В данном исследовании мы обладали возможностью сопоставить статус мутации генов семейства RAS с наличием аберрантного метилирования в выбранных нами генах.
Основной задачей этой работы был анализ метилирования промотерных участков генов SEPT9 и VIM у пациентов с КРР для формирования единой панели эпигенетических маркеров, позволяющей диагностировать данную онкопатию с высокой чувствительностью и специфичностью.
Материалы и методы
Работа была одобрена локальным этическим комитетом, выполнена в соответствии с требованиями GCP (Good Clinical Practice) и Хельсинской декларацией по защите прав человека.
Исследование включало 150 парных образцов опухолевой ткани с известным статусом мутации генов семейства RAS и прилегающей гистологически неизмененной ткани пациен- тов с аденокарциномой прямой кишки, проходивших лечение в Республиканском клиническом онкологическом диспансере Министерства здравоохранения Республики Татарстан в 2008-2012 годах (таблица 1). Каждый пациент подписал добровольное информированное согласие на участие в проведении исследования. Опухоли классифицированы в соответствии с TNM-классификацией Международного противоракового союза и описаны гистологически на основании классификации Всемирной Организации Здравоохранения (ВОЗ) [12, 13]. Для отбора образцов с высоким содержанием опухолевых клеток проводили дополнительный гистологический анализ микросрезов. Отбирали образцы из первичных очагов с содержанием опухолевых клеток не менее 50%.
Таблица 1
Клиническая характеристика пациентов
|
Пол |
Количество |
|
мужской |
72 |
|
женский |
78 |
|
Возраст |
|
|
>50 |
124 |
|
<50 |
26 |
|
Стадия опухоли |
|
|
Т2M0 |
11 |
|
Т3M0 |
36 |
|
Т4М0 |
38 |
|
Т2М1 |
2 |
|
Т3М1 |
18 |
|
Т4М1 |
28 |
Выделение ДНК осуществлялось набором QIAamp DNA FFPE Tissue Kit («Qiagen», Германия), концентрацию суммарной ДНК в водном растворе оценивали на спектрофотометре NanoVue Plus («GE Healthcare», Великобритания) по соотношению оптической плотности при длинах волн 260 и 280 нм. Бисульфитная конверсия и очистка проводились наборами EpiTect Fast Bisulfite Conversion Kit («Qiagen», Германия) с помощью автоматической станции пробо-подготовки QIAcube («Qiagen», Германия). Изучение профилей метилирования производилось с помощью метода MethyLight PCR c олигонуклеотидами (таблица 2), подобранными на локусы, содержащие дифференциально метилируемые CpG-островки, на приборе StepOnePlus™ RealTime PCR Systems («Applied Biosystems», США). В качестве неметилированного гена сравнения использовали COL2A1. Для определения степени метилирования вычисляли величину порогового цикла (Ct) для каждого гена-мишени, затем величину ∆CT (мишень-контроль), после значение ∆∆CT (мишень-калибрант). Величина RQ рассчитывалась по формуле RQ=2^(- ∆∆CT). Метилированным считался образец с RQ>10.
Статус мутаций в генах KRAS и NRAS определяли с помощью наборов KRAS-24 и NRAS-24 (ООО «Тестген», Россия).
Статистический анализ данных проводили с применением точного критерия Фишера. Уровень значимости принят равным 0.05. Конкор-дантность данных по метилированию оценивали с помощью непараметрической ранговой корреляции Спирмана. Значимость корреляции по Спирману (Rs) проверяли с помощью t-теста Стьюдента: с числом степеней свободы ν = N – 2, где N – размер выборки. Уровень значимости принят равным 10–6.
Чувствительность и специфичность маркеров оценивались с помощью ROC-анализа (MedCalc.2 software)
Результаты и обсуждение
В данном исследовании подтвердилось наличие аберрантного метилирования у пациентов, больных КРР. ДНК образцов опухоли была достоверно чаще метилирована, чем ДНК образцов прилежащей ткани (P=8,67E-19 для гена SEPT9 и P=8,68E-19 для гена VIM) (рис. 1). Довольно интересно, что гены SEPT9 и VIM не являются биологически значимыми маркерами в развитии КРР, однако ценность их как диагностических маркеров представляется нам очень высокой, так как в отличие от таких маркеров, как MLH1 и MGMT (продукты которых участвуют в канцерогенезе), они обладают высокими показателями как чувствительности, так и специфичности (чувствительность 60-70% для SEPT9 и VIM )
По результатам проведенной работы мы выявили, что в группе пациентов, имеющих мутации в генах KRAS или NRAS , ДНК опухолевых образцов достоверно чаще метилирована в генe SEPT9 ( P=0.0018 ), в отличие от ДНК опухолевых образцов пациентов, не несущих данных мутаций. В исследованиях похожей тематики также подтверждается частое гипермети-лированние промотерных участков генов при наличии активирующих мутаций гена KRAS [15]. Биологические основы этого обстоятельства на сегодняшний день до конца не изучены. Мы можем предположить, что процессы канцерогенеза у носителей мутаций в генах семейства
Таблица 2
Параметры праймеров и зондов для ПЦР в режиме реального времени
|
Ген |
Последовательность, 5’-3’ |
Длина продукта |
Условия реакции, °С |
|
SEPT9 |
Праймер - FM, TAGGGTTCGGGTTTCGTCG ,57C Праймер - RM,TTTCAAAACTTCGAAATCCG,51C Зонд - CGCGTTAACCGCGAAATCCG-BHQ1, 61C |
98 |
51 |
|
VIM |
Праймер - FM, GGCGGTTCGGGTATCG,56C Праймер - RM, CGTAATCACGTAACTCCGACT,54C Зонд - GACGCGGAGGCGAGTCGGTCG-BHQ1, 63C |
146 |
54 |
|
COL2A1 |
Праймер - FM, AGGGTAATTTTGGAATAGATGGA, 64C Праймер - RM, TCTCCTAAAATAACAAAATCCACAA, 63C Зонд - CAACACTCACAACAAATCCTTTAACTCCAA –BHQ2, 69C |
83 |
54 |
RAS протекают в целом быстрее и агрессивнее [16, 17], поэтому аберрантное метилирование в некоторых генах у пациентов-носителей мутаций также будет выражено сильнее.
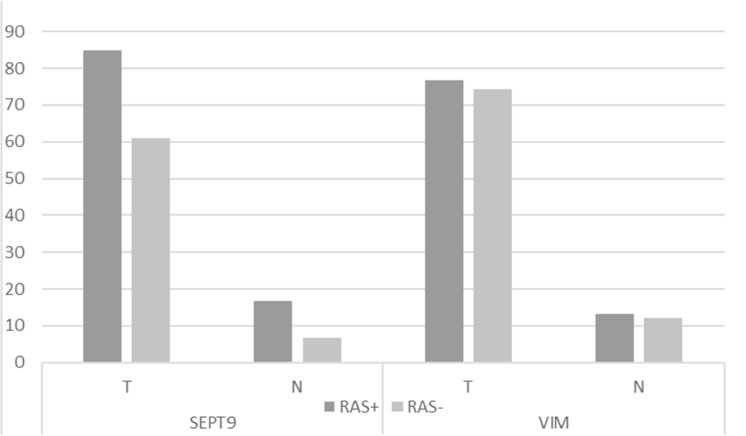
Рис. 1. Процент метилированных образцов в зависимости от статуса мутации генов,кодирующих белки семейства RAS.
Мы провели корреляционный анализ для выявления зависимости степени прогрессирования КРР (учитывалось наличие или отсутствие метастазов) и частоты метилирования. Корреляция между данными показателями оказалась очень слабой (r=0,03967, P>0,05 для гена SEPT9 , r= 08871, P>0,05 для гена VIM ). Вероятно, для выявления степени прогрессирования КРР следует анализировать профиль метилирования.
На сегодняшний день для диагностики колоректального рака существуют наборы для определения метилирования в гене SEPT9 , либо набор для определения метилирования в гене VIM , однако обеспечить лишь одним из данных наборов необходимые для диагностики показатели чувствительности и специфичности представляется затруднительным. Использование нескольких маркеров позволили бы улучшить показатели диагностических тест-систем.
В рамках данной работы был рассчитан индекс метилирования для каждого образца и проверены параметры чувствительности и специфичности как для совокупности маркеров, так и для каждого маркера в отдельности. За пороговое значение для анализа совокупности маркеров был взят индекс метилирования, равный 0,5. Под индексом метилирования понимается отношение числа метилированных локусов к общему числу локусов модели. При этом значении система из маркеров имеет высокие показатели чувствительности и специфичности (91,3% и 78,0% соответственно). AUC, показатель интегральной оценки качества и предсказательной способности модели, составляет 0,90, что говорит о высоком качестве модели.
Таким образом, использование нескольких маркеров при диагностике КРР позволяет существенно улучшить параметры тест-системы.
Выводы
В данной работе подтверждается высокая частота метилирования генов SEPT9 и VIM в опухолевых тканях больных КРР.
Для генов SEPT9 и VIM были установлены высокие показатели чувствительности и специфичности (чувствительность 70,7% и специфичность 89,4 % для SEPT9 , чувствительность 75,3% и специфичность 87,3% для VIM ), которые считаются важными клиническими маркерами, имеющими большие перспективы в диагностике КРР.
В настоящем исследовании мы показали, что
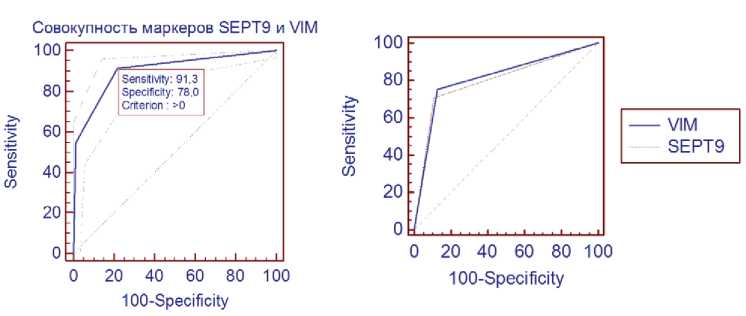
Рис. 2. Сравнение результатов ROC-анализа для каждого маркера в отдельности и для совокупности маркеров.
ДНК опухолевых образцов пациентов с мутациями в гене KRAS достоверно чаще метилирована в гене SEPT9 (P=0.0018) в отличие от ДНК опухолевых образцов пациентов, не несущих данных мутаций. Однако биологические основы этих результатов требуют дальнейших изучений.
Нами было продемонстрировано, что использование совокупности маркеров метилирования, таких как SEPT9 и VIM, позволяет улучшить чувствительность тест-систем, используемых в диагностике КРР, но показатели специфичности
Список литературы Использование аберрантно метилированных генов SEPT9 и ViM для клинической диагностики колоректального рака
- Jones P.A., Baylin S.B. 2007. The Epigenomics of Cancer. Cell. 2007;128: 683-692.
- Wild N., Andres H., Rollinger W., et al. A combination of serum markers for the early detection of colorectal cancer. Clin Cancer Res. 2010;16(24):6111-21 DOI: 10.1158/1078-0432.CCR-10-0119
- Leon S.A., Shapiro B., Sklaroff D.M., Yaros M.J. Free DNA in the serum of cancer patients and the effect of therapy. Cancer Res. 1977;37: 646-650.
- Russell S.E.H., Hall P.A. Do septins have a role in cancer? Br. J. Cancer. 2005;93: 499-503.
- Kinoshita M., Noda M. Roles of septins in the mammalian cytokinesis machinery. Cell Struct Funct. 2001;26: 667-670.
- Joo E., Tsang C.W., Trimble W.S. Septins: traffic control at the cytokinesis intersection. Traffic Cph. Den. 2005;6: 626-634.
- McDade S.S., Hall P.A., Russell S.E.H. Translational control of SEPT9 isoforms is perturbed in disease. Hum Mol Genet. 2007;16: 742-752.
- Estey M.P., Di Ciano-Oliveira C., Froese C.D., Bejide M.T., Trimble W.S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. J Cell Biol. 2010;191: 741-749.
- Zou H., Harrington J.J., Shire A.M., et al. Highly methylated genes in colorectal neoplasia: implications for screening. Cancer Epidemiol Biomarkers Prev. 2007 Dec;16(12):2686-96.
- Brenner D.E., Rennert G. Fecal DNA biomarkers for the detection of colorectal neoplasia: attractive, but is it feasible? J Natl Cancer Inst. 2005; 97: 1107-9.
- Schneider K.U., Dietrich D., Fleischhacker M., et al. Correlation of SHOX2 Gene Amplification and DNA Methylation in Lung Cancer Tumors. BMC Cancer. 2011 Mar 22;11:102 DOI: 10.1186/1471-2407-11-102
- Mikeska T., Craig J.M. DNA Methylation Bio-markers: Cancer and Beyond. Genes. 2014;5:821-864.
- Linardou H., Briasoulis E., Dahabreh I.J., et al. 2011. All about KRAS for clinical oncology practice: gene profile, clinical implications and laboratory recommendations for somatic mutational testing in colorectal cancer. Cancer Treat. Rev. 2011;37: 221-233.
- Ying H.-Q., Wang F., He B.-S., et al. The involvement of Kras gene 3’-UTR polymorphisms in risk of cancer and influence on patient response to anti-EGFR therapy in metastatic colorectal cancer: a meta-analysis. OncoTargets Ther. 2014;7: 1487-1496.
- Кит О.И., Водолажский Д.И., Дваденко К.В., et al. 2016. Аберрантное метилирование промоторных участков генов APC, CDH13 и MGMT у больных колоректальным раком. Сибирский Онкологический Журнал. 2016;15: 48-55.
- Cerottini J.P., Caplin S., Saraga E., Givel J.C., Benhattar J. The type of K-ras mutation determines prognosis in colorectal cancer. Am J Surg. 1998;175: 198-202.
- Беляева А.В. Мутации в гене K-RAS у больных колоректальным раком. Автореф. дис....канд. мед. наук. Спб.: 2012.-27 с.


