Использование ДНК маркеров в диагностике наследственных мутаций у крупного рогатого скота и свиней
Автор: Ахметов Т.М., Тюлькин С.В., Нургалиев Ф.М., Вафин Р.Р.
Статья в выпуске: 2 т.210, 2012 года.
Бесплатный доступ
В данной работе представлены результаты оптимизированных нами протоколов проведения ДНК-анализа по индикации и идентификации генотипов по генам CD 18, SLC 35 A 3 и RYR 1. Исследования показали, что оптимизированные нами протоколы позволяют достоверно и эффективно выявлять наследственные мутации у крупного рогатого скота ( BLAD и CVM) и свиней (стрессового синдрома).
Протокол, мутация, маркёр, пцр, днк
Короткий адрес: https://sciup.org/14287550
IDR: 14287550 | УДК: 636.2.034:636.2.082.
Текст научной статьи Использование ДНК маркеров в диагностике наследственных мутаций у крупного рогатого скота и свиней
Насыщение отечественного рынка продовольствия качественными продуктами в достаточном объёме невозможно без интенсификации животноводства, где одной из составляющих является эффективная селекция. Сегодня уже ни у кого не вызывает сомнения эффективность использования генетических маркёров, таких как группы крови, биохимические белки, ферменты, а также новых маркёров, выявляемых с помощью полимеразной цепной реакции (ПЦР). Применение такой маркёрной технологии в селекции позволяет выявлять генетические дефекты и прогнозировать генетический потенциал продуктивности животных сразу после рождения (Г.М. Гончаренко, 2009).
Широкий обмен генетическим материалом между странами сопровождается распространением различных инфекционных заболеваний, а также заболеваний, вызываемых редкими мутациями, возникающими у выдающихся представителей коммерческих пород. В отдельных случаях наблюдается высокая скорость распространения таких мутаций. Огромный экономический ущерб обусловливает необходимость строгого генетического контроля импортируемого генетического материала, а также изучение возможных механизмов распространения мутаций (В.И. Глазко и др., 2001; А.Е. Маріуца, 2005).
К таким наследственным заболеваниям относят у крупного рогатого скота дефицит лейкоцитарной адгезии – BLAD (Р.В. Биккинин, 2007), комплексное уродство позвоночника – CVM (Y. Kanae et al., 2005;) и у свиней стрессовый синдром – RYR1 (E. Nakajima et al., 1996; Г.М. О.В. Плужникова, 2009).
В связи с этим исследования, посвященные оптимизации протоколов ДНК-диагностики мутаций ( BLAD , CVM и RYR1 ), являются актуальными.
Материал и методика исследований. Для проведения ДНК-диагностики у крупного рогатого скота и свиней были отобраны пробы крови. Кровь, полученную у животных, вносили в пробирки с 100 мМ ЭДТА до конечной концентрации 10 мМ.
ДНК из крови выделяли комбинированным щелочным способом: 100 мкл крови смешивали с 1 мл дистиллированной воды и центрифугировали при 10000 об/мин в течение 10 мин. Супернатант отбрасывали, а к осадку добавляли 50 мкл 0,2 М NaOH и тщательно встряхивали смесь на вортексе при комнатной температуре до просветления суспензии. Полученный гомогенат выдерживали в термостате при 600С в течение 10 мин. К лизату добавляли равный объем (50 мкл) 1М Трис-HCl (pH 8,0) и тщательно встряхивали смесь на вортексте при комнатной температуре. К полученному гомогенату добавляли 500 мкл 96% этанола и выдерживали полученную смесь при -200С в течение 30 мин. Нуклеопротеидный комплекс осаждали центрифугированием при 12000 об/мин в течение 10
мин. Супернатант отбрасывали, а осадок высушивали при 600С в течение 12 мин с открытой пробиркой. К высушенному осадку добавляли 100 мкл 10% аммиака, тщательно встряхивали смесь на вортексе при комнатной температуре и выдерживали в термостате при 600С в течение 10 мин, затем повторно встряхивали на вортексе и выдерживали в термостате при 600С в течение 10 мин. Полученный гомогенат выдерживали в термостате при 950С в течение 15 мин с открытой пробиркой.
Анализ BLAD -мутации. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl 2 , 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, по 0,5 мкМ праймеров BLAD-F: 5/–TCCGGAGGGCCAAGGGCTA-3/ и BLAD-R: 5/-GAGTAGGAGAGGTCCATCAGGTAGTACAGG-3/, сконструированных К.Е. Грир и др. (C.E. Greer et al., 1991) для амплификации фрагмента гена CD 18 длиной 58 пар нуклеотидов, 1 мкл пробы ДНК в следующем режиме:
×1:94 0С – 4 мин; ×40:94 0С – 20 сек, 69 0С – 20 сек, 72 0С – 20 сек;
×1:72 0С – 7 мин; хранение: 4 0С.
Для выявления BLAD -мутации 20 мкл ПЦР пробы обрабатывали 5 ед. эндонуклеазы рестрикции Hae III в 1×буфере «С» фирмы СибЭнзим (Россия) при 37 0С течение ночи.
Анализ CVM -мутации. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, по 0,5 мкМ праймеров CVM-F: 5/-CACAATTTGTAGGTCTCACTGCA-3/ и CVM-R: 5/-CGATGAAAAAGGAACCAAAAGGG -3/, сконструированных Ю. Канае и др. (Y. Kanae et al., 2005) для амплификации фрагмента гена SLC35A3 длиной 233 пар нуклеотидов, 1 мкл пробы ДНК в следующем режиме:
×1:94 0С – 4 мин; ×40:94 0С – 15 сек, 65 0С – 15 сек, 72 0С – 15 сек;
×1:72 0С – 7 мин; хранение: 4 0С.
Для выявления CVM -мутации 20 мкл ПЦР пробы обрабатывали 5 ед. эндонуклеазы рестрикции PstI в 1×буфере «О» фирмы СибЭнзим (Россия) при 37 0С течение ночи.
Анализ локуса гена RYR1. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, 0,5 мкМ праймера RYR1-F: 5/-CCACACCCTCCCCGCAAGTGC-3/, 0,5 мкМ праймера RYR1-R: 5/-GCCAGGGAGCAAGTTCTCAGTAAT-3/, сконструированных Т.Д. Луерце и др. (T.D. Luerce et al., 2009) для амплификации фрагмента гена RYR1 длиной 144 пары нуклеотидов, 1 мкл пробы ДНК в следующем режиме:
×1:94 0С – 4 мин; ×40:94 0С – 10 сек, 56 0С – 10 сек, 72 0С – 10 сек;
×1:72 0С – 7 мин; хранение: 4 0С.
Для определения аллельного полиморфизма гена RYR1 по вариантам N и n 20 мкл ПЦР пробы обрабатывали 5 ед. эндонуклеазы рестрикции HspAI в 1×буфере «Y» фирмы СибЭнзим (Россия) при 370C в течение ночи.
Детекция. Для визуализации фрагментов ДНК пробы вносили в лунки 4% агарозного геля с содержанием этидия бромида (0,5 мкг/мл) и проводили горизонтальный электрофорез при 15 В/см в течение 40 мин в 1×ТВЕ буфере.
После электрофореза гель просматривали в УФ-трансиллюминаторе при длине волны 310 нм. Идентификацию генотипов определяли по количественным и качественным признакам ПЦР-ПДРФ.
Результаты собственных исследований. Для оценки качества работы известного протокола по выявлению у крупного рогатого скота BLAD -мутации нами была протестирована пара олигонуклеотидных праймеров: BLAD-F: 5/-TCCGGAGGGCCAAGGGCTA-3/ и BLAD-R: 5/-GAGTAGGAGA-GGTCCATCAGGTAGTACAGG-3/, сконструированных К.Е. Грир и др. (C.E. Greer et al., 1991) по оптимизированной нами технике ПЦР-ПДРФ.
Праймеры BLAD-F+BLAD-R инициируют амплификацию ПЦР-фрагмента для выявления BLAD -мутации крупного рогатого скота длиной 58 bp (рис. 1). ПДРФ- HaeIII профиль здоровых животных – 49/9 bp, больных животных –30/19/9 bp, а животных-носителей BLAD -мутации – 49/30/19/9 bp.
Для оценки качества работы известного протокола по выявлению у крупного рогатого скота CVM -мутации нами были протестированы праймеры CVM-F: 5/-CACAATTTGTAGGTCTCACTGCA-3/ и CVM-R: 5/-CGATGAAA-AAGGAACCAAAAGGG-3/, сконструированных Ю. Канае и др. (Y. Kanae et al., 2005) по оптимизированной нами технике ПЦР-ПДРФ.
Праймеры CVM-F+ CVM-R инициируют амплификацию фрагмента для выявления CVM -мутации крупного рогатого скота длиной 233 bp (рис. 2). ПДРФ- PstI профиль здоровых животных = 212 bp (генотип TV / TV ), больных животных = 233 bp (генотип CV/CV ), а животных-носителей CVM -мутации = 233/212 bp (генотип CV / TV ).
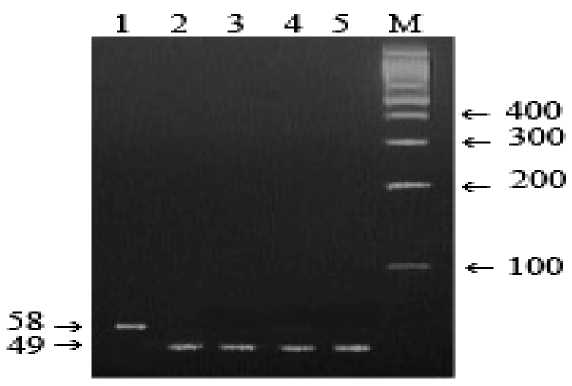
Рис. 1. Электрофореграмма результата ПЦР-ПДРФ для выявления у крупного рогатого скота BLAD -мутации с праймерами BLAD-F+BLAD-R и эндонуклеазным расщеплением HaeIII
Обозначения: 1) цельный ПЦР-фрагмент гена CD 18 (58 bp); 2-5) генотип с отсутствием BLAD -мутации; М) ДНК-маркеры 1000-100 bp (СибЭнзим).
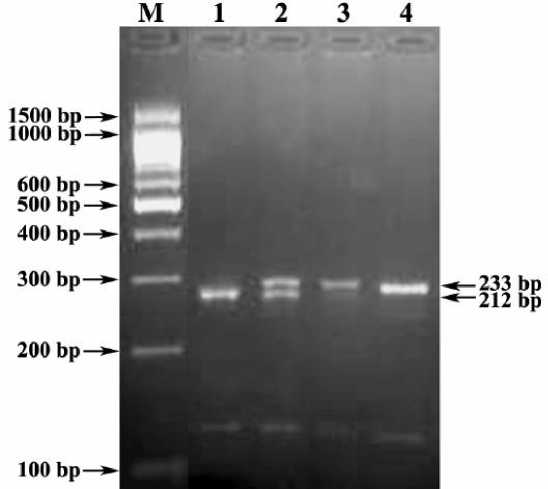
Рис. 2. Электрофореграмма PCR - PIRA -PstI –профилей генотипов гена SLC35A3 кр.рог.ск, сопряженного с CVM -мутацией
Обозначения: М) ДНК-маркеры 1500-100 bp (СибЭнзим); 1-3) PCR-RIPA- PstI -профили: 1) генотип TV / TV (212 bp) [отсутствие носительства CVM -мутации], 2) генотип CV / TV (233/212 bp) [гетерозиготное носительство CVM -мутации], 3) генотип CV / CV (233 bp) [гомозиготное носительство CVM -мутации]; 4) цельный ПЦР-фрагмент локуса гена SLC35A3 кр.рог.ск. (233 bp).
Для оценки качества работы известного протокола генотипирования свиней по гену RYR1 нами были протестированы праймеры RYR1-F: 5/-CC-ACACCCTCCCCGCAAGTGC-3/ и RYR1-R: 5/-GCCAGGGAGCAAGTTCTC-AGTAAT-3//, сконструированные Т.Д. Луерце и др. (T.D. Luerce et al., 2009) по оптимизированной нами технике ПЦР-ПДРФ.
Праймеры RYR1-F+RYR1-R инициируют амплификацию фрагмента гена RYR1 (стрессового синдрома) свиней длиной 144 bp. RYR1- ПДРФ- HspAI -профиль здоровых животных = 102/42 bp (генотип NN ) (рис. 3), больных животных = 144 bp (генотип nn ), а животных-носителей мутантного аллеля n гена RYR1 =144/102/42 bp.
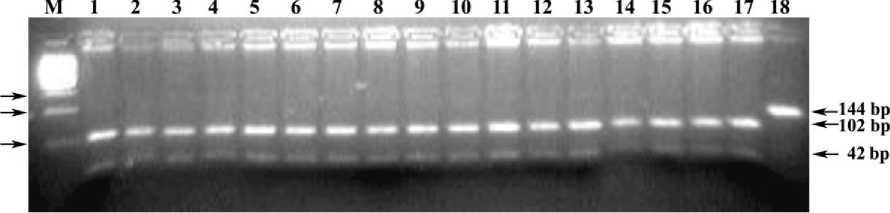
Рис. 3. Электрофореграмма результата ПЦР-ПДРФ гена RYR1 с праймерами RYR1-F+RYR1-R и эндонуклеазным расщеплением HspAI
Обозначения: М) ДНК-маркеры 1500-100 bp (СибЭнзим); 1-17) генотип NN (102/42 bp); 18) цельный ПЦР-фрагмент гена RYR1 (144 bp).
Вывод. Оптимизированные технические приемы ДНК-анализа аллельного полиморфизма генов CD18 , LC35A3 и RYR1 являются эффективными средствами генодиагностики наследственных заболеваний у крупного рогатого скота (BLAD и CVM) и свиней (стрессовый синдром).
ЛИТЕРАТУРА: 1. Биккинин, Р.В. Использование современных методов селекции в совершенствовании бестужевского скота: автореф. дисс канд. с.-х. наук: 06.02.01 / Биккинин Рустям Вагизович. – Уфа, 2007. – 20 с. 2. Глазко, В.И. Введение в ДНК-технологии / В.И. Глазко, И.М. Дунин, Г.В. Глазко, Л.А. Калашникова // М.: ФГНУ
«Росинформагротех», 2001. – 436 с. 3. Гончаренко, Г.М. Генетическая структура популяций сельскохозяйственных животных Западной Сибири и использование маркёров в селекции: автореф. дисс. … докт. биол. наук: 06.02.01 / Гончаренко Галина Моисеевна. – Новосибирск, 2009. – 37 с. 4. Плужникова, О.В. Естественная резистентность, воспроизводительные и мясные качества свиней в связи с их аллельным состоянием по локусу Ryr-1 гена: автореф. дисс. … канд. биол. наук : 06.02.01 / Плужникова Ольга Викторовна. – Ставрополь, 2009. – 19 с. 5. Greer, C.R. PCR amplification from paraffin embedded tissues: Effects of fixative and fixation times / C.R. Greer, S.L. Peterson, N.B. Kiviat, M.M. Manos // American Journal of Clinical
Pathology, 1991. – 95: 117-124. 6. Kanae, Y. A method for detecting complex vertebral malformation in Holstein calves using polymerase chain reaction– primer introduced restriction analysis / Y. Kanae, D. Endoh, H. Nagahata, M. Hayashi. // J. Vet. Diagn. Invest. – 2005. – 17: 258-262. 7. Маріуца, А.Е. Популяційно-генетичні механізми адаптації і розповсюдження напівлетальних рецесивних мутацій на прикладі BLAD у великої рогатої худоби: автореф. дис... канд. с.-г. наук: 03.00.15 / Маріуца Алла Ергашівна. – Кieв, 2005. – 22 с. 8. Nakajima, E. Technical note: use of a PCR-single strand conformation polymorphism (PCR-SSCP) for detection of a point mutation in the swine ryanodine receptor (RYR1) gene / E. Nakajima [et al.] // Journal of Animal Science. – 1996. – V. 74. – P. 2904-2906. 9. Luerce, T.D. An improved method for characterization of the mutation associated to porcine stress syndrome by PCR amplification followed by restriction analysis / T.D. Luerce [et al.] // Ciência Rural, Santa Maria. – 2009. – V. 39. – n. 5. – Р. 1577-1580.
ИСПОЛЬЗОВАНИЕ ДНК МАРКЁРОВ В ДИАГНОСТИКЕ НАСЛЕДСТВЕННЫХ МУТАЦИЙ У КРУПНОГО РОГАТОГО СКОТА И СВИНЕЙ
Ахметов Т.М., Тюлькин С.В., Нургалиев Ф.М., Вафин Р.Р.
Резюме
В данной работе представлены результаты оптимизированных нами протоколов проведения ДНК-анализа по индикации и идентификации генотипов по генам CD 18 , SLC35A3 и RYR1 . Исследования показали, что оптимизированные нами протоколы позволяют достоверно и эффективно выявлять наследственные мутации у крупного рогатого скота ( BLAD и CVM ) и свиней (стрессового синдрома).
USE OF DNA MARKERS IN DIAGNOSIS OF HEREDITARY MUTATIONS AT THE CATTLE AND PIGS
Ahmetov T.M., Tjulkin S.V., Nurgaliev F.М., Vafin R.R. Summary
In the given work results of the reports of carrying out of DNA-analysis optimised by us on indication and identification of genotypes on genes CD 18 , SLC35A3 and RYR1 are presented. Researches have shown, that the reports optimised by us allow to tap authentically and effectively hereditary mutations at the cattle ( BLAD and CVM ) and pigs (a stressful syndrome).


