Использование гидродинамических расчетов в выборе сценария эмболизации церебральной артериовенозной мальформации с фистульным компонентом
Автор: Панарин Вячеслав Александрович, Орлов Кирилл Юрьевич, Кривошапкин Алексей Леонидович, Чупахин Александр Павлович, Черевко Александр Александрович, Хе Александр Канчерович, Телегина Надежда Юрьевна, Баранов Виктор Ильич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ангионеврология и нейрохирургия
Статья в выпуске: 3 т.16, 2012 года.
Бесплатный доступ
На локальной математической модели церебральной артериовенозной мальформации (АВМ), состоящей из набора трубок различного диаметра, рассматриваются различные сценарии ее эмболизации. Показано, что наименьший перепад давления на входе в АВМ достигается в случае эмболизации на первом этапе наиболее широкой фистулы, затем крупного и мелкого компартментов мальформации. Проводится сравнение модельных расчетов с результатами эмболизации АВМ у 15 пациентов.
Эмболизация, артериовенозная мальформация, фистула, кровоизлияние
Короткий адрес: https://sciup.org/142140488
IDR: 142140488 | УДК: 616.1
Текст научной статьи Использование гидродинамических расчетов в выборе сценария эмболизации церебральной артериовенозной мальформации с фистульным компонентом
* ФГБУН «Институт гидродинамики им. М.А. Лаврентьева»
СО РАН, 630090, Новосибирск, просп. акад. Лаврентьева, 15 ** ФГБУ «Научно-исследовательский институт физиологии» СО РАМН, 630117, Новосибирск, ул. акад. Тимакова, 4
ВАК 14.01.18
Поступила в редакцию 28 июля 2012 г.
К.Ю. Орлов,
А.Л. Кривошапкин,
А.П. Чупахин,
А.А. Черевко,
А.К. Хе,
Н.Ю. Телегина,
В.И. Баранов, 2012
На локальной математической модели церебральной артериовенозной мальформации (АВМ), состоящей из набора трубок различного диаметра, рассматриваются различные сценарии ее эмболизации. Показано, что наименьший перепад давления на входе в АВМ достигается в случае эмболизации на первом этапе наиболее широкой фистулы, затем крупного и мелкого компартментов мальформации. Проводится сравнение модельных расчетов с результатами эмболизации АВМ у 15 пациентов. Ключевые слова: эмболизация; артериовенозная мальформация; фистула; Onyx; кровоизлияние.
В последнее десятилетие в эндоваскулярном лечении пациентов с церебральными артериовенозными мальформациями достигнуты значительные успехи. Во-мно-гом это стало возможным благодаря появлению нового эмболизирующего неадгезивного материала Onyx. По сравнению с цианакрилатами, использование Onyx позволило повысить радикальность выключения АВМ только методом эмболизации более чем у половины пациентов [1–3].
В то же время остается достаточно высоким процент осложнений, приводящих к инвалидизации (3,8–7,1%) и смерти (1,5– 3,0%) [1–5]. Наиболее тяжкие осложнения связаны с перипроцедуральными кровоизлияниями, частота которых, по разным данным, варьирует от 2,0 до 16,7% [6].
Одной из причин таких кровоизлияний являются изменения гемодинамики, которые происходят в сосудах мальформации и окружающих узел «здоровых» сосудах мозга в результате частичной или полной эмболизации АВМ. Накопленный клинический опыт позволил выработать ряд правил, придерживаясь которых стало возможным снизить количество таких кровоизлияний. Так, не вызывает дискуссии необходимость многоэтапного выключения АВМ высоких градаций. Замечено, что введение более 5–6 мл Onyx за одну сессию либо окклюзия более 60% объема узла АВМ резко повышают число геморрагических осложнений. Известно, что наибольший риск кровоизлияния возникает при достижении одномоментного субтотального выключения артериовенозной мальформации [2]. Остается нерешенным ряд вопросов, касающихся последовательности выключения различных компартментов АВМ, безопасного объема вводимого эмболизата в каждом конкретном случае. Очевидно, что только понимание гемодинамики артериовенозной мальформации и знание изменений гемодинамических параметров в ходе эмболизации должно лежать в основе разработки мер эффективной профилактики периоперационных кровоизлияний.
Предоперационное моделирование призвано помочь в определении оптимальной последовательности проведения эмболизации, в оценке степени риска операции и возникновения геморрагических осложнений. Коллективом авторов, состоящим из врачей-нейрохирургов НИИ патологии кровообращения им. акад. Е.Н. Мешал-кина, ученых НИИ гидродинамики им. акад. М.А. Лаврентьева СО РАН и НИИ физиологии СО РАМН, проводится совместная работа по моделированию изменений гемодинамики артериовенозной мальформации в процессе эмболизации с целью разработки алгоритма эмболизации артериовенозной мальформации низкого риска.
МАТЕРИАЛ И МЕТОДЫ
За период с января 2011 по июнь 2012 г. 115 пациентам было выполнено 176 эндоваскулярных процедур.
У 15 (13%) пациентов в структуре АВМ были выявлены одна или несколько прямых артериовенозных фистул (АВФ). Распределение этих 15 пациентов по классификации Spetzler – Martin было следующим: II – 1, III – 5, IV – 8, V – 1 . В качестве основного эмболизирующего материала применялся Onyx 18. Для закрытия прямых фистул мы использовали отделяемые микроспирали, после формирования конгломерата спиралей между витками последних вводился Onyx. По нашему мнению, этот способ закрытия прямых фистул более управляемый и безопасный, чем традиционно используемое в этих случаях введение цианакрилатной смеси высокой (80%) концентрации. Для введения Onyx в узел АВМ использовались исключительно микрокатетеры с отделяемой дистальной частью (Apollo 1,5F, ev3, Sonic 1,2F, 1,5F, Balt Extrusion).
РЕЗУЛЬТАТЫ
На примере локальной модели гипотетической АВМ рассмотрим различные сценарии ее эмболизации, отличающиеся последовательностью выключения различных участков. Локальная модель мальформации (рис. 1) строится следующим образом: входящая артерия (1) делится на два сосуда (2, 3), каждый из которых формирует рацемозный компартмент, моделируемый пакетом мелких трубок (4, 5). Далее сосуды собираются в общую вену (6). Между артериальной и венозной частями имеется также прямая фистула – сосуд наибольшего диаметра, через который шунтируется большая часть крови. Данная модель представляет собой граф. Сосуды моделируются трубами с жесткими стенками нулевой шероховатости, по которым течет жидкость плотности ρ = 998кг/м3и вязкости µ = 4,2 мПа·с.
Для АВМ характерно наличие гипертрофированных артериальных сосудов (афферентов, фидеров), большого количества артериовенозных шунтов, расширенных дренирующих вен. Эта особенность отражена в модели. Также учитывается, что поток крови через мальформацию значительно больше потока у здорового (вылеченного) пациента.
При этом скорость крови в патологических сосудах в несколько раз превышает скорость кровотока у здорового человека [7]. На входе в мальформацию задается постоянное давление p = 100 мм рт. ст., в венозной части давление считается повышенным: p = 19,6 мм рт. ст. (нормальное давление принимается равным 5 мм рт. ст.). Поток крови, проходящий через мальформацию, Q = 750 см3/мин.
Обозначим через f, b1 и b2 операции по эмболизации фистулы и рацемозных клубков (4), (5) соответственно. Возможны следующие сценарии эмболизации: (b1+ b2) + f, (f + b1) + b2, (f + b2) + b1. При этом запись (b1+ + b2) + f означает, что на первом этапе операции заклеиваются клубки (4) и (5), а на втором этапе – фистула.
Эмболизация первого или второго, а также обоих рацемозных клубков мальформации практически не отражается на общей картине течения (рис. 2). Эта операция позволяет добиться лишь снижения скорости кровотока на этих участках. Окклюзия фистулы практически полностью нормализует венозное давление до p = 7 мм рт. ст. При этом увеличивается кровоток через рацемозные участки АВМ. Результаты одновременной эмболизации фистулы и первого, более мелкого клубка АВМ (f + b1) мало чем отличаются от операции f .
Операция (f + b2) приводит к явному уменьшению расхода через мальформацию Q = 430 см3/мин. Венозное давление нормализуется до p = 5,24 мм рт. ст. Полная эмболизация возможна при Q = 405 см3/мин. Отметим, что наибольшую опасность с точки зрения «скачка» давления в мальформации представляет одновременная эмболизация фистулы и наиболее широкого рацемозного участка (операция f+b2 на графике). С другой стороны, поскольку лечение требует полной эмболизации АВМ, важно не допустить максимального скачка давления в аномальных сосудах. Из графиков можно сделать вывод, что наименьший перепад
Рис. 1.
Локальная модель мальформации.
рацемозная № 1 l = 10 см, d = 0,1 см, 40 шт.
l = 15 см, d = 0, 2 см 2
l = 40 см, d = 0, 3 см
l = 6 см, d = 0, 4 см
фистула I = 10 см, d = 0,8 см 5
l = 6 см, d = 0, 2 см l = 20 см, d = 0, 8 см l = 6 см, d = 0, 4 см
рацемозная № 2 l = 4 см, d = 0, 2 см, 10 шт.
Рис. 2.
Изменение давления вдоль рацемозного клубка: а – 4; б – 5.
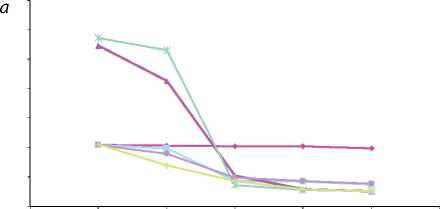
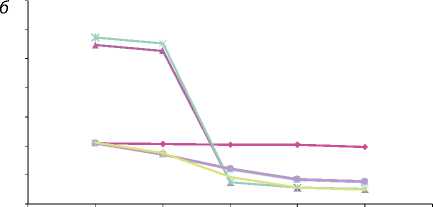
—♦- Мальформация
—Операция b1+f
—•— Операция b2+f
Операция b1+b2
Операция b1+b2+f
Операция f
Без мальформации
давления достигается в случае эмболизации на первом этапе наиболее широкой фистулы, затем крупного и мелкого компартментов мальформации соответственно.
Проведено 30 сеансов эмболизаций 15 пациентам с фистульно-рацемозными АВМ. У троих к настоящему времени лечение закончено: в двух случаях достигнута тотальная, в одном – субтотальная эмболизация АВМ. Остальные продолжают лечение. 14 пациентов удовлетворительно перенесли от 1 до 6 этапов эмболизации, с введением за сеанс от 0,6 до 9 мл Onyx, в среднем 3,3±1,6 мл. В одном случае мы получили тяжелое перипроцедуральное кровоизлияние (3,3% на процедуру, 6,7% на пациента). В качестве иллюстрации различных сценариев эмболизации АВМ, приведших к различным исходам, приводим два клинических наблюдения.
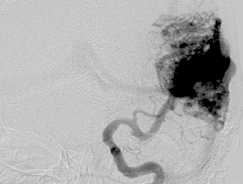
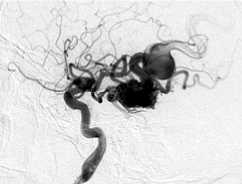
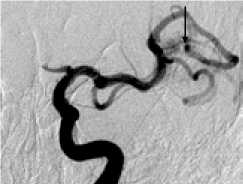
Пациентка Б., 36 лет, госпитализирована с диагнозом: артериовенозная мальформация левой височной доли, торпидное течение. Ангиографически в проекции левой височной доли визуализировался узел артериовенозной мальформации, в максимальном измерении до 65 мм, с афферентами из височных ветвей средней и задней мозговых артерий. Дренирование осуществлялось в сигмовидный синус (IV градация по Spetzler – Martin) (рис. 3, а, б ). В структуре АВМ определялась прямая фистула между ветвью средней височной артерии и дренирующей веной (рис. 3, б, в ).
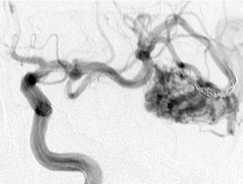
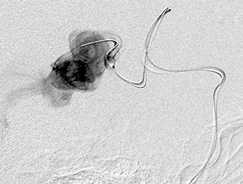
Принято решение о многоэтапном лечении. На первом этапе мы ограничились выключением прямой фистулы (рис. 3, г ). В последующем выполнено еще пять этапов эмболизации, с введением за один этап не более 5 мл
Onyx. Достигнуто тотальное тромбирование АВМ. Пациентка выписана без неврологического дефицита.
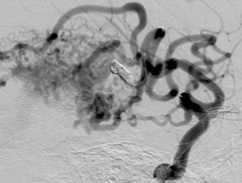
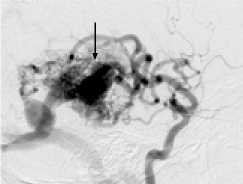
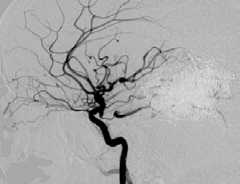
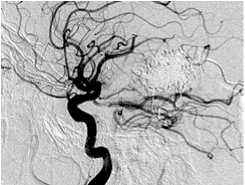
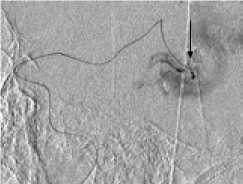
Другой пример. Пациент Ш., 46 лет, госпитализирован с диагнозом: АВМ левой височной доли, симптоматическая эпилепсия. Локализация и источники васкуляризации данной АВМ были схожи с предыдущей, но размеры узла существенно меньше – до 3 см (II градация по Spetzler – Martin) (рис. 4, а ). Один из афферентов АВМ, являвшийся конечной ветвью средней височной артерии, участвовал в формировании прямой артериовенозной фистулы (рис. 4, б, в ). В начале операции была эмболизи-рована прямая фистула (рис. 4 , г ). С учетом «низкой» градации АВМ было принято решение о продолжении эмболизации. В узел мальформации было введено 8 мл Onyx, достигнуто тотальное тромбирование АВМ (рис. 4, д ).
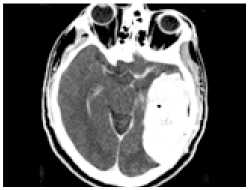
Однако уже при выполнении контрольной ангиографии было отмечено появление экстравазации контраста вблизи тени эмболизата, с дислокацией ветвей левой средней мозговой артерии. Экстренно проведенная КТ показала развитие обширного внутримозгового кровоизлияния в левой височной доле (рис. 4 , е ). Пациент был подвергнут экстренной операции в объеме декомпрессивной трепанации и удаления гематомы. Однако клинический исход остался неудовлетворительным: пациент длительно находился в состоянии комы, с выходом в апаллический синдром.
ОБСУЖДЕНИЕ
Исключительная сложность пространственной геометрии артериовенозной мальформации, различные механи-
Рис. 3.
Этапная тотальная эмболизация АВМ левой височной доли, V градации по Spetzler – Martin: а – передне-задняя проекция; б – латеральная проекция, видна прямая АВФ (стрелка); в – суперселективная ангиография из префистульного участка афферента; г – эмболизация фистулы микроспиралями Onyx (первый этап); д – тотальная эмболизация АВМ после шести этапов лечения.
Рис. 4.
Одноэтапная эмболизация АВМ левой височной доли, II градации по Spetzler – Martin: а – латеральная проекция, варикоз дренирующей вены; б, в – прямая АВФ в структуре АВМ (стрелка); г – эмболизация фистулы микроспиралями; д – тотальная эмболизация АВМ; е – на КТ после операции обширная внутримозговая гематома левой височной доли.
б
д
д
е
ческие свойства формирующих ее сосудов, активность их стенок, учет влияния форменных элементов крови, наличие физиологических механизмов регуляции мозгового кровообращения, отсутствие полных экспериментальных данных о кровотоке объясняют отсутствие в настоящее время адекватной гемодинамической модели АВМ [9–15]. Несмотря на то что описанная локальная модель АВМ имеет очевидные упрощения и недостатки, присущие большинству существующих моделей, проведенные на ней расчеты согласуются с нашими результатами лечения.
ВЫВОДЫ
-
1. При наличии в структуре АВМ прямой артериовенозной фистулы независимо от градации АВМ следует ограничиться выключением фистулы, с разделением эмболизации на этапы.
-
2. Использованная упрощенная модель, являющаяся первым этапом по математическому моделированию изменений локальной гемодинамики АВМ в процессе эмболизации, уже позволила показать и объяснить качественное соответствие клинических и экспериментальных результатов.
Список литературы Использование гидродинамических расчетов в выборе сценария эмболизации церебральной артериовенозной мальформации с фистульным компонентом
- Saatci I., Geyik S., Cekirge H. et al.//J. Neurosurg. 2011. V. 115 (1). Р. 78-88.
- Maimon S., Strauss I., Frolov V. et al.//Am. J. Neuroradiol. 2010. V. 31 (5). Р. 947-954.
- Katsaridis V., Papagiannaki C., Aimar E.//Neuroradiology. 2008. V. 50 (7). Р. 589-597.
- Van Rooij W.J., Sluzewski M., Beute G.N.//Am. J. Neuroradiol. 2007. V. 28 (1). Р. 172-177.
- Panagiotopoulos V., Gizewski E., Asgari S. et al.//Am. J. Neuroradiol. 2009. V. 30 (1). Р. 99-106.
- Liu L., Jiang C., He H. et al.//Interv. Neuroradiol. 2010. V. 16 (1). Р. 47-57.
- Рябухин В.Е., Климов А.Б., Орлов К.Ю. и др. Хирургия аневризм головного мозга. M., 2012. Т. 3. С. 231-269.
- Gao E., Young W.L., Pile-Spellman J. et al.//Neurosurgery. 1997. V. 1 (6). Р. 1345-1356.
- Gao E., Young W.L., Ornstein E. et al.//1997. V. 17 (8). Р. 905-918.
- Guglielmi G.//Neurosurgery. 2008. V. 63 (1). Р. 1-10.
- Hademenos G.J. et al.//Stroke. 1996. V. 27 (6). Р. 1072-1083.
- Ашметов И.В., Буничева А.Я., Мухин С.И. и др. Компьютер и мозг. Новые технологии. М., 2005.
- Педли Т. Гидродинамика крупных кровеносных сосудов. М., 1983.
- Багаев С.Н. и др. Система кровообращения и артериальная гипертония: биофизические и генетико-физиологические механизмы, математическое и компьютерное моделирование. Новосибирск, 2008.


