Использование iPBS маркеров для анализа полиморфизма генотипов озимого ячменя
Автор: Сухинина К.В., Дубина Е.В., Репко Н.В., Давыденко В.Н.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 5, 2025 года.
Бесплатный доступ
Цель исследования – оценить эффективность использования iPBSмолекулярных маркеров для анализа генотипов озимого ячменя российских сортов современной селекции. Для генотипирования были подобраны 15 сортов озимого ячменя различных оригинаторов. Оценка их генетического разнообразия проводилась с использованием 10 iPBSмаркеров. Для подготовки образцов к выделению ДНК семена озимого ячменя предварительно проращивали в чашках Петри на увлажненной фильтровальной бумаге с использованием термостата, исключив доступ света. Выделение ДНК проводили СТАВметодом, после чего выделенную ДНК разводили ТЕбуфером и проверяли концентрацию при помощи флуориметра Qubit. С целью обеспечения высокого выхода амплифицированного продукта использовали следующие условия полимеразной цепной реакции: 5 мин при 94 °С, далее 40 циклов, 30 с при 94 °С, 30 с при 55 °С, 1 мин при 72 °С, 3 мин при 72 °С. Электрофоретическое разделение продуктов ПЦР проводили в течение 1 ч, используя 2 % ТАЕ – агарозный гель. Для визуализации результатов разделения использовали гельдокументирующую систему GelDoc. В результате постановки ПЦР и последующей детекции ее продуктов в диапазоне от 100 до 10000 п.н. четко проявилось 1223 аллеля. Статистическая обработка полученных данных позволила определить степень полиморфности генотипов ячменя на основании PCoA и кластерного анализа, которые в свою очередь показали сходные результаты, разделив образцы на четыре популяции. Полученные результаты дают возможность применять маркерные системы класса iPBS для определения степени полиморфизма генотипов озимого ячменя.
Озимый ячмень, генетический полиморфизм, MEGA, STRUCTURE
Короткий адрес: https://sciup.org/140309755
IDR: 140309755 | УДК: 633.16"324":631.527 | DOI: 10.36718/1819-4036-2025-5-47-61
Текст научной статьи Использование iPBS маркеров для анализа полиморфизма генотипов озимого ячменя
Введение. Ячмень (Hordeum vulgare) – представитель семейства мятликовых и одна из основных сельскохозяйственных культур, возделываемых по всему миру. Несмотря на широкое территориальное распространение культуры, генотипы сортов, возделываемых в промышленных масштабах, схожи ввиду многолетней направленной селекции [1].
Для расширения генотипа в настоящее время селекционеры все чаще обращают внимание на использование в программах скрещиваний диких и полудиких форм, старых сортов, считающихся родоначальниками селекции ячменя, а также иностранных сортов. Включение в систему скрещиваний генотипически отличающихся родительских форм позволит сформировать не только сорт с новым комплексом заданных признаков, но и получить линии с признаками и свойствами, утерянными в результате многолетней селекционной работы [2].
При этом идентификация каждого отдельного сорта, даже на уровне государственного сортоиспытания, ограничивается лишь морфологическим описанием по фенотипическим признакам, на что уходит достаточно длительное время [3]. Важно помнить, что подавляющее большинство сортовых признаков, в зависимости от климатических условий каждого отдельного года, могут варьировать в достаточно широких пределах. Настоящий факт накладывает свой отпечаток на сроки создания сорта, его предполагаемый потенциал, а также достоверность наличия в нем интересующего признака [4].
Все это позволяет говорить о целесообразности использования методов молекулярногенетического анализа в современной систематизации ботанических ресурсов и селекционном процессе в частности.
В настоящее время метод генетического анализа (молекулярного маркирования) для идентификации генотипа признан более достоверным. Он позволяет понять, обладает ли исследуемый образец целевым геном интересующего морфологического признака. Это значительно повышает эффективность селекционной работы и сокращает время, необходимое для создания сорта. Кроме того, при правильном и умелом комплексном сочетании фенотипических и генотипических методов сроки получения современных сортов с заданными характеристиками уменьшаются в разы.
Современные информационные источники обладают внушительным количеством генетических баз, объединяющих в себе исследования ученых всего мира. Также разработано и успешно используется множество молекулярных маркеров, эффективность и надежность которых доказана в исследованиях идентификации генов, отвечающих за фенотипическое проявление хозяйственно ценных признаков [5].
Согласно историческим данным, молекулярные маркеры в селекции растений начали использовать в 1983 г. Такие методы получили название маркер-ориентированной селекции [6]. Принцип работы настоящих методов основывается на установлении прочных, тесных взаимосвязей между геном, отвечающим за фенологическое проявление признака, и молекулярным маркером. Этот способ является не заменой или альтернативой традиционной селекции, а мощным и эффективным дополнительным инструментом в руках ученых на пути к созданию стабильного конкурентоспособного посевного материала российского происхождения.
Использование молекулярных маркеров в селекции основано на принципе генетической связи, так называемого сцепления. Гены, расположенные близко друг к другу на хромосоме, наследуются вместе чаще, чем гены, находящиеся далеко друг от друга [7]. Это явление называется сцепленным наследованием. Если молекулярный маркер тесно сцеплен с целевым геном, контролирующим желаемый признак (например устойчивость к болезням, урожайность, качество продукта), то наличие или отсутствие специфического аллеля маркера может свидетельствовать о наличии или отсутствии желаемого аллеля целевого гена.
В идеальном сценарии селекционеры стремятся идентифицировать маркеры, фланкирующие целевой ген, расположенные по обе стороны от него. Такой подход повышает точность предсказания фенотипа, минимизируя вероятность рекомбинации между маркером и целевым геном [8].
Метод анализа генетического разнообразия растений представляет собой мощный инструмент, успешно применяемый в масштабных исследованиях. Ключевое его преимущество заключается в независимости от предварительного знания полной последовательности генома исследуемых организмов. Это значительно расширяет спектр потенциальных объектов исследования, включая виды с плохо изученным геномом.
Для достижения высокой точности селекционеры проводят картирование генома, чтобы найти маркеры с наибольшей силой сцепления с целевыми генами. Этот процесс включает в себя анализ больших популяций растений, определение фенотипа и генотипа по различным маркерам и использование статистических методов для оценки силы сцепления [9].
Молекулярные маркеры представляют собой участки ДНК с известным местоположением в геноме, которые демонстрируют полиморфизм – вариации в последовательности ДНК между отдельными особями [7]. Этот полиморфизм может быть вызван различными мутациями, такими как однонуклеотидные полиморфизмы (SNPs), вставки-делеции (indels), микросателлиты (STRs) или более крупные структурные вариации. Выбор типа маркера зависит от целей исследования и особенностей генома.
ПЦР и молекулярные маркеры значительно упростили и усовершенствовали селекционные программы, обеспечив возможность эффективного отбора образцов с желаемыми признаками на ранних этапах развития, что существенно сокращает время и затраты на селекцию, а также повышает ее эффективность. Современные методы анализа данных и высокопроизводительные технологии позволяют проводить геномный отбор на беспрецедентном масштабе, открывая новые возможности для улучшения сельскохозяйственных культур.
Молекулярные маркеры, как мощный инструмент современной генетики, эволюционировали от относительно простых и менее точных методов, таких как RAPD и AFLP, до высокоэффективных и информативных, таких как SSR и SNP, которые сегодня активно используются в геномных исследованиях [10].
Существуют и другие группы маркерных систем, однако для проведения филогенетических исследований и установления возможных связей родословных использование iPBS маркеров принято считать наиболее эффективным. Метод iPBS (inter PBS amplification) подразумевает использовании праймеров к участку связывания тРНК к последовательностям ретротранспозонов [11].
Свою эффективность в изучении генетического разнообразия iPBS маркеры подтверждают в работах ряда ученых [5]. Простота и доступность использования делает настоящий метод одним из основных при молекулярно-генетическом анализе сельскохозяйственных культур.
Применение системы iPBS-ретротранспозон-ных маркеров в селекции растений имеет огромный потенциал, особенно в контексте адаптации к абиотическим стрессам. Анализ генетического разнообразия позволяет выявлять генотипы, обладающие повышенной устойчивостью к неблагоприятным условиям окружающей среды. Идентификация таких генотипов, устойчи- вых к стрессам, позволяет селекционерам создавать новые сорта растений с улучшенными агрономическими характеристиками и большей продуктивностью. Более того, данный метод может использоваться для изучения эволюционных процессов, понимания генетической структуры популяций и оценки их адаптационного потенциала. В целом система iPBS-ретро-транспозонных маркеров представляет собой прогрессивный метод с широкими перспективами применения в современной генетике и селекции растений [12].
Все это позволяет использовать систему маркеров iPBS для изучения генетического разнообразия популяционной структуры имеющейся коллекции озимого ячменя, разработки селекционных программ, а также установления степени родства между изучаемыми объектами.
Цель исследований – оценить эффективность использования iPBS молекулярных маркеров для анализа генотипов озимого ячменя российских сортов современной селекции.
Материалы и методы. Для оценки генетического разнообразия 15 сортов озимого ячменя четырех оригинаторов были использованы 10 iPBS праймеров, нуклеотидная последовательность которых представлена в таблице 1. На основании ряда экспериментов в условиях амплификации температура отжига праймеров на уровне 55 °С показала наиболее четкие электрофоретические спектры.
Для оценки генетического разнообразия использовали 15 сортов озимого ячменя российской селекции четырех оригинаторов. Изученные сорта внесены в Государственный реестр селекционных достижений (табл. 2).
Таблица 1
|
Праймер |
Последовательность олигонуклеотидов |
Температура отжига праймера, °С |
|
2373 |
GAACTTGCTCCGATCCCA |
55 |
|
2074 |
GCTCTGATACCA |
55 |
|
2228 |
CATTGGCTCTTGATACCA |
55 |
|
2415 |
CATCGTAGGTGGGCGCCA |
55 |
|
2230 |
TCTAGGCGTCTGATACCA |
55 |
|
2075 |
CTCATGATGCCA |
55 |
|
2078 |
GCGGAGTCGCCA |
55 |
|
2237 |
CCCCTACCTGGCGTGCCA |
55 |
|
2374 |
CCCAGCAAACCA |
55 |
|
2375 |
TCGCATCAACCA |
55 |
Таблица 2
|
Сорт |
Оригинатор |
Разновидность |
|
1 |
2 |
3 |
|
Рубеж |
ФГБНУ НЦЗ им. П.П. Лукьяненко |
parallelum |
|
Молот |
ФГБНУ НЦЗ им. П.П. Лукьяненко |
parallelum |
|
Ларец |
ФГБНУ АНЦ «Донской» |
parallelum |
|
Каррера |
ООО «Агростандарт» |
parallelum |
|
Лайс |
ООО «Агростандарт |
pallidum |
|
Шелк |
ООО «Агростандарт» |
pallidum |
|
Сельхоз |
ООО «Агростандарт»; ФГБОУ ВО Кубанский ГАУ |
parallelum |
|
Агродеум 21 |
ФГБОУ ВО Кубанский ГАУ |
nutans |
|
Агродеум 11 |
ФГБОУ ВО Кубанский ГАУ |
nutans |
|
Тимофей |
ФГБНУ АНЦ «Донской» |
parallelum |
|
Ерема |
ФГБНУ АНЦ «Донской» |
parallelum |
Окончание табл. 2
|
1 |
2 |
3 |
|
Жигули |
ФГБНУ АНЦ «Донской» |
parallelum |
|
Романс |
ФГБНУ НЦЗ им. П.П. Лукьяненко |
parallelum |
|
Преемник |
ФГБНУ НЦЗ им. П.П. Лукьяненко |
parallelum |
|
Платон |
ФГБНУ НЦЗ им. П.П. Лукьяненко |
parallelum |
Молекулярные маркеры, использованные в работе
Molecular markers used in the work
Использованные в работе сорта озимого ячменя
Varieties of winter barley used in the work
Для подготовки образцов к выделению ДНК семена озимого ячменя предварительно проращивали в чашках Петри на увлажненной фильтровальной бумаге с использованием термостата, исключив доступ света. Выделение ДНК проводили СТАВ-методом, после чего выделенную ДНК разводили ТЕ-буфером и проверяли концентрацию при помощи флуориметра Qubit.
С целью обеспечения высокого выхода ам-плифицированного продукта использовали следующие условия полимеразной цепной реакции: 5 мин при 94 °С, далее 40 циклов, 30 с при 94 °С, 30 с при 55 °С, 1 мин при 72 °С, 3 мин при 72 °С.
Электрофоретическое разделение продуктов ПЦР проводили в течение 1 ч, используя 2 % ТАЕ – агарозный гель. Для визуализации результатов разделения использовали гель-документирующую систему GelDoc.
Полученные в результате ПЦР продукты использовали для генотипирования, при этом во внимание принимались лишь четкие электрофоретические полосы или так называемые бенды. Дальнейший анализ в программе MS Excel подразумевал учет наличия и отсутствия бен-дов на снимке, наличие полосы принималось за 1, а отсутствие за 0. Затем, используя макрос GenAlex, была проведена обработка методом главных координат (PCoA) [13]. Построена дендрограмма изучаемых генотипов ячменя с использованием программы MEGA11. Программа STRUCTURE позволила провести структурный анализ популяции на основании полученного массива данных [14].
Результаты и их обсуждение. При исследовании генетического разнообразия 15 сортов озимого ячменя использовалось 10 iPBS-маркеров. В результате их применения выявлено, что они обладают разным уровнем полиморфизма (рис. 1–10, где М – маркер молекулярного веса; 1–15 – генотипы растений ячменя).
В результате ПЦР реакций с использованием праймерной пары iPBS 2373, в диапазоне от 100 до 10000 п.н., четко проявились 80 бендов, при этом в исследуемых образцах число аллелей варьировало от 3 до 10 полос.
Ml 2 3 4 5 6 7 8 9 10 11 12 13 14 15
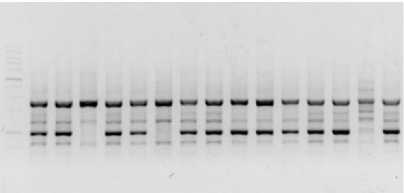
Рис. 1. Визуализация продуктов ПЦР с применением маркера 2373 Visualization of PCR products using marker 2373
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
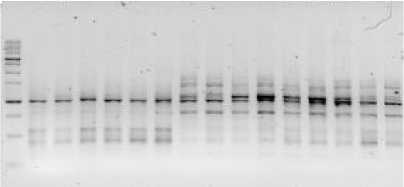
Рис. 2. Визуализация продуктов ПЦР с применением маркера 2074 Visualization of PCR products using marker 2074
M 1 2 3 4 5 6 7 8 9 IO 11 12 13 14 13
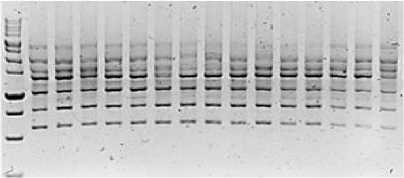
Рис. 3. Визуализация продуктов ПЦР с применением маркера 2228 Visualization of PCR products using marker 2228
Используя маркер iPBS 2228, выделено 122 четких полиморфных аллелей, при этом их диапазон менялся от 2 до 10 в пределах одного генотипа.
Маркер iPBS 2074, как показывает рисунок 2, содержит 114 ДНК-бендов, в среднем 8 аллей на один генотип.
Ml 2 3 4 5 6 7 8 9 10 11 12 13 14 15
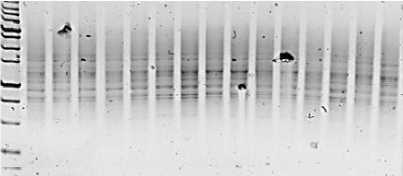
Рис. 4. Визуализация продуктов ПЦР с применением маркера 2415 Visualization of PCR products using marker 2415
Детекция продуктов амплификации с использованием маркера iPBS 2415 позволила визуализировать в общей сложности 112 полос в 15 генотипах. При этом в образцах с 1-го по 9-й число ДНК-бендов достигало 12, с 10-го по 15-й не превышало 9.
Анализ использования праймерной пары 2230 показал 101 бенд, наибольшее количество (9 и 10) наблюдалось в образцах под номерами 10, 13 и 14 соответственно. Наименьшее в образце 15 - 3 аллеля.
Ml 2 3 4 5 6 7 8 9 10 11 12 13 14 15
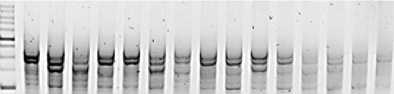
Рис. 5. Визуализация продуктов ПЦР с применением маркера 2230 Visualization of PCR products using marker 2230
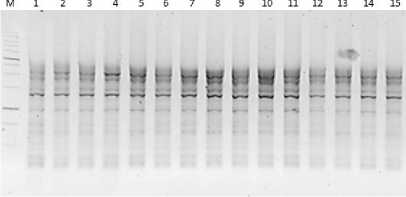
Рис. 6. Визуализация продуктов ПЦР с применением маркера 2075 Visualization of PCR products using marker 2075
м 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
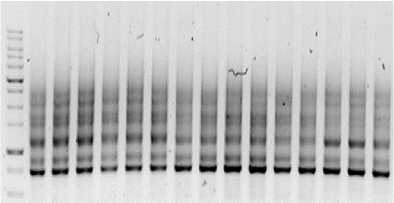
Рис. 7. Визуализация продуктов ПЦР с применением маркера 2078 Visualization of PCR products using marker 2078
Маркер iPBS 2078 позволил увидеть и насчитать 114 бендов на электорфореграмме, при этом число полос в одном генотипе не превышало 10.
От 10 до 16 аллелй в образце было визуализировано при использовании маркера iPBS 2075.
Детекция продуктов амплификации с использованием маркера iPBS 2237 позволила визуа- лизировать в общей сложности 109 аллелей в 15 генотипах с вариацией от 6 до 10 бендов на образец.
Анализ применения маркера iPBS 2374 в 15 образцах показал 178 электрофоретических полос. При этом следует отметить, что в номерах 8 и 9 число ДНК-бендов не превышало 6, но при этом сформировало 19 бендов в образце номер 3.
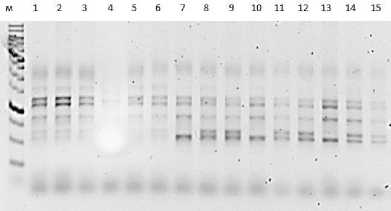
Рис. 8. Визуализация продуктов ПЦР с применением маркера 2237 Visualization of PCR products using marker 2237
Ml 2 3 4 5 б 7 8 9 10 11 12 13 14 15
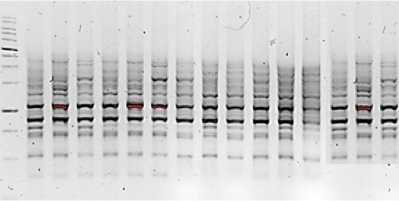
Рис. 9. Визуализация продуктов ПЦР с применением маркера 2374 Visualization of PCR products using marker 2374
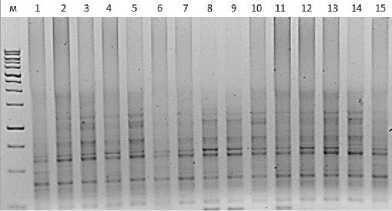
Рис. 10. Визуализация продуктов ПЦР с применением маркера 2375 Visualization of PCR products using marker 2375
От 3 до 12 бендов в электрофоретическом спектре на образец проявилось с применением маркера iPBS 2306.
По итогу проведения комплекса полимеразных цепных реакций с 10 iPBS праймерами, в диапазоне от 100 до 10000 п.н., четко проявились 1223 электрофоретические полосы. При этом сорт Тимофей показал меньшее значение, сформировав 65 бендов, сорт Каррера показал 95 бендов, превысив показатели всех остальных образцов.
Для расчета генетического разнообразия исследованных генотипов использовался дополнительный макрос MS Excel – AMOVA (табл. 3).
Таблица 3
|
Сорт |
О СК О- £ Z 2 |
S X S t о ° ^ _ S Ф ф Н ™g " Z О Ь ? m Ф 1 о о о |
о — m ° i^g m § s ° £ о х о |
Ф -0 а^ § i о о |
о о О о с 00 х аз |
н - 3 |
f О |
|
Рубеж |
1 |
88 |
|||||
|
Молот |
1 |
89 |
|||||
|
Платон |
1 |
80 |
|||||
|
Преемник |
1 |
72 |
|||||
|
Романс |
1 |
74 |
142 |
48,56 |
7 |
0,279 |
0,189 |
|
Тимофей |
2 |
64 |
|||||
|
Ларец |
2 |
92 |
|||||
|
Жигули |
2 |
68 |
|||||
|
Ерема |
2 |
73 |
146 |
59,13 |
9 |
0,369 |
0,257 |
|
Каррера |
3 |
95 |
|||||
|
Лайс |
3 |
93 |
|||||
|
Шелк |
3 |
92 |
112 |
39,42 |
1 |
0,251 |
0,175 |
|
Сельхоз |
4 |
88 |
|||||
|
Агродеум 21 |
4 |
80 |
|||||
|
Агродеум 11 |
4 |
75 |
113 |
59,13 |
22 |
0,376 |
0,263 |
|
Всего |
– |
1223 |
513 |
51,56 |
630 |
0,319 |
0,221 |
Результаты анализа генетического разнообразия Results of the analysis of genetic diversity
Данные таблицы 3 показывают, что число аллелей в изучаемых образцах было различным. Анализируя коэффициент полиморфизма среди четырех популяций, стоит отметить, что у второй и четвертой популяций растений он оказался самым высоким и достиг 59,13 %, что говорит о достаточно большом генетическом различии среди образцов настоящих популяций, оригинаторами которых являются ФГБНУ АНЦ «Донской» и ФГБОУ ВО Кубанский ГАУ соответственно. Анализ массива данных выявил, что процент полиморфных локусов в популяциях был достаточно высок – 51,6 %. Однако самые низкие значения показали популяции, состоящие состоящей из сортов, оригинатором которых является Агростандарт – 39,42 % и ФГБНУ НЦЗ им. П.П. Лукьяненко (48,56 %), что позво- ляет сделать вывод о их более однородном генетическом составе относительно двух других популяций. Количество частных полос, или иначе говоря – специфичных аллелей, варьировало от 1 в третьей популяции до 22 в четвертой. Первая и вторая популяции показали 7 и 9 аллелей соответственно.
Числовые выражения индексов Шеннона и разнообразия оказались близки в популяциях один и три, а также два и четыре. Для первой популяции – 0,279 и 0,189, для второй – 0,369 и 0,257, для третьей – 0,251 и 0,175, для четвертой – 0,376 и 0,263. Оба параметра показали, что уровень генетического разнообразия четвертой популяции, несмотря на ее малочисленный состав, оказался более высоким относительно других популяций.
Анализ молекулярной дисперсии проводился с учетом внутрипопуляционных и межпопуляционных различий (рис. 11) и показал, что проанализированные образцы в большей сте- пени отличались внутри популяции, чем попу ляции между собой.
Расчет взаимосвязей между генотипами яч меня производился с использованием програм мы MS Excel (табл. 4).
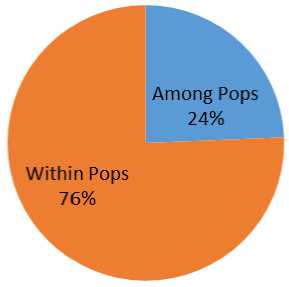
Рис. 11. Процент молекулярной дисперсии генотипов озимого ячменя Percentage of molecular dispersion of winter barley genotypes
Таблица 4
|
CD CO CL |
1— О 1 |
=r CD ^ |
co CD S’ |
О |
CD 3 |
co О X CD О |
CM s CD |
CD О |
>s CD -8-o |
co CD Ш |
s 1_______ |
о co о CL |
CD CD EZ |
X о co 1= |
|
|
0 |
Рубеж |
||||||||||||||
|
35 |
0 |
Молот |
|||||||||||||
|
44 |
41 |
0 |
Ларец |
||||||||||||
|
59 |
60 |
47 |
0 |
Каррера |
|||||||||||
|
53 |
58 |
61 |
34 |
0 |
Лайс |
||||||||||
|
64 |
59 |
62 |
47 |
45 |
0 |
Шелк |
|||||||||
|
68 |
61 |
68 |
49 |
45 |
46 |
0 |
Сельхоз |
||||||||
|
86 |
85 |
90 |
89 |
83 |
94 |
78 |
0 |
Агродеум 21 |
|||||||
|
81 |
78 |
79 |
90 |
86 |
87 |
73 |
49 |
0 |
Агродеум 11 |
||||||
|
84 |
85 |
84 |
77 |
81 |
76 |
84 |
78 |
83 |
0 |
Тимофей |
|||||
|
81 |
68 |
85 |
68 |
74 |
81 |
81 |
85 |
86 |
41 |
0 |
Ерема |
||||
|
92 |
97 |
92 |
77 |
83 |
92 |
86 |
74 |
79 |
56 |
67 |
0 |
Жигули |
|||
|
92 |
91 |
102 |
89 |
83 |
82 |
84 |
80 |
83 |
58 |
63 |
58 |
0 |
Романс |
||
|
100 |
103 |
102 |
91 |
99 |
100 |
88 |
84 |
75 |
76 |
79 |
70 |
66 |
0 |
Преемник |
|
|
102 |
105 |
108 |
107 |
103 |
106 |
96 |
100 |
89 |
94 |
95 |
92 |
90 |
90 |
0 |
Платон |
Матрица коэффициентов сходства различия для генотипов ячменя
Matrix of coefficients of similarity of differences for genotypes of barley
Оценка генетических взаимоотношений между образцами озимого ячменя проводилась с помощью PCoA-анализа (рис. 12). Так, сорта разделились на четыре группы. В первую группу входят сорта, оригинатором которых является НЦЗ им. П.П. Лукьяненко, во вторую – ФГБНУ АНЦ «Донской», в третью – сорта фирмы ООО «Агростандарт» и в четвертую – сорта селекции
ФГБОУ ВО Кубанский ГАУ. Согласно рисунку 12, Каррера, Шелк и Лайс расположены очень близко друг к другу, что говорит о генетическом сходстве. Так как оригинатором этих сортов является ООО «Агростандарт», логично предположить, что их родословные могут содержать генетическую плазму родственных популяций.
Principal Coordinates (PCoA)
|
Ерема Тимофей % РЖомиагунлси |
Каррера ♦ ф Шелк Лайс |
|
♦ Преемник ♦ Платон ♦ Агродеум 21 ♦ Агродеум 11 |
♦ Сельхоз ►♦♦ Ларец Рубеж Молот |
Coord. 1
Рис. 12. График анализа 15 генотипов озимого ячменя
Graph of the analysis of 15 genotypes of winter barley
Аналогичную зависимость можно наблюдать у сортов популяции 3 – Агродеум 21 и Агродеум 11. Однако здесь генетическое расстояние выше, особенно у сорта Сельхоз, являющегося результатом совместной селекции ФГБОУ ВО Кубанский ГАУ и ООО «Агростандарт». Сорта Жигули, Тимофей и Ерема селекции ФГБНУ АНЦ «Донской» обладают более отдаленным генетическим расстоянием, за исключением сорта Ларец, который выделился в другой кластер, приближенный к сортам Рубеж и Молот. Сорта селекции НЦЗ им. П.П. Лукьяненко имели самое высокое генетическое расстояние между собой относительно других популяций и распределились по трем из четырех областей графика.
Для кластеризации образцов был выбран метод «Neighbor-Joining» программы MEGA11 [14] (рис. 13). Он позволил разделить генотипы на два больших кластера, и только сорт Платон обособился отдельно от всей изучаемой выборки. В один кластер выделились сорта селекции ООО «Агростандарт» и НЦЗ им. П.П. Лукьяненко, за исключением сорта Ларец. Этот кластер дополнительно подразделяется на еще две подгруппы отдельно, вынося сорта Каррера, Лайс, Шелк и Сельхоз, обладающие устойчивостью к мучнистой росе, карликовой ржавчине и пятнистостям. Ларец, Рубеж и Молот, характеризующиеся высокой морозоустойчивостью, вошли в другую подгруппу.
Другой кластер объединил в себя сорта ФГБНУ АНЦ «Донской» и ФГБОУ ВО Кубанский ГАУ, кроме сортов Преемник и Романс, являющихся интеллектуальной собственностью НЦЗ им. П.П. Лукьяненко. Взаимосвязанные Тимофей и Ерема, а также Жигули и Романс оказались родственными по структуре ДНК. Преемник, согласно кластерограмме, берет свое генетическое начало из совокупности вышеперечисленных четырех образцов.
Данные кластерного анализа и сформированной дендрограммы показали результаты, сходные с результатами PCoA-анализа.
В обоих случаях четко просматривается разделение на четыре кластера, при этом прослеживается генетическая взаимосвязь между сортами селекции ООО «Агростандарт» и НЦЗ им. П.П. Лукьяненко, а также сортов ФГБНУ АНЦ «Донской» и ФГБОУ ВО Кубанский ГАУ.
Следующим этапом наших исследований стал анализ структуры популяции всей выборки сортов ячменя. Программы STRUCTURE и Structure Selector, являясь мощными инструментами для анализа генетических данных и определения распределения генотипов по различным мнимым группам, позволяют визуализировать и интерпретировать генетическую структуру популяций. Количество гипотетических субпопуляций (K) оценивалось с помощью 10 независимых значений (K от 1 до 10) для проверки наилучшего значения ΔK [15]. На рисунке 14 можно увидеть, что при значениях К = 2 и К = 4 генетические образцы демонстрируют наиболее четкое разделение на группы. Это связано с тем, что именно при этих значениях достигается максимальная высота кривой, что указывает на наибольшую степень уверенности в классификации образцов.
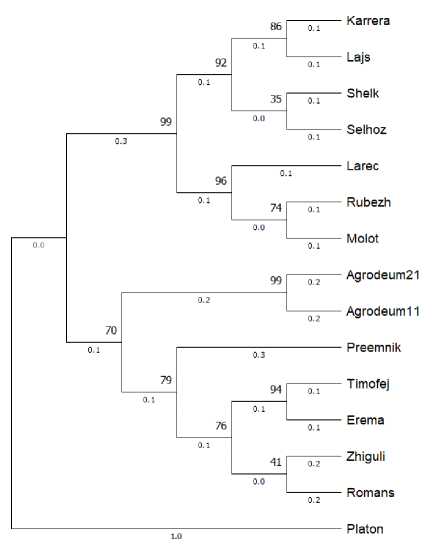
Рис. 13. Кластерный анализ 15 генотипов ячменя методом Neighbor-Joining Cluster analysis of 15 genotypes of barley by the Neighbor-Joining method
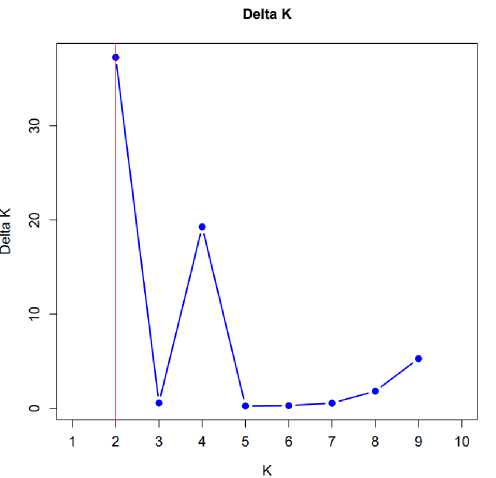
Рис. 14. Количество K групп (Structure Selector) Number of K groups (Structure Selector)
Важно отметить, что выбор оптимального значения К имеет критическое значение для анализа. Слишком низкое значение может привести к потере информации о структурных различиях между популяциями, в то время как слишком высокое значение может создать искусственную сложность, выделяя группы, которые на самом деле не имеют биологического значения.
Проводя структурный анализ при К = 2 (рис. 15, табл. 5), где каждая вертикальная полоса показывают присутствие генотипа одной популяции в генотипе другой, результаты Neighbor-Joining и PCoA подтверждают друг друга, однако при значении К = 4 имеет более точные результаты (рис. 16, табл. 5).
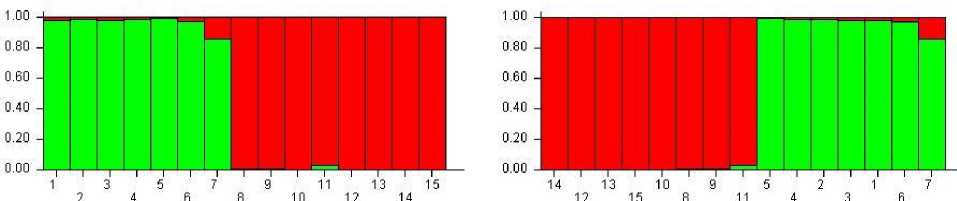
Рис. 15. Генетическая структура 15 генотипов озимого ячменя при K = 2
The genetic structure of 15 genotypes of winter barley at K = 2
Таблица 5
|
Номер образца |
Сорт |
Номер образца |
Сорт |
Номер образца |
Сорт |
|
1 |
Рубеж |
6 |
Шелк |
11 |
Ерема |
|
2 |
Молот |
7 |
Сельхоз |
12 |
Жигули |
|
3 |
Ларец |
8 |
Агродеум 21 |
13 |
Романс |
|
4 |
Каррера |
9 |
Агродеум 11 |
14 |
Преемник |
|
5 |
Лайс |
10 |
Тимофей |
15 |
Платон |
Номер и наименование образцов, представленных на рисунках 15 и 16
The number and name of the samples shown in Figures 15 and 16
Гистограмма, представленная на рисунке 15, показывает, что образцы под номерами 1, 2, 3, 4, 6, 7 в большей степени, а генотип 5 полностью представлены первой популяцией. Генотипы 8, 9, 10, 12, 13, 14, 15 полностью относятся ко второй популяции. Образец под номером 11
относится к популяции два примерно на 80 % (см. рис.15).
В точке 4 наблюдается значение ∆К второе по величине. Соответствующий график разделения изучаемой выборки на четыре мнимых популяции показан на рисунке 16.
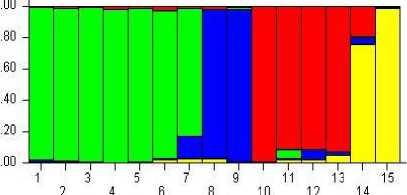
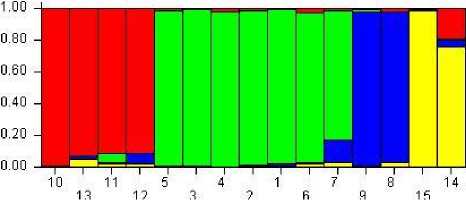
Рис. 16. Генетическая структура 15 генотипов озимого ячменя при K = 4
The genetic structure of 15 genotypes of winter barley at K = 4
Важно отметить, что генотипы образцов 1–5, представленные в большей степени одним цветом, четко выделяются среди всего массива. В отдельный кластер можно отнести номера 10– 13. Генетически более разнородны сорта 1, 4, 5, 9, 15, содержащие в своем профиле части двух популяции, а образцы 2, 6, 8, 11–14 – трех, и только номер 7 сочетает в себе комплекс генетического материала всех четырех популяций (см. рис. 16).
Полученные данные позволяют предположить, что его селекция на территории Ростов- ской области и Краснодарского края основывается на двух «школах» ФГБНУ НЦЗ им. П.П. Лукьяненко и ФГБНУ АНЦ «Донской», являющимися основоположниками развития озимого ячменя как культуры не только на территории своих регионов, но и в России в целом. Именно поэтому изучаемая выборка в большей степени разделена на две популяции. При этом четко выделяется четвертая популяция, в которую входят сорта селекции ФГБОУ ВО Кубанский ГАУ. Популяция под номером три, оригина-тором сортов которой является ООО «Агро- стандарт», менее контрастна относительно других и почти полностью соответствует популяции номер один.
Оценить эффективность применения iPBS маркеров для анализа генетического разнообразия изученных сортов озимого ячменя мы смогли после проведения полного и разностороннего анализа генетических взаимоотношений 15 сортов ячменя при использовании 10 iPBS маркеров.
Средние значения, полученные в результате комплекса инструментов статистической обработки геномных данных, подтверждают результаты друг друга и свидетельствуют о богатом генетическом разнообразии изученных нами четырех популяций современных сортов озимого ячменя отечественной селекции.
Анализ молекулярной дисперсии, проведенный с учетом внутрипопуляционных и межпопуляционных различий, показал значимые (P < 0,001) генетические различия внутри (76 %) и между популяциями (24 %) (рис. 11). Это указывает на то, что генетическое разнообразие в основном наблюдается среди сортов, а не популяций. Такие результаты представляют большую значимость, ведь снижение генетического разнообразия внутри популяции грозит утратой ее положительных свойств.
Оценка генетических взаимоотношений между образцами и дендрограмма сгруппировали 15 сортов озимого ячменя в два основных кластера, в каждом из которых образовалось по два подкластера. Так, кластер 1 объединил в себе сорта селекции ФГБНУ НЦЗ им. П.П. Лукьяненко и ООО «Агростандарт», а кластер 2 – сорта селекции ФГБНУ АНЦ «Донской» и ФГБОУ ВО Кубанский ГАУ, что позволяет говорить о их генетической близости. Последующее разделение каждого из этих кластеров на 2 дополнительных подкластера полностью соответствует нашей исходной группировке популяций по наименованию оригинатора.
Важно отметить, что селекция озимого ячменя в России имела свое начало на базе именно этих больших селекционных школ – ФГБНУ НЦЗ им. П.П. Лукьяненко и ФГБНУ АНЦ «Донской», которые можно по праву считать родоначальниками культуры озимого ячменя не только на юге, но и на территории всей нашей страны. Их сорта послужили основой для создания многих современных сортов рассмотренной нами культуры.
Кластеризация, проведенная с помощью STRUCTURE, также разделила 15 сортов озимого ячменя в два основных кластера. Наи- большая вероятность того, что данные, объясняющие структуру популяции, были получены при ΔK = 2 (рис. 15), в очередной раз подтверждает, что генетические профили сортов озимого ячменя селекции ФГБОУ ВО Кубанский ГАУ и ФГБНУ АНЦ «Донской», а также ООО «Агростандарт» и ФГБНУ НЦЗ им. П.П. Лукьяненко содержат в себе больше сходной генетической информации. А следующее по величине – значение ΔK = 4, что объясняет наше разделение выборки на 4 популяции по происхождению.
Так, данные, полученные в ходе каждого из этапов исследования, хоть и показывают большее генетическое сходство между группами сортов озимого ячменя селекции ФГБОУ ВО Кубанский ГАУ и ФГБНУ АНЦ «Донской», а также ООО «Агростандарт» и ФГБНУ НЦЗ им. П.П. Лукьяненко, при этом отличают их по целому ряду показателей. Все это свидетельствует об уникальности и разнородности каждой из исследованных популяций.
Подобные исследования проводились рядом ученых по всему миру [4, 5, 7, 8, 11–15]. При этом предметом изучения являлись разнообразные объекты, в т. ч. растения, бактерии и даже животные. По результатам таких научных изысканий группа маркеров iPBS для оценки полиморфизма была признана одним из самых простых, бюджетных и достоверных методов. Ведь именно генетическое разнообразие популяций позволяет вести направленную селекцию и получать все более совершенные конкурентоспособные сорта сельскохозяйственных растений.
Заключение. Обработка генетических данных по 15 сортам озимого ячменя отечественной селекции методами PCoA, Neighbor-Joining и STRUCTURE 2.3.4 показала, что исследуемые образцы распределились сходным образом. Сорта селекции ФГБНУ АНЦ «Донской» и ФГБОУ ВО Кубанский ГАУ в основном разделились на отдельные группы. Генетический профиль сортов ООО «Агростандарт» имел больше сходства с сортами ФГБНУ НЦЗ им. П.П. Лукьяненко.
Из вышесказанного следует, что четкое разделение образцов подтверждает эффективность анализа генотипов озимого ячменя с помощью iPBS маркеров и обосновывает целесообразность использования данного типа маркерных систем для составления селекционных программ, основываясь на отдаленности родства селекционного материала.


