Использование микросателлитного анализа для выявления биотипов у сортов ярового рапса (Brassica napus L.)
Автор: Рогожина Т.Г., Анискина Ю.В., Карпачев В.В., Шилов И.А.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 2 (162), 2015 года.
Бесплатный доступ
Проведена оценка степени генетической однородности сортов ярового рапса методом микросателлитного анализа, на основании которой было выявлено разнообразие биотипов внутри изучаемых сортов, что послужило основой для признания их сортовыми популяциями. Вычисление частот встречаемости аллелей позволило разделить данные варианты на отдельные биотипы и сравнить их с исходными сортами по жирно-кислотному составу масла. Биотипы, превосходящие исходные варианты по биохимическим параметрам, в дальнейшем будут использованы в работе по созданию паспорта по каждому сорту ярового рапса.
Биотипы, яровой рапс, микросателлиты
Короткий адрес: https://sciup.org/142151236
IDR: 142151236 | УДК: 633.853.494:575.22
Текст научной статьи Использование микросателлитного анализа для выявления биотипов у сортов ярового рапса (Brassica napus L.)
Введение. Рапс ( Вrassica napus L. ) – одна из перспективных масличных культур для обеспечения населения растительным маслом и животноводства кормовым белком [1]. Основными направлениями селекции рапса являются: улучшение количественных характеристик растений, улучшение качественных свойств сортов, создание сортов с улучшенными биотическими и абиотическими признаками. Для создания сортов рапса с комплексом вышеназванных признаков проводится непрерывная работа по созданию соответствующего исходного материала. С применением простых, двойных, ступенчатых схем внутривидовых скрещиваний с последующим индивидуальным отбором и инбридингом создан разнообразный исходный материал для селекции яровых форм рапса [2].
Наряду с традиционной селекцией в последнее время стала широко применяться селекция, основанная на применении молекулярных ДНК-маркеров, так называемая маркер-вспомогательная се- лекция (Marker-assisted selection – MAS). Преимущество этой селекции заключается в адекватности генетической оценки исходного материала, что приводит к точности отбора, даже если селективная аллель является рецессивной, а растения гетерозиготны. Это приводит к сокращению числа циклов или даже этапов селекционной программы и реальному ускорению селекционного процесса на несколько лет. Также возможно проведение оценки отбора на ранних стадиях роста и развития растений – вплоть до 5– 7-дневных проростков, что дает возможность выбраковывать неперспективный материал и экономить финансовые и материальные ресурсы [3]. Молекулярные маркеры позволяют надежно различать виды, подвиды, сорта и инбредные линии растений и даже близкородственные формы [4]. Для идентификации необходимо иметь каталоги и базы данных «генетических паспортов», охватывающие генетическое разнообразие культуры или вида в целом, в т.ч. всех сортов и гибридов [5].
Также для подбора родительских пар при скрещивании, контроля гибридности наиболее перспективным является метод анализа полиморфизма микросателлит-ных последовательностей ( Simple Sequence Repeats – SSR ), позволяющий получить индивидуальную характеристику отдельного генотипа – его ДНК-профиль. В предыдущих работах нами была показана возможность паспортизации сортов рапса [6]. Однако паспортизировать удалось только линейные сорта рапса, в основном зарубежной селекции, при этом наши сорта оказались популяциями, т.е. состоящими из нескольких генотипов. Тогда было сделано предположение, что эти сорта можно разделить на биотипы, по аналогии с другими культурами, такими как рожь [7].
Таким образом, цель данной работы заключалась в оценке степени генетической однородности сортов ярового рапса методом микросателлитного анализа, вычислении частоты встречаемости аллелей, а также разделении на отдельные биотипы с последующим их сравнением с ис- ходными сортами по хозяйственно ценным признакам.
Материалы и методы. Материалом для исследования послужили два сорта ярового рапса селекции ВНИИ рапса: Булат и Форвард.
Сорт Булат 00 типа включен в Госре-естр по Северо-Западному и ЦентральноЧерноземному регионам. Средняя урожайность семян в Северо-Западном регионе 11,0 ц/га, в Центрально-Черноземном регионе – 12,2 ц/га, наибольшая – 25,2 ц/га (Курская область). Вегетационный период 92 дня. Устойчивость к полеганию 4,7–5,0 балла, к осыпанию – 3,9– 4,3 балла. Высота растений 101,2 см, масса 1000 семян – 3,2–3,7 г. Содержание жира в семенах 42,5–44,0 %. Рекомендован для возделывания на семена и корм.
Сорт Форвард 00 типа включен в Гос-реестр по Северо-Западному, Центральному, Центрально-Черноземному, Средневолжскому, Уральскому и ЗападноСибирскому регионам. В СевероЗападном регионе наибольшая урожайность получена в Калининградской области – 30,9 ц/га. Вегетационный период 86 дней. В Центральном регионе в Рязанской и Тульской областях средняя урожайность составила 27,0 и 33,8 ц/га соответственно. Вегетационный период 86 дней. В ЦЧО, в Курской области, средняя урожайность была 18,2 ц/га, вегетационный период – на 5 дней короче, чем у стандарта. Масличность 45,0 %, что выше чем у стандарта на 3,8 %. В Средневолжском регионе наибольшая урожайность получена в Республике Татарстан – 21,2 ц/га, масличность – 41,6 %, что выше стандарта на 4,1 %. Вегетационный период 90 дней. В Уральском регионе наибольшая урожайность получена в Челябинской области – 27,3 ц/га. Вегетационный период 97 дней. В ЗападноСибирском регионе наибольшая урожайность составила 38,7 ц/га (в Томской области), прибавка 10 %. Вегетационный период 102 дня, масличность – 50,0 %, что выше чем у стандарта на 2,4 %. Рекомендован для возделывания на семена.
Геномную ДНК выделяли из первых настоящих листьев модифицированным СТАВ-методом [8]. Полимеразную цепную реакцию осуществляли с помощью локус-специфичных пар праймеров [9]. Реакции проводили в 25 мкл смеси, содержащей 20–50 нг ДНК, по 10 пмоль каждого из праймеров (один из праймеров был помечен флуоресцентным красителем Cy5), буферный раствор, содержащий 100 мМ tris-HCl (pH 8.3), 25 мМ MgCl 2 , 500 мМ KCl, 400 мкМ каждого дезоксинуклеозидтрифосфата и 1 ед. акт. ДНК-полимеразы "ThermoStar". Активация термостабильной ДНК-полимеразы происходила в результате экспозиции реакционной смеси при 95 оС в течение 10 мин перед проведением ПЦР. Амплификация осуществлялась при следующих температурных условиях: 1 цикл: 95 оС – 10 мин, 30 циклов: 94 оС – 30 сек, T отж – 30 сек, 72 оС – 30 сек; 1 цикл: 72 оС – 5 мин. Для амплификации использовали термоциклер «Терцик» фирмы «ДНК-технология» (Россия). Анализ флуоресцентно-меченых ПЦР-фрагментов проводили методом электрофореза в денатурирующих условиях с помощью автоматического анализатора ALFexpress II Amersham BioSciences (США). Полученные данные анализировали с помощью пакета прикладных программ ALFwin Software Fragment Analyzer (США). В работе использовалось оборудование центра коллективного пользования научным оборудованием ВНИИСБ «Биотехнология».
Жирно-кислотный состав масла определялся в лаборатории химических анализов ВНИИ рапса по методике [10] методом газожидкостной хроматографии по ГОСТ 30089-93 [11].
Результаты и обсуждение. На первом этапе исследований для исследуемых сортов определяли степень их генетической однородности. На рисунке 1 представлены результаты анализа генетической однородности сорта Булат по трем парам праймеров: Bna.M.001, Bna.M.006, Bna.M.005. В результате анализа сорта Булат по исследуемым парам праймеров выявлено несколько вариантов генотипов с разным аллельным составом, что свидетельствует о его генетической неоднородности (рис. 1). По сорту Форвард была получена аналогичная картина. Таким образом, можно предположить, что данные сорта являются сортовыми популяциями, состоящими из нескольких генотипов.
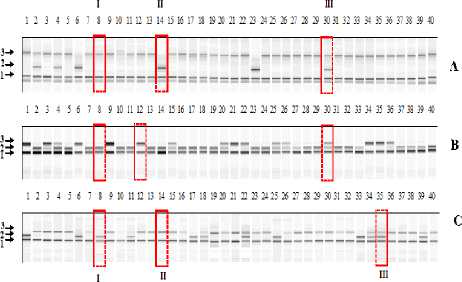
Рисунок 1 – Электрофореграмма разделения в 8 %-ном ПААГ продуктов ПЦР сорта Булат, полученных по трём парам праймеров: А – Bna.M.001, B – Bna.M.006, C – Bna.M.005. 1, 2, 3 – аллели; I, II, III – генотипы. По паре праймеров Bna.M.006:
I генотип – дорожка 30, II генотип – дорожка 8, III генотип – дорожка 12
Дальнейшие исследования по созданию ДНК-паспорта сорта проведены нами по схеме, взятой из литературных источников [12], состоящей из следующих этапов: 1 – оценка однородности; 2 – в случае гетерогенности материала оценка частоты встречаемости аллелей и дифференциация образца на биотипы, т.е. группы растений с различным аллельным составом; 3 – анализ ДНК одного образца каждого биотипа по остальным ранее отобранным локусам, 4 – запись данных в виде молекулярно-генетической формулы.
На основе предложенной схемы в первую очередь была проведена оценка частоты встречаемости аллелей микросател-литных локусов и генотипов обоих сортов (рис. 2 и 3). В итоге были получены данные по соотношению и преобладанию определенных аллелей по каждому из исследуемых сортов.
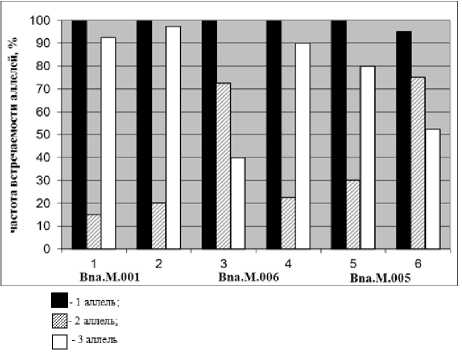
Рисунок 2 – Частота встречаемости аллелей по трём парам праймеров: Bna.M.001, Bna.M.006, Bna.M.005.
1, 3, 5 – сорт Булат; 2, 4, 6 – сорт Форвард. Расположение аллелей см. на рис. 1
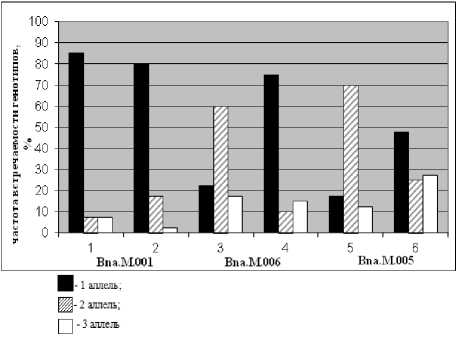
Рисунок 3 – Частота встречаемости генотипов по трём парам праймеров:
Bna.M.001, Bna.M.006, Bna.M.005.
1, 3, 5 – сорт Булат; 2,4,6 – сорт Форвард.
Расположение генотипов см. на рис. 1.
На основании этого, согласно предложенной в работе [12] принципиальной схеме, были выделены отдельные биотипы по каждому сорту. По сорту Булат было выявлено пять биотипов с частотой встречаемости аллелей более 5 %: I биотип с частотой встречаемости аллелей 37,5 %, II биотип – 12,5 %, III биотип – 10 %, IV и V биотипы – по 7,5 % (рис. 4). Затем из каждого биотипа сортов Булат и Форвард мы отобрали по три растения, которые обозначили: 411–413 – 1-й биотип сорта Форвард, 421–423 – 2-й биотип, 431–433 – 3-й биотип, 441–443 – 4-й биотип, 451-453 – 5-й биотип сорта Форвард;
511–513 – 1-й биотип сорта Булат, 521–523 – 2-й биотип, 531–533 – 3-й биотип, 541– 543 – 4-й биотип, 551–553 – 5-й биотип сорта Булат. Отобранные растения также были проверены по трём вышеуказанным парам праймеров на наличие генетической однородности (рис. 5).

Рисунок 4 – Электрофореграмма разделения в 8 %-ном ПААГ продуктов ПЦР сорта Булат, полученных по трём парам праймеров: А – Bna.M.001, B – Bna.M.006, C – Bna.M.005. I – 37,5 %; II – 12,5 %;
III – 10 %; IV – 7,5 %; V – 7,5 %; VI ≤ 5 % (примесь)

Рисунок 5 – Электрофореграмма разделения в 8 %-ном ПААГ продуктов ПЦР сортов Форвард и Булат, полученных по трём парам праймеров : А – Bna.M.005, B – Bna.M.006, C – Bna.M.001. 411–413 – 1-й биотип сорта Форвард, 421–423 – 2-й биотип, 431–433 – 3-й биотип, 441–443 – 4-й биотип, 451–453 – 5-й биотип сорта Форвард;
511–513 – 1-й биотип сорта Булат, 521–523 – 2-й биотип, 531–533 – 3-й биотип, 541–543 – 4-й биотип, 551–553 – 5-й биотип сорта Булат
Далее для посева взяли по одному растению из каждого биотипа, а также в ка- честве контроля наши исходные сорта-популяции – Форвард и Булат: 4–14 – исходный сорт Форвард, 412–14 – 1-й биотип сорта Форвард, 423–14 – 2-й биотип, 433 – 3-й биотип, 442–14 – 4-й биотип, 453–14 – 5-й биотип сорта Форвард; 5–14 – исходный сорт Булат, 511–13 – 1-й биотип сорта Булат, 523 – 2-й биотип, 533 – 3-й биотип, 543 – 4-й биотип, 552 – 5-й биотип сорта Булат (таблица). Выращивание растений производили в условиях полевого опыта. Во время цветения на все растения были надеты изоляторы для предотвращения их перекрестного опыления. Уборку проводили вручную, семена с каждого растения обмолачивались в отдельный пакет, который подписывали.
Таблица
Содержание олеиновой кислоты в образцах ярового рапса
|
Сорт, биотип сорта |
Содержание олеиновой кислоты, % |
Отклонение от стандарта, % |
|
Форвард, контроль |
58,35 |
- |
|
1 биотип – 412-14 |
62,66 |
4,31** |
|
2 биотип – 423-14 |
61,955 |
3,605* |
|
3 биотип – 433-14 |
60,433 |
2,08 |
|
4 биотип – 442-14 |
61,3 |
2,95* |
|
5 биотип – 453-14 |
60,583 |
2,233 |
|
НСР 05 =2,68, НСР 01 =3,618 |
||
|
Булат, контроль |
59,71 |
- |
|
1 биотип – 511-13 |
68,83 |
9,12** |
|
2 биотип – 523-14 |
58,97 |
-0,74 |
|
3 биотип – 533-14 |
65,98 |
6,27** |
|
4 биотип – 543-14 |
67,92 |
8,21** |
|
5 биотип – 552-14 |
64,53 |
4,82** |
|
НСР 05 =2,16, НСР 01 =3,024 |
||
*достоверность различий на 5 %-ном уровне значимости,
**достоверность различий на
1 %-ном уровне значимости
Дальнейшая характеристика полученных биотипов по каждому сорту заключалась в проведении биохимического анализа их семян по жирно-кислотному составу и сравнении с показателями исходных сортов. В результате были получены данные по процентному содержанию основных жирных кислот семян (пальмитиновой, олеиновой, линолевой, линоленовой, эйкозеновой и эруковой) биотипов и исходных сортов. Известно, что основным требованием, предъявляемым к современным сортам, принимаемым в производство пищевого рапсового масла, является содержание менее 0,6 % глюкозинолатов в семенах и снижение практически до нуля эруковой кислоты в масле. Олеиновая кислота является моно-ненасыщенной жирной кислотой, относящейся к группе омега-9, без которой невозможен правильный обмен веществ. В таблице приведены данные по содержанию олеиновой кислоты в сравниваемых биотипах относительно соответствующих им исходных сортов.
В результате установлено, что все исследуемые биотипы превосходят исходные сорта по содержанию олеиновой кислоты в среднем на 3–9 %, что дает возможность для их использования в дальнейшей работе.
Известно, что биотипы представляют собой группы растений с различным аллельным составом [12]. Биотипный состав напрямую связан с урожайностью через вклад разнокачественных по адаптивной ценности биотипов. Именно с этих позиций работают селекционеры, вовлекая в систему скрещиваний сорта различных экологических групп, используя системы сортосмесей, предусматривающие объединение компонентов, неравнозначных по адаптивным свойствам.
Ранее в ряде своих работ исследователи осуществляли направленный селекционный процесс ряда культурных растений через выделение и анализ биотипов. Так, использование в селекции многокомпонентных сортов с различающимися по адаптивности компонентами позволяет поддерживать уровень продуктивности на относительно стабильном уровне, причем такой эффект достигается за счет наличия в таких сортах генотипов, различающихся по реакции на условия среды и обеспечивающих выраженный компенсаторный эффект [13]. Бороевич С.В. указывает, что в сорте находятся биотипы, устойчивые к лимитирующим факторам отдельного го- да, или к определенной местности. Он считает, что через биотипы реализуется явление взаимодополняемости составных компонентов сорта за счет того, что пониженный уровень в проявлении признака продуктивности по одному компоненту компенсируется достаточно высоким уровнем признака для другого компонента или результатом их совместного эффекта на конечный результат в популяции [14]. Результатами данного анализа подтверждается факт неравнозначности биотипов по обеспечению суммарной продуктивности озимой пшеницы. Особенно это касается уровня главного биотипа, т.к. его количественное изменение или потеря приводит к однонаправленному изменению показателей продуктивности. Основываясь на установленной роли биотипов в обеспечении определенного уровня продуктивности сорта, можно предположить, что варьирование в содержании основного биотипа, приводит к переопределению структуры сорта, что выражено изменением урожайности [15].
Полученные данные показывают, что в процессе семеноводства сорт претерпевает существенные изменения. Частоты отдельных биотипов могут быстро и значительно меняться в процессе пересева как под влиянием естественного, так и направленного отбора. Это приводит к существенному снижению продуктивности сорта, потере ряда его ценных признаков и свойств. Эти факты имеют и другую, юридическую сторону, ведь, по сути, под одним и тем же названием реализуется разный селекционный продукт. Поэтому в процессе семеноводства необходим контроль не только за урожайностью, но и за биотипным составом сорта, а использование микросателлитного анализа в процессе первичного и элитного семеноводства с обязательным составлением генетического паспорта передавае- мого на государственное испытание сорта, является в этой связи особенно важным [7].
Выводы. С помощью микросателлит-ного анализа с набором оригинальных пар праймеров была выявлена неоднородность сортов ярового рапса Булат и Форвард, проведена оценка частоты встречаемости аллелей и дифференциация сортов на биотипы, т.е. группы растений с различным аллельным составом и проведена их сравнительная оценка с исходными сортами по содержанию олеиновой кислоты.
Работа была выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (проект № RFMEFI62114X0003).
Список литературы Использование микросателлитного анализа для выявления биотипов у сортов ярового рапса (Brassica napus L.)
- Артемов И.В., Киселев А.М. Пути увеличения производства кормов и растительного масла//Кормопроизводство. -1997. -№4. -С. 2-7.
- Бочкарева Э.Б., Горлов С.Л., Сердюк В.В. Генетические ресурсы озимого и ярового рапса во ВНИИМК//Сб. науч. докл. на междунар. науч.-практ. конф. «Рапс -культура XXI века: аспекты использования на продовольственные, кормовые и энергетические цели», 15-16 июля 2005 г. -Липецк, 2005. -С. 23-27.
- Козлов Н.Н., Клименко И.А. Маркер-вспомогательная селекция кормовых культур: проблемы и перспективы//Селекция и семеноводство. -2006. -№ 3-4. -С. 1-7.
- Хавкин Э.Е. Молекулярная селекция растений: ДНК-технологии создания новых сортов сельскохозяйственных культур//Сельскохозяйственная биология. -2003. -№ 3. -С. 26-41.
- Cooke R.J. Modern methods for the cultivar identification and the transgenic plant challenge//Seed. Sci. Technol. -1999. -V. 27. -P. 669-680.
- Сатина Т.Г., Анискина Ю.В. Паспортизация сортов рапса с использованием микросателлитного анализа//Сб. мат. 6-й междунар. конф. молод. ученых и специалистов «Инновационные направления исследований в селекции и технологии возделывания масличных культур», посвященной 125-летию со дня рождения В.С. Пустовойта, Краснодар, 24-25 февраля 2011. -С. 266-269.
- Тороп А.А., Александров Е.В., Тороп Е.А. Урожайность и биотипный состав элиты сорта озимой ржи Таловская 33//Вестник РАСХН. -2011. -№ 3. -С. 43-45.
- Kidwell K.K., Osborn T.C. Plant Genomes: Methods for Genetic and Physical Mapping. -Kluever Academic Publishers Group. A.H. Dordrecht, The Netherlands. -2001. -P. 1-13.
- Сатина Т.Г., Анискина Ю.В., Карпачев В.В., Харченко П.Н., Шилов И.А. Различение и идентификация сортов рапса методом микросателлитного анализа//Доклады РАСХН. -2010. -№ 1. -С. 11-13.
- Демьянчук Г.Т., Мельник М.В., Лысюк В.И., Микитин Н.С. Оценка селекционного материала рапса и сурепицы на содержание эруковой кислоты и глюкозинолатов: методические указания. -М.: РАСХН, 1988. -16 с.
- ГОСТ 30089-93. Масла растительные. Метод определения эруковой кислоты. -Введ. 1997-01-01. Измен. 2014-23-06. -М.: Изд-во стандартов, 1993.
- Малышев С.В., Урбанович О.Ю., Картель Н.А. Идентификация и паспортизация сортов сельскохозяйственных культур (мягкой пшеницы, картофеля, томата, льна и свеклы) на основе ДНК-маркеров: методические рекомендации. -Минск: , 2006. -27 с.
- Самигулин С.Н. Фитоценотический анализ популяций мягкой пшеницы. -Уфа: АН РБ, 1994. -186 с.
- Бороевич С. Принципы и методы селекции растений. -М.: Колос, 1984. -344 с.
- Ковалева О.Н., Дубежинская А.В., Петрова Н.Н. Популяционные отношения озимой пшеницы//Агросборник. -№ 4. -2008. -. -Режим доступа: http://agrosbornik.ru/agrosbornik4/25-2011-09-09-15-27-21.html.


