Использование молекулярно-генетических маркеров для идентификации генов чувствительности к фотопериоду в селекционном материале сои
Автор: Иванов С.В., Рамазанова С.А., Гучетль С.З., Трунова М.В.
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 2 (198), 2024 года.
Бесплатный доступ
Соя - одна из важнейших масличных и кормовых культур. В ней содержится большое количество масла, белка, витаминов и других ценных нутриентов. Возделываемая площадь сои в России увеличивается ежегодно в направлении центральных и сибирских регионов страны. Однако соя очень чувствительная к фотопериоду, что имеет ключевое значение для регуляции её роста и развития. Идентификация генов, контролирующих фотопериодическую чувствительность в сортах сои, важна для селекции новых адаптивных сортов. ДНК-маркеры являются эффективным инструментом для проведения работ по отбору ценных генотипов из селекционного материала. В работе проведена идентификация генов, вносящих наибольший вклад в снижение чувствительности к длине дня у сои. Оценку проводили на шести сортах, пяти линиях поколений F6-F7 и пяти гибридах сои F1. Для этого использовали шесть молекулярных маркеров. Анализ показал, что больше всего рецессивных аллелей у сортов Элана и Баргузин, которые относятся к очень раннеспелым сортам, больше всего доминантных аллелей у сорта Мамонт, что относит его к среднеспелым сортам. Остальные образцы характеризовались наличием двух или трех рецессивных аллелей и относились к группам спелости от ранней до среднеранней. Анализ гибридных комбинаций показал, что молекулярный маркер на ген Е3 наследуется кодоминантно, что позволяет использовать его для контроля переноса желаемых генов при скрещиваниях в потомстве. Таким образом, использование молекулярно-генетических маркеров показало эффективность в отборе по исследуемому признаку и может применяться в селекционном процессе.
Соя, е-гены, фотопериодическая чувствительность, сорт, гибрид, линия, маркер, днк
Короткий адрес: https://sciup.org/142240896
IDR: 142240896 | УДК: 633.853.52:575 | DOI: 10.25230/2412-608X-2024-2-198-3-9
Текст научной статьи Использование молекулярно-генетических маркеров для идентификации генов чувствительности к фотопериоду в селекционном материале сои
Введение. Соя в России занимает второе место после подсолнечника среди масличных культур по площади возделывания и валовому сбору. Эта культура является ценным источником растительного белка, масла, витаминов, вторичных метаболитов и других питательных веществ. Основные области применения сои в России – это производство масла и белковых кормов. Площади посева сои в стране, согласно официальной статистике, ежегодно увеличиваются на 5–6 %, и только за 2022 г. было выделено 3,45 млн га сельхозугодий под возделывание культуры [1]. Этому способствует проводимая селекционная работа по расширению географии выращивания сои в более северных регионах России, чем было ранее.
Чувствительность к длине светового дня играет ключевую роль в регуляции роста, развития и цветения растений, особенно это важно для сои – одной из наиболее фоточувствительных культур. Способность сои адаптироваться к различным длинам дня и незначительно увеличивать вегетационный период при перемещении в регионы с большей его продолжительностью, является определяющим фактором, влияющим на период вегетации, цветение, урожайность и в целом на возможность возделывания того или иного сорта в условиях нетипичной для него длины дня. Идентификация рецессивных аллелей генов, ответственных за фотопериодическую чувствительность в сортах сои, является важным шагом в селекции и создании новых адаптивных и продуктивных сортов. Этот признак у сои контролируется генами E (Early). На сегодняшний день известно двенадцать таких генов, но наиболее существенный вклад в снижение чувствительности вносят гены Е1–Е4 [2].
Ген Е1 контролирует фактор транскрипции, выполняющий роль репрессора цветения. Для Е1 идентифицировано шесть аллелей, из которых e1-nl и e1-fs приводят к раннему цветению и полному подавлению экспрессии Е1 , e1-as определяет среднюю продолжительность цветения и частично подавляет действие Е1 [3; 4].
Ген Е2 – ингибитор цветения в условиях длинного дня, рецессивный аллель e2-ns , вызванный нонсенс-мутацией, имеет второе по важности значение в снижении фотопериодической реакции сои [2].
Гены Е3 и Е4 контролируют экспрессию фитохрома А (GmPhyA3 и GmPhyA2), который воздействует на цветение при разном соотношении красного света к дальнему красному (R/FR). При высоком R/FR в условиях длинного дня усиливается эффект гена Е3 , а при низком – Е4 . Также они запускают экспрессию Е1 , из-за чего наступает позднее цветение и при коротком, и при длинном дне. Но рецессивные аллели е3 и е4 снижают чувствительность к фотопериоду и способствуют раннему цветению в обоих условиях [5; 6; 7].
В настоящее время молекулярные методы, такие как ДНК-маркирование, стали неотъемлемой частью исследований в области генетики растений. С помощью маркеров возможно эффективно выявлять гены хозяйственно ценных признаков и контролировать их передачу от донора к реципиенту, что открывает новые перспективы для усовершенствования селекционных программ.
Целью нашего исследования было идентифицировать гены фотопериодической чувствительности в генотипах сои с использованием молекулярных маркеров.
Материалы и методы. Исследования проводили в лаборатории молекулярно- генетических исследований отдела биологических исследований ФГБНУ ФНЦ ВНИИМК. Объектом исследования служили шесть сортов (Баргузин, Элана, Рысь, Мамонт, Свапа, Арлета), пять линий поколений F6–F7 (2501, 2502, 2504, 2507, 2508), являющихся родительскими линиями пяти гибридов F1 : гибрид 1 (2502 × Арлета), гибрид 2 (Арлета × 2502), гибрид 3 (2502 × 2507), гибрид 4 (2502 × 2508), гибрид 5 (2504 × 2501). Контрольными вариантами по генам Е1, Е2, Е3 и Е4 выступали сорта Вильямс 82 и Harosoy, аллели данных генов ранее идентифицированы и описаны в литературе [3; 9].
Для экстракции ДНК использовались осевые органы зародыша, без предварительного проращивания. Выделение ДНК проводили с использованием набора реагентов для экстракции ДНК Экстран-3 (Синтол, РФ). Предварительно растительный материал измельчали с помощью гомогенезатора KZ-III-FP (Servicebio, КНР). Определение качества и количества выделенной ДНК осуществляли на микроспектрофотометре Nano-300 (Allsheng, КНР) в 3-кратной повторности на основании измерения оптической плотности раствора при длине волны 260 нм для нуклеиновых кислот (НК), 280 – для белков и фенолов, 230 – для других органических соединений. Оптимальным соотношением оптических плотностей, полученных при 260/280 нм и 260/230 нм, считали значение от 1,8 до 2,2.
ПЦР проводили в 25 мкл реакционной смеси, содержащей 2,5 мкл 10x ПЦР-Буфер-Б; 0,2 мM каждого dNTP; по 10 пМ каждого праймера; 100 нг матричной ДНК и 1 ед. SynTaq ДНК-полимеразы (Синтол, РФ). Амплификация выполнялась в термоциклере GeneExplorer GE-96S (BIOER, Китай).
Для маркирования были выбраны четыре гена, отвечающие за чувствительность к фотопериоду: E1 , Е2 , Е3 и Е4 . Для идентификации исследуемых генов использовались ДНК-маркеры, ранее разработанные зарубежными и отечественными авторами, которые представлены в таблице 1.
Таблица 1
Молекулярные маркеры, примененные в исследовании
|
Ген |
Лока-лиза-ция (хромо-сома) |
Последовательность праймеров |
Длина ПЦР-продуктов, п.н. |
Источник |
|
E1 |
6 |
F11: CACTCAAATTA AGCCCTTTCA R21: TCCGATCTCAT CACCTTTCC F2: GGGAGCAGTG TCAAAAGAAGAG R2: GTGCTATCCCT TAGTTAATTAAATA F3: GGGAGCAGTGT CAAAAGAAGAC R3: GTGCTATCCCT TAGTTAATTAAATT |
E1/e1-as/e1-fs – 547 Е1 – 1403 e1-as – 1403 |
[2] [8] |
|
Е2 |
10 |
F: GAAGCCCATCAG AGGCATGTCTTATT R: AAGCCTATGC CAGCTAGGTATTT |
E2 – 130 e2-ns – 107+23 |
[3] |
|
Е3 |
19 |
F: TGGAGGGTATT GGATGATGC R1: CTAAGTCCGC CT CTGGTTTCAG R2: CGGTCAAGAGC CAACATGAG R3: GTCCTATACAA TTCTTTACGACG |
E3-Mi – 1339 E3-Ha – 558 e3-tr – 275 |
[6] |
|
E4 |
20 |
F: AGACGTAGTG CTAGGGCTAT R1: GCATCTCGCAT CACCAGATCA R2: GCTCATCCCTT C GAATTCAG |
E4 – 1229 e4-SORE-1 – 837 |
[5] |
1 – прямой праймер
2 – обратный праймер
Параметры амплификации: предварительная денатурация (95 ℃) – 5 мин;
40 циклов: денатурация (95 ℃) – 10 сек, гибридизация (55–60 ℃) – 20 сек, элонгация (72 ℃) – 35 сек; финальная элонгация (72 ℃) – 5 мин.
Продукты амплификации с парой праймеров Е2FR обрабатывали эндонуклеазой рестрикции DraI , согласно протоколу изготовителя (СибЭнзим, РФ).
Разделение ПЦР-продуктов методом электрофореза в 2%-ом агарозном геле проводили в камере для горизонтального электрофореза SE-2 (Хеликон, РФ). Параметры силы тока и напряжения – 90 mA, 5
180 V. Гели окрашивали бромидом этидия и визуализировали фрагменты ДНК при помощи гель-документирующей системы GenoSens Touch 2200 в УФ-свечении. Размер фрагментов определяли с помощью маркеров молекулярного веса 100–1000 п.н. (Синтол, РФ) и 100 + bp DNA Ledder (Евроген, РФ).
Результаты и обсуждение. Для идентификации аллелей гена Е1 в изучаемых генотипах использовали три пары праймеров. Праймеры Е1F1R1 являются общими для доминантного Е1 и рецессивных аллелей е1-as , e1-fs . Отсутствие гибридизации свидетельствует о наличии рецессивного аллеля e1-nl. Праймеры на Е1 и е1-as амплифицируют фрагменты одной длины 1403 п.н., но имеется одна нуклеотидная замена, в связи с чем аллель e1-as вносит изменения в работу гена. Праймеры Е1F2R2 гибриди-зуются только в образцах с наличием аллеля Е1 , а Е1F3R3 – только с аллелем e1-as . В нашей работе все проанализированные образцы характеризовались наличием аллеля e1-as (рис. 1а), кроме сорта Мамонт, у которого был идентифицирован аллель Е1 (рис. 1б). Аллель e1-nl выявлен не был.
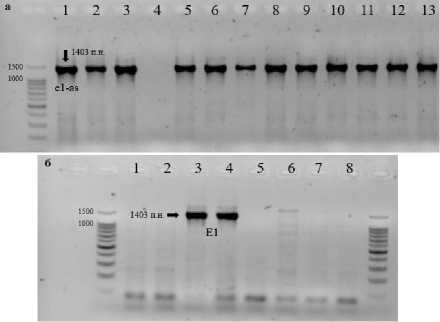
Рисунок 1 – Электрофоретические спектры ПЦР-продуктов, полученных с помощью праймеров Е1F3R3 ( а ) и Е1F2R2 ( б ).
Дорожки: а) 1 - Вильямс 82; 2 - Harosoy;
3 – Баргузин; 4 – Мамонт; 5 – Рысь; 6 – Элана;
7 – Свапа; 8 – Арлета; 9 – 2501; 10 – 2502; 11 – 2504;
12 – 2507; 13 – 2508;
б) 1 - Вильямс 82; 2 - Harosoy; 3, 4 - Мамонт;
5, 6 – Свапа; 7, 8 – Элана
Для изучения аллельного состояния гена Е2 применяли СAPS-маркер, кото-6
рый идентифицировал фрагмент длиной 130 п.н. во всех образцах. Отличие в нуклеотидных последовательностях доминантного аллеля Е2 от рецессивного е2-ns – однонуклеотидная замена аденина на тимин, которая затрагивает сайт распознавания эндонуклеазы DraI. Поэтому после проведения гидролиза ампликоны, имеющие данную трансверсию, разрезаются на фрагменты длиною 107 и 23 п.н., что соответствует рецессивному аллелю е2-ns . Фрагменты с аденином не подвергаются рестрикции, что свидетельствует о наличии в этих образцах доминантного аллеля Е2 . В исследуемой выборке у всех образцов идентифицирован рецессивный аллель е2-ns (рис. 2). Только у сорта Вильямс 82 обнаружен аллель Е2 , что соответствует литературным данным [4].

Рисунок 2 – Электрофоретические спектры ПЦР-продуктов, полученных с помощью пары праймеров Е2 (после обработки DraI ).
Дорожки: 1 – Баргузин; 2 – Элана; 3 – Рысь;
4 – Мамонт; 5 – Свапа; 6 – Арлета; 7 – 2501;
8 – 2502; 9 – 2504; 10 – 2507; 11 – 2508;
12 – Вильямс 82; 13 – Harosoy
Ген Е3 имеет четыре аллеля (E3-Mi, E3-Ha, e3-tr, e3-fs), два из которых рецессивные: e3-tr и e3-fs. В нашем исследовании мы идентифицировали только аллели Е3-На и е3-tr. Маркер аллеля Е3-Ha имеет длину фрагмента в 558 п.н., был обнаружен у сортов Рысь, Мамонт, Свапа, линий 2501, 2502 и 2508, а также у гибрида 4. Маркер аллеля e3-tr – 275 п.н. наблюдался у сортов Элана, Баргузин и Арлета, линий 2504 и 2507. У гибридов 1, 2, 3 и 5 ген Е3 находится в гетерозиготном состоянии (Е3-Ha/e3-tr) (рис. 3). Но важно отметить, что аллель e3-fs отличается от аллеля E3-Ha инсерцией тимина, которая является фреймшифт-мутацией (мутация рамки считывания), в результате происходит сдвиг рамки считывания при транскрипции мРНК. Это приводит к появлению стоп-кодона в экзоне 1 и преждевременной терминации синтеза белка [9]. Поэтому, потенциально, при идентификации аллеля Е3-Ha доминантный аллель может быть ошибочно идентифицирован как рецессивный. Точное определение e3-fs возможно секвенированием амплифицированной последовательности [8], но в нашей работе этого не проводилось.
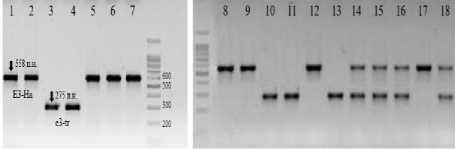
Рисунок 3 – Электрофоретические спектры ПЦР-продуктов, полученных с помощью праймеров на ген Е3 .
Дорожки: 1 – Вильямс 82; 2 – Harosoy; 3 – Баргузин; 4 – Элана; 5 – Рысь; 6 – Мамонт; 7 – Свапа; 8 – 2501;
9 – 2502; 10 – 2504; 11 – 2507; 12 – 2508;
13 – Арлета; 14 – Гибрид 1; 15 – Гибрид 2;
16 – Гибрид 3; 17 – Гибрид 4; 18 – Гибрид 5
Из литературы известно, что ген Е4 имеет широкое разнообразие рецессивных аллелей ( е4-SORE-1, e4-kes, e4-oto, e4-tsu, e4-kam ), но наиболее распространен аллель е4-SORE-1, остальные характерны для сортов китайской и японской селекции [5]. Данный е4 -специфичный маркерный фрагмент ДНК длиной 837 п.н. выявлен в сортах Элана, Баргузин, Свапа и линии 2508. Все остальные генотипы характеризуются доминантным аллелем Е4 – 1229 п.н. (рис. 4). Однако стоит отметить, что у линии 2502 присутствует аллель Е4 , у 2508 – е4-SORE-1 , а их гибрид 4 находится в гомозиготном состоянии по Е4 , что может быть вызвано ошибкой отбора растений из общей популяции линии 2508, которая представлена поколением F 6 , где еще продолжается расщепление гибридной популяции.
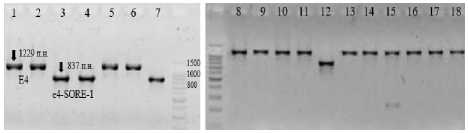
Рисунок 4 – Электрофоретические спектры ПЦР-продуктов, полученных с помощью праймеров маркера гена Е4 .
Дорожки: 1 – Вильямс 82; 2 – Harosoy; 3 – Баргузин; 4 – Элана; 5 – Рысь; 6 – Мамонт; 7 – Свапа; 8 – 2501;
9 – 2502; 10 – 2504; 11 – 2507; 12 – 2508;
13 – Арлета; 14 – Гибрид 1; 15 – Гибрид 2;
16 – Гибрид 3; 17 – Гибрид 4; 18 – Гибрид 5
Известно, что генотипы с максимальным количеством рецессивных аллелей снижают чувствительность к фотопериоду у сои в северных и южных широтах, обеспечивая раннее цветение и созревание [7]. Результаты идентификации генов Е1-Е4 у всех изученных генотипов сои представлены в таблице 2.
Таблица 2
Результаты оценки генотипов сои по молекулярным маркерам и группе спелости
|
Сорт |
Ген/аллель |
Группа спело-сти* |
|||
|
E1/e1-as |
Е2/е2-ns |
E3-Ha/e3-tr |
E4/e4-SORE |
||
|
Вильямс 82 (к) |
e1-as |
E2 |
E3-Ha |
E4 |
– |
|
Harosoy (к) |
e1-as |
е2-ns |
E3-Ha |
E4 |
– |
|
Баргузин |
e1-as |
е2-ns |
e3-tr |
e4-SORE-1 |
2 |
|
Элана |
e1-as |
e2-ns |
e3-tr |
e4-SORE-1 |
2 |
|
Рысь |
e1-as |
е2-ns |
E3-Ha |
E4 |
4 |
|
Мамонт |
E1 |
е2-ns |
E3-Ha |
E4 |
5 |
|
Свапа |
e1-as |
е2-ns |
E3-Ha |
e4-SORE-1 |
3 |
|
Арлета |
e1-as |
е2-ns |
e3-tr |
E4 |
3 |
|
Линия 2501 |
e1-as |
е2-ns |
E3-Ha |
E4 |
4 |
|
Линия 2502 |
e1-as |
е2-ns |
E3-Ha |
E4 |
4 |
|
Линия 2504 |
e1-as |
е2-ns |
e3-tr |
E4 |
4 |
|
Линия 2507 |
e1-as |
е2-ns |
e3-tr |
E4 |
3 |
|
Линия 2508 |
e1-as |
е2-ns |
E3-Ha |
e4-SORE-1 |
3 |
|
Гибрид 1 2502 × Арлета |
e1-as |
е2-ns |
E3-Ha/ e3-tr |
E4 |
3 |
|
Гибрид 2 Арлета × 2502 |
e1-as |
е2-ns |
E3-Ha/ e3-tr |
E4 |
3 |
|
Гибрид 3 2502 × 2507 |
e1-as |
е2-ns |
E3-Ha/ e3-tr |
E4 |
3 |
|
Гибрид 4 2502 × 2508 |
e1-as |
е2-ns |
E3-Ha |
E4 |
4 |
|
Гибрид 5 2504 × 2501 |
e1-as |
е2-ns |
E3-Ha/ e3-tr |
E4 |
3 |
Список литературы Использование молекулярно-генетических маркеров для идентификации генов чувствительности к фотопериоду в селекционном материале сои
- Рынок сои в 2022 году: тенденции и прогнозы: [Электронный ресурс]. Экспертно-аналитический центр агробизнеса: - Режим доступа: https://ab-centre.ru/news/rynok-soi-v-2022-godu-tendencii-i-rognozy.
- Watanabe S., Xia Z., Hideshima R. [et al.]. A map-based cloning strategy employing a residual heterozygous line reveals that the GIGANTEA gene is involved in soybean maturity and flowering // Genetics. - 2011. - Vol. 188. - No. 2. - P. 395-407.
- Xia Z., Watanabe S., Yamada T. [et al.]. Positional cloning and characterization reveal the molecular basis for soybean maturity locus E1 that regulates photoperiodic flowering // Proc. of Nation. Acad. Sci. USA. - 2012. - Vol. 109. - No. 32. - P. E2155-E2164.
- Tsubokura Y., Watanabe S., Xia Z. [et al.]. Natural variation in the genes responsible for maturity loci E1, E2, E3 and E4 in soybean // Ann. Bot. - 2014. - Vol. 113. - No. 3. - P. 429-441.
- Liu B., Kanazawa A., Matsumura H., Takahashi R., Harada K., Abe J. Genetic redundancy in soybean photoresponses associated with duplication of phytochrome A gene // Genetics. - 2008. - 180 (2). - P. 995-1007.
- Watanabe S., Hideshima R., Xia Z. [et al.]. Map-based cloning of the gene associated with the soybean maturity locus E3 // Genetics. - 2009. - 182 (4). - P. 1251-1262.
- Федорина Я.В., Хлесткина Е.К., Сеферова И.В., Вишнякова М.А. Молекулярно-генетические механизмы, лежащие в основе продвижения ареала возделывания сои к северу // Экологическая генетика. - 2022. - Т. 20. - № 1. - С. 13-30. EDN: ILIPDF
- Перфильев Р.Н., Щербань А.Б., Салина Е.А. Разработка панели маркеров для генотипирования отечественных сортов сои по генам, контролирующим срок вегетации и реакцию на фотопериод // Вавиловский журнал генетики и селекции. - 2021. - 25 (7). - С. 761-769.
- Xu M., Xu Z., Liu B., Kong F., Tsubokura Y., Watanabe S., Xia Z., Harada K., Kanazawa A., Yamada T., Abe J. Genetic variation in four maturity genes affects photoperiod insensitivity and PHYA-regulated post-flowering responses of soybean // BMC Plant Biol. - 2013. - No. 13. - Art. No. 91.


