Использование новой навигационной системы картирования "Астрокард" (Россия) с возможностью интеграции компьютерной модели левого предсердия для лечения фибрилляции и трепетания предсердий
Автор: Яшков М.В., Артюхина Е.А., Попов А.Ю., Васин В.А., Ревишвили А.Ш.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.34, 2019 года.
Бесплатный доступ
Цель: представить первый опыт применения нового алгоритма интеграции компьютерной томографии (КТ) сердца системы навигации «Астрокард» (Россия) при выполнении радиочастотной аблации (РЧА) у пациентов с фибрилляцией (ФП) и трепетанием предсердий (ТП).Материал и методы. Тридцати одному пациенту с ФП и двум пациентам с атипичным левопредсердным ТП была проведена электроанатомическая реконструкция левого предсердия (ЛП) и легочных вен (ЛВ) с режимом интеграции КТ сердца. У пациентов с ФП схема аблации включала антральную изоляцию ЛВ; при атипичном левопредсердном ТП осуществлялись линейные воздействия в зоне замедления проведения возбуждения. Продолжительность операции составляла 58±14,5 мин, время флюороскопии 33±8 мин.Заключение. Функция слияния системы навигационного картирования «Астрокард» (Россия) дает точное сопоставление электроанатомической карты с КТ сердца, что позволяет минимизировать время флюороскопии и операции.
Радиочастотная аблация, навигационные системы, электроанатомическое инвазивное картирование, томография
Короткий адрес: https://sciup.org/149125296
IDR: 149125296 | УДК: 616.125.2+004.94]:616.12-008.313.2-089 | DOI: 10.29001/2073-8552-2019-34-2-33-38
Текст научной статьи Использование новой навигационной системы картирования "Астрокард" (Россия) с возможностью интеграции компьютерной модели левого предсердия для лечения фибрилляции и трепетания предсердий
В настоящее время проблема лечения и диагностики аритмий остается одной из актуальных тем современной кардиологии и аритмологии. Аритмии снижают качество жизни пациентов и могут стать причиной временной или стойкой утраты трудоспособности.
Самая распространенная форма нарушения ритма на данный момент – фибрилляция предсердий (ФП). Ее частота в общей популяции составляет 1–2%. Основным интервенционным вмешательством при этой форме аритмии является радиочастотная аблация (РЧА) легочных вен (ЛВ).
«Золотым стандартом» при интервенционном лечении ФП считается антральная изоляция ЛВ [1, 2], во время которой происходит создание непрерывных линейных воздействий вокруг устьев ЛВ. Конечными точками этой процедуры являются отсутствие электрической активности внутри изолированных вен и создание блокады выхода из ЛВ.
Флюороскопия предоставляет ограниченную информацию о строении и морфологии сердца и неполную оценку структур тканей миокарда, поэтому системы трехмерного электроанатомического картирования стали играть все более важную роль в процедуре катетерного лечения аритмий, особенно ФП и атипичного трепетания предсердий (ТП) [3].
На сегодняшний день для выполнения РЧА доступны различные системы электроанатомического картирования, каждая из которых имеет свои достоинства. Наиболее широко используемыми системами навигации являются CARTO 3 (Biosense-Webster, Irvine, CA, US), EnSite NavX (Abbott, USA), Rhythmia HDx (Boston Scientific, Marlboro, Massachusetts, USA). Однако в последние годы активно развиваются и отечественные разработки.
Электроанатомическая реконструкция не дает достаточно точного отображения индивидуальных особенностей внутрисердечных структур, устьев вен, предсердных ушек – все это создает трудности во время интервенционного вмешательства [3]. Для точных радиочастотных воздействий возникает необ- ходимость в более детальной визуализации анатомии камеры сердца, которую можно достичь за счет интеграции компьютерного (КТ) или магнитно-резонансного (МРТ) изображения. Данная функция имеется практически во всех современных системах навигации.
Представляем первый опыт применения нового алгоритма интеграции КТ изображения левого предсердия (ЛП) в системы навигационного картирования «Aстрокард» (Россия) для лечения пациентов с ФП и ТП.
Материал и методы
Радиочастотная изоляция ЛВ с применением нового алгоритма слияния с КТ навигационной системы «Астрокард» (Россия) была выполнена 33 пациентам: 31 (ж. 19, м. 12) с ФП и 2 (м. 2) с атипичным левопредсердным ТП.
Согласно внутреннему протоколу Национального медицинского исследовательского центра хирургии имени А.В. Вишнев-
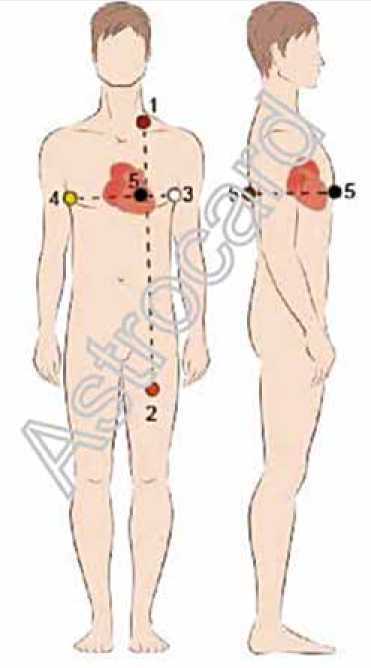
Рис. 1. Схема расположения навигационных электродов системы «Астрокард» (Россия) на поверхности тела пациента. Черный и коричневый электроды накладывались на переднюю и заднюю поверхности грудной клетки в области сердца, белый и желтый электроды по средней подмышечной линии слева и справа, красный в левой надключичной области, оранжевый на левом бедре
Fig. 1. The layout of the navigation electrodes on the surface of the patient’s body, the system “Astrocard” (Russia). Black and brown electrodes were placed on the anterior and posterior surfaces of the chest in the region of the heart. White and yellow electrodes were placed on the middle axillary line to the left and to the right. Red electrode was placed in the left supraclavicular region; orange electrode was placed on the left thigh ского Министерства здравоохранения Российской Федерации, всем пациентам перед интервенционным вмешательством по поводу лечения ФП/левопредсердного ТП проводилась мультиспиральная компьютерная томография (МСКТ) ЛП и ЛВ. Полученные данные МСКТ обрабатывались на программном комплексе «Астрокард» (Россия) для дальнейшей интеграции изображения в систему навигации.
В условиях рентгеноперационной выполнялось электрофизиологическое исследование (ЭФИ). ЭКГ в 12 отведениях (в диапазоне 0,05–160 Гц) и интракардиальные электрограммы (с фильтром 30–700 Гц) регистрировались и записывались на 128-канальном комплексе для проведения внутрисердечных ЭФИ («Астрокард», Россия). Электроанатомическое инвазивное картирование осуществлялось с использованием навигационной системы «Астрокард» (Россия), основанной на регистрации электрического импеданса, для чего на грудную клетку устанавливалось 6 дополнительных навигационных электродов (рис. 1). В последующем всем пациентам выполнялась РЧА.
Для позиционирования внутрисердечных электродов проводилась пункция левой подключичной вены и правой бедренной вены по методике Сельдингера, для доступа к ЛП транссептальная пункция.
В ходе операционного вмешательства через интродьюсер, размещенный в левой подключичной вене, устанавливался диагностический электрод в коронарный синус. Данный электрод является референтом для последующего построения электро-анатомической модели ЛП.
Система навигации «Астрокард» (Россия) позволяет производить анатомическую реконструкцию любым электродом. Типы используемых катетеров определяются навигационной системой автоматически. После электроанатомической реконструкции ЛП выполнялось совмещение построенной модели с обработанным МСКТ изображением. Для этого на электроана-томической реконструкции и модели КТ выбирались референтные точки в разных плоскостях (рис. 2).
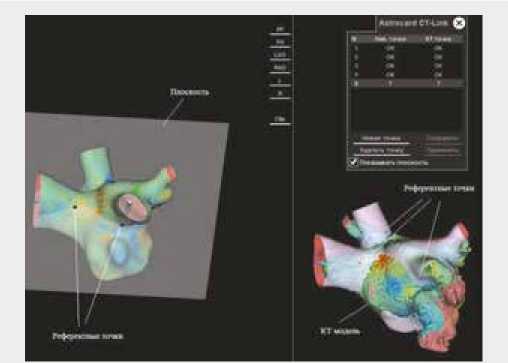
Рис. 2. Выбор точек для совмещения КТ изображения с реконструированной моделью. Плоскость строится среди двух точек. Astrocard CTLink – меню взятия референтных точек и информация об их количестве. КТ – модель КТ. Реконструкция – электроанатомическая модель. Референтные точки – точки для интеграции модели КТ и электроанатомической модели Fig. 2. The choice of points for combining CT images with a reconstructed model. Plane is built among two points. Astrocard CT-Link: menu for taking reference points and information about their number. CT: CT model. Reconstruction is electroanatomical model. Reference points are points for integrating the CT model and the electroanatomical model
При отсутствии удовлетворительного сопоставления модели сердца с КТ изображением выбирались дополнительные референтные точки, и модели вновь сопоставлялись до полной интеграции КТ изображения (рис. 3).
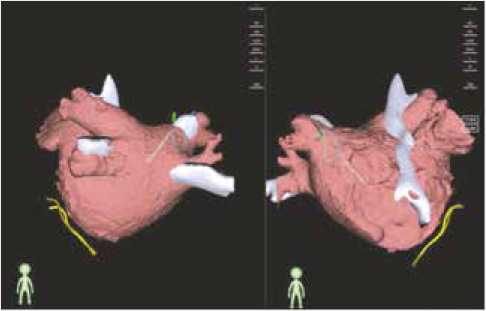
Рис. 3. Сопоставление КТ модели и анатомической реконструкции. Серым обозначена анатомическая реконструкция, цветным – КТ модель
Fig. 3. Fusion of the CT model and anatomical reconstruction. Gray indicates anatomical reconstruction; color indicates the CT model
Дальнейшие манипуляции в ЛП осуществлялись в уже интегрированной КТ модели. При необходимости строились активационные и амплитудные карты. При проведении РЧА ориентировались на следующие критерии: время воздействия (не менее 10 с), отсутствие смещения катетера (не более 3 мм) до предшествующей точки аблации, расстояние до поверхности эндокарда (не более 3 мм). Пациентам с ФП выполнялась антральная изоляция правых и левых ЛВ с верификацией отсутствия спайковой активности и блока выхода, при атипичном ТП построение активационной карты с последующим линейным воздействием в зоне замедленного проведения возбуждения.
Результаты
Во время выполнения антральной радиочастотной изоляции ЛВ отмечалось исчезновение спайковой активности в венах (рис. 4).
В восьми случаях произведена изоляция единого ствола левых ЛВ, в восьми выявлены сближенные левые ЛВ. У двух пациентов визуализирована третья добавочная вена справа, верифицирована ее изоляция. У пациентов с атипичным ТП после выполнения линейных воздействий в ЛП в областях замедления проведения возбуждения достигнуто восстановление синусового ритма.
Продолжительность процедуры при использовании режима совмещения с КТ сердца составила 33±8 мин, время флюороскопии 58±14,5 мин.
Обсуждение
В данном исследовании показана возможность трехмерного картирования камер сердца с помощью отечественной технологии «Астрокард» (Россия). Система дает возможность совмещать получаемую реконструкцию камер сердца с КТ мо-
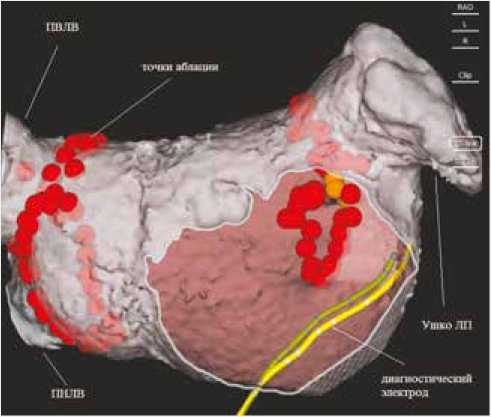
Рис. 4. Интегрированная КТ модель после антральной аблации у пациента с ФП. Красным обозначены аблационные точки. ПВЛВ – правая верхняя легочная вена. ПНЛВ – правая нижняя легочная вена. Ушко ЛП – ушко левого предсердия. Желтым цветом обозначен диагностический электрод, расположенный в коронарном синусе
Fig. 4. Integrated CT model after antral isolation in a patient with atrial fibrillation. Red indicates ablation points. ПВЛВ – right superior pulmonary vein. ПНЛВ – right inferior pulmonary vein.
Ушко ЛП – the appendage of the left atrium. Yellow color indicates the diagnostic electrode located in the coronary sinus делью, полученной на дооперационном этапе. Комбинация КТ модели с активационной или амплитудной картами позволяет повысить точность и эффективность проведения интервенционного лечения при нарушениях ритма сердца. Управление катетером без применения флюороскопии и точность сопоставления реконструированной камеры сердца с КТ моделью значительно уменьшают время флюороскопии и общее время процедуры.
Во всех современных навигационных системах возможно применение функции совмещения с КТ/МРТ: CartoMerge (BW), Rhythmia (BS), Navix Ensite (Abbott). В системе EnSite (Abbott, USA) принцип анатомической реконструкции работы основан на регистрации импеданса, что, с одной стороны, одновременно производит реконструкцию интересующей камеры сердца всеми позиционированными электродами, а с другой, – снижает точность картирования и зависит от стабильности референтных электродов [4].
Система навигации CARTO (Biosense-Webster) применяет технологию магнитной локализации для определения положения датчиков, которые встроены в диагностические и аблационные электроды. Во время интервенционного вмешательства под операционным столом располагается электромагнитная локационная панель, которая излучает серию магнитных полей и позволяет системе точно локализовать, записать и отобразить в реальном времени положение катетера для картирования [5]. Смещение и искажение электроанатомической карты за счет использования магнитных референтов и специальных электродов сводится к минимальному по сравнению с импедансными системами.
Система навигации Rhythmia (Boston Scientific) представляет собой гибридную систему, которая сочетает в себе методику магнитной локализации и технологию, основанную на регистрации импеданса. Магнитная составляющая системы поддерживает навигационные катетеры со специальными магнитными датчиками, обеспечивая максимальную точность и эффективность во время картирования. Функция отслеживания импеданса катетеров позволяет выполнять радиочастотные воздействия, строить активационные, амплитудные карты любыми катетерами.
В ряде исследований показано, что при использовании системы CartoMerge (BW) эффективность радиочастотной изоляции ЛВ не улучшается, но время флюороскопии снижается [6, 7]. Однако применение функции КТ совмещения помогает при атипичной анатомии сердца, что было продемонстрировано при интервенционных вмешательствах у пациентов со сложной анатомией, например, у больных после операции Фонтена [8].
Согласно исследованию по оценке слияния МСКТ сердца и электроанатомической модели, изображения МСКТ могут быть точно объединены с системой трехмерного электроанатоми-ческого картирования. Процедуры катетерной аблации с различными интегрированными методами визуализации имеют преимущества [9].
В рандомизированном исследовании, оценивающем интерфейс работы двух систем (CartoMerge и NavX Fusion), несмотря на более быстрое совмещение КТ модели с электроанатомиче-ским картированием при использовании системы CartoMerge, общее время процедуры и клинические результаты значимо не отличались [10].
Было доказано, что интеграция изображений МСКТ с элек-троанатомическим картированием значительно улучшает успех антральной аблации по широкой области, что подтверждается отсутствием спайковой активности в ЛВ и наличием блока проведения. Кроме того, безопасность РЧА в отношении возникновения стеноза ЛВ повышается по сравнению с контрольной группой, в которой использовалось только обычное электро-анатомическое картирование [11].
Совмещение МСКТ с электроанатомической реконструкцией с высокой точностью отображает реальную трехмерную анатомию ЛП и ЛВ и дает возможность визуализировать истинные анатомические отношения между пищеводом и ЛП [12].
Визуализация эндокардиальной поверхности при использовании внутрисердечной эхокардиографии способствует достижению лучшего слияния между изображением КТ/МРТ и электроанатомической картой (CartoMerge), при этом расхождение со стандартным методом слияния КТ/МРТ изображения составляет 1,2 мм [13].
Выводы
В представленной работе описан первый опыт использования интеграции КТ изображения ЛП в отечественной системе навигационного картирования «Астрокард» (Россия). Функция слияния дает точное сопоставление электроанатомической карты с МСКТ сердца, позволяет строить амплитудные, воль-тажные карты, производить линейные воздействия при нестандартной анатомии ЛП и ЛВ, что минимизирует время флюороскопии и операции.
Список литературы Использование новой навигационной системы картирования "Астрокард" (Россия) с возможностью интеграции компьютерной модели левого предсердия для лечения фибрилляции и трепетания предсердий
- Haissaguerre M., Jais P., Shah D.C., Takahashi A., Hocini M., Quiniou G., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N. Engl. J. Med. 1998 Sept. 3;339(10):659-666. DOI: 10.1056/NEJM199809033391003
- Pappone C., Rosanio S., Oreta G., Tocchi M., Gugliotta F., Vicedomini G., et al. Circumferential radiofrequency ablation of pulmonary vein ostia: a new anatomic approach for curing atrial fibrillation. Circulation. 2000 Nov. 21;102(21):2619-2628.
- Dickfeld T., Calkins H., Zviman M., Kato R., Meininger G., Lickfett L., et al. Anatomic stereotactic catheter ablation on three-dimensional magnetic resonance images in real time. Circulation. 2003;108(19):2407-2413. DOI: 10.1161/01.CIR.0000093191.05433.B0
- Derndorfer M., Pürerfellner H. High-density Mapping - Toy or Tool? European Journal of Arrhythmia & Electrophysiology. 2018;4(2):47-49. DOI: 10.17925/EJAE.2018.4.2.47
- Stabile G., Scaglione M., del Greco M., De Ponti R., Bongiorni M.G., Zoppo F., et al. Reduced fluoroscopy exposure during ablation of atrial fibrillation using a novel electroanatomical navigation system: a multicentre experience. Europace. 2012;14(1):60-65. DOI: 10.1093/europace/eur271
- Caponi D., Corleto A., Scaglione M., Blandino A., Biasco L., Cristoforetti Y., et al. Ablation of atrial fibrillation: does the addition of threedimensional magnetic resonance imaging of the left atrium to electroanatomic mapping improve the clinical outcome? A randomized comparison of Carto-Merge vs. Carto-XP three-dimensional mapping ablation in patients with paroxysmal and persistent atrial fibrillation. Europace. 2010;12(8):1098-1104.
- DOI: 10.1093/europace/euq107
- Vivek Y. Reddy. Mapping and Imaging. In: Cardiac Electrophysiology: From Cell to Bedside. 6th ed. Saunders; 2014:581-593.
- DOI: 10.1016/B978-1-4557-2856-5.00060-1
- Pflaumer A., Deisenhofer I., Hausleiter J., Zrenner B. Mapping and ablation of atypical flutter in congenital heart disease with a novel three-dimensional mapping system (Carto Merge®). Europace. 2006 Feb.;8(2):138-139.
- DOI: 10.1093/europace/euj032
- Tops L.F., Bax J.J., Zeppenfeld K., Jongbloed M.R., Lamb H.J., van der Wall E.E., et al. Fusion of multislice computed tomography imaging with three-dimensional electroanatomic mapping to guide radiofrequency catheter ablation procedures. Heart Rhythm. 2005 Nov.;2(10):1076-1081.
- DOI: 10.1016/j.hrthm.2005.07.019
- Finlay M.C., Hunter R.J., Baker V., Richmond L., Goromonzi F., Thomas G., et al. A randomised comparison of Cartomerge vs. NavX fusion in the catheter ablation of atrial fibrillation: the CAVERN Trial. Journal of Interventional Cardiac Electrophysiology. 2012 Mar.;33(2):161-169.
- DOI: 10.1007/s10840-011-9632-7
- Martinek M., Nesser H.-J., Aichinger J., Boehm G., Purerfellner H. Impact of integration of multislice computed tomography imaging into three dimensional electroanatomic mapping on clinical outcomes, safety, and efficacy using radiofrequency ablation for atrial fibrillation. Pacing Clin. Electrophysiol. 2007 Sept. 25;30(10):1215-1223.
- DOI: 10.1111/j.1540-8159.2007.00843.x
- Piorkowski C., Hindricks G., Schreiber D., Tanner H., Weise W., Koch A., et al. Electroanatomic reconstruction of the left atrium, pulmonary veins, and esophagus compared with the "true anatomy" on multislice computed tomography in patients undergoing catheter ablation of atrial fibrillation. Heart Rhythm. 2006;3(3):317-327.
- DOI: 10.1016/j.hrthm.2005.11.027
- Rossillo A., Indiani S., Bonso A., Themistoclakis S., Corrado A., Raviele A. Novel ICE-guided registration strategy for integration of electroanatomical mapping with three-dimensional CT/MR images to guide catheter ablation of atrial fibrillation. J. Cardiovasc. Electrophysiol. 2009 Mar. 23;20(4):374-378.
- DOI: 10.1111/j.1540-8167.2008.01332.x


