Использование полимерных нановолокон для исследования структурной анизотропии культуры иммортализованных сердечных клеток
Автор: Тепленин Александр Сергеевич, Ерошенко Любовь Владимировна, Ерофеев Иван Станиславович, Агладзе Константин Игоревич
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Бионанофизика
Статья в выпуске: 1 (17) т.5, 2013 года.
Бесплатный доступ
Клетки линии HL-1 представляют собой иммортализованные кардиомиоциты предсердия, способные к спонтанному сокращению и экспрессирующие основные кардио-специфические белки. Относительно недавно в HL-1 удалось трансфецировать светочувствительный ионный канал - канальный родопсин 2, что позволило управлять динамическими характеристиками возбудимой клеточной системы с помощью света с длиной волны около 480 нм. В настоящей работе эти клетки культивировались на нановолоконном субстрате. Это дало возможность помимо фотоконтроля управлять морфологией клеток и создавать выделенное направление распространения волн возбуждения. С помощью методов оптического картирования в работе было проведено исследование поведения, характеристик и взаимодействия спиральных волн возбуждения в созданной анизотропной среде.
Оптическое картирование, клеточная культура, нановолокон- ный субстрат, канальный родопсин-2, спиральные волны
Короткий адрес: https://sciup.org/142185887
IDR: 142185887
Текст научной статьи Использование полимерных нановолокон для исследования структурной анизотропии культуры иммортализованных сердечных клеток
Успехи молекулярной, клеточной биологии и материаловедения привели в последнее десятилетие к бурному развитию такой области науки, как тканевая инженерия сердца. Фактически исследователи вплотную подошли к возможности создания тканей организма, с заранее определенными свойствами. Бурное развитие этого направления тканевой инженерии не случайно: именно отказы в работе сердечно-сосудистой системы являются ведущей причиной смертности в современных индустриально развитых странах. Как известно, особенностью сердечной ткани является ярко выраженная структурная и функциональная анизотропия, которая необходима для поддержания нормальной работы сердца, что было показано в ряде работ [1]. Наиболее удобной и простой моделью для исследования возбудимости сердечной ткани является монослой из кардиомиоцитов, помещаемый на. подложку субстрат, структурированную таким образом, чтобы придать клеточной культуре требуемую архитектуру. В качестве клеточного материала используют клетки, выделяемые из неонатальных сердец крыс [2,3] или клетки иммортализованной клеточной линии [4]. Для придания подложке требуемой анизотропии используются: нанесение нановолокон, полученных методом электроспиннинга. [5], микропаттернинг фактора, прикрепления [6,7], мик-рогрувинга [6,8]. В данной работе мы использовали полимерные нановолокна. для формирования архитектуры ткани, а. волны возбуждения регистрировали с помощью установки оптического картирования возбуждения [9]. В качестве светочувствительных клеток использовались клетки HL-1, с трансфецированным в них белком канальным родопсином-2, являющимся светоуправляемым неспецифическим ионным каналом [10]. Было исследовано поведение вращающихся спиральных волн в анизотропной возбудимой среде, а. также их взаимодействие.
2. Материалы и методы2.1. Изготовление подложек методом электроспиннинга
В качестве полимерного раствора для электроспиннинга использовался 13% раствор полиметилглутаримида (polymethylglutarimide, PMGI, MICROCHEM Corp. (МА, USA)) в циклопентаноне и тетрагидрофурфуроле. Спиртовой раствор поверхностно-активного вещества додецилсульфата натрия был добавлен к раствору полимера в конечной концентрации 1.44 г/л. Полидиметилсилоксан (PDMS) приготовлялся с добавлением катализатора в массовом соотношении 1:10 к мономеру на плоской чашке Петри. Для прохождения реакции полимеризации чашка Петри с полимером содержалась при температуре 80 °C. Приготовленный раствор PMGI помещался в шприц 1 мл с диаметром тупоконечной иглы 0.51 мм, который в свою очередь помещался в электроспиннинговую установку Nanon (МЕСС. Corp, Japan). Скорость подачи полимера составляла 2 мл/ч, напряжение между кончиком иглы и коллектором было 8-12 кВ. Расстояние от конца иглы до заземленного коллектора составляло 15 см. Коллектор фактически являлся двухэлектродной системой, описанной в [11], представляющей собой круглую пластинку из алюминиевой фольги толщиной 0.1 мкм с вырезанной в ней прямоугольной щелью шириной 1.5-2.5 см и глубиной 5 см. Собранные на щели коллектора линеаризованные в одном направлении нановолокна PMGI были перенесены на подложку из PDMS соответствующего размера [5]. Потом волокна переносились с кусочка PDMS на покровные стекла методом температурного мик-роконтактного принтинга: покровное стекло (размер 22 мм) было помещено на нагревательную плитку с температурой 200 °C, нановолокна на подложке из PMGI были приведены в контакт с нагретой поверхностью стекла. После охлаждения до комнатной температуры и удалении подложки из PDMS нановолокна оставались прикрепленными к покровному стеклу.
2.2. Клеточная культура HL-1
Для культивирования клеточной линии HL-1 использовалась среда Клейкомба [4]. Среда приготовлялась из следующих реагентов без дальнейшей очистки: L-Glu L-Glutamine (Глутамин), Invitrogen; FBS Fetal bovine serum (сыворотка из крупного рогатого скота), Sigma Aldrich; PBS Phosphate buffer standard (стандартный фосфатный буфер), Invitrogen; HF Human Fibronectin (человеческий фибронектин), Invitrogen; Trypsin/EDTA Trypsin (трипсин 0,25%, EDTA 0,2%), Invitrogen; PS Penicilin/Streptomycin (пеници-лин/стрептомицин, 1 мл PS содержит 100 ед/мл пеницилина, 100 ед/мл стрептомицина) Invirogen. Клетки выращивались во флаконах Т25 (площадь дна 25 см2) в СО2-инкубаторе при 37 °C. Поскольку используемые среды содержали фенолред, то можно было наблюдать за кислотным состоянием клеток, следя за окраской среды.
2.3. Приготовление образцов для микроскопии и оптического картирования
Покровные стекла, покрытые нановолокнами, помещались либо в шестилуночный планшет, либо в отдельные чашки Петри. На каждое стекло высаживалась капля суспензии клеток объема 1 мл, содержащая 0,5-1 миллион клеток. После помещения образца в инкубатор на 1 час к суспензиям клеток на стеклах добавлялось по 2 мл среды. Для окрашивания активных филаментов клеток клетки монослоя, выращенного на нановолоконном субстрате, были зафиксированы при помощи 4% раствора параформальдегида в PBS в течение 10 минут, затем раствор отмывался 2 мл PBS 2-3 раза. Для пермеабилизации клеток добавлялся 0,1% Triton 100, растворенный в PBS на 10 мин. Затем для устранения неспецифического фона после отмывки при помощи PBS (2-3 раза) наливался 1% раствор BSA в PBS на 20 мин. После отмывки PBS была добавлена флуоресцентная краска Alexa Fluor 488 Phalloidin
Conjugate на 40 минут. Уже после отмывки PBS были сняты фотографии актиновых филаментов при помощи флуоресцентного микроскопа. Для оптического картирования образцы окрашивались в растворе Fluo-4, как это описано в [5].
2.4. Установка оптического картирования
Для оптического картирования использовалась установка, состоящая из следующих компонентов:
1) высокочувствительной скоростной видеокамеры (Andccor ІХопЗ, Andor Technologies) на основе ПЗС-матрицы для наблюдения волн в реальном времени и записи видеоряда;
2) ртутной лампы (Olympus U-RFL-T), служащей источником света для возбуждения флуоресценции;
3) оптического микроскопа (Olympus MVX10) с фильтровым кубом (Olympus U-M49002XL). Для стимуляции фоточувствительных клеток использовался ионный лазер (Melies Griot 35-LAP-321-230) с регулируемой длиной волны излучения. Оптический модулятор (Avesta Project, OCV-4800FD) позволял подавать свет импульсами. Контролирующий блок оптического модулятор позволял регулировать частоту и длительность импульсов.
3. Результаты3.1. Влияние подложки из нановолокон на морфологию клеток HL-1
3.2. Картирование волн возбуждения монослоя клеток, выращенных на нановолоконном субстрате
3.3. Спиральные волны в анизотропной среде
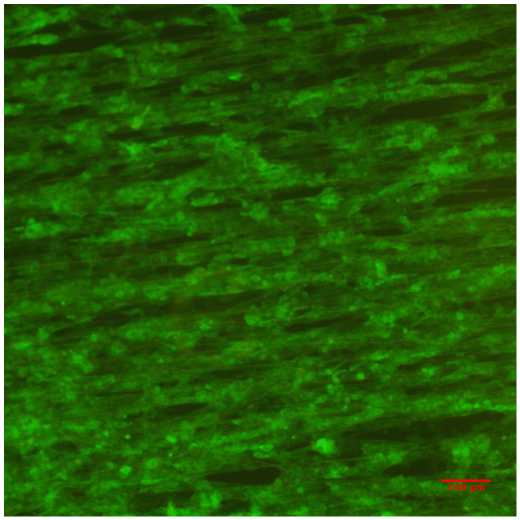
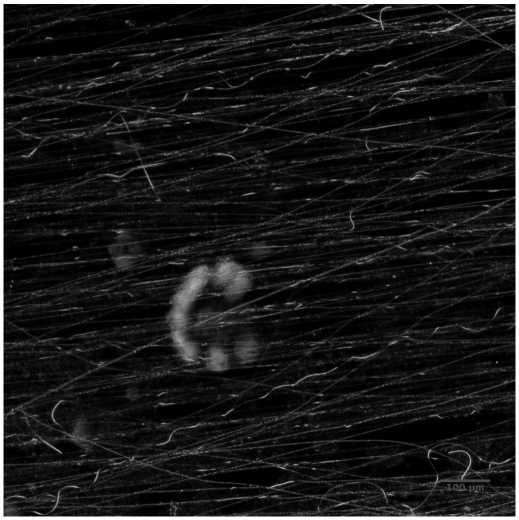
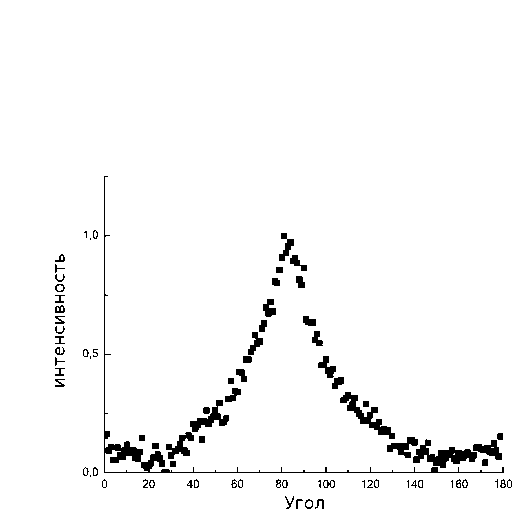
На первом этапе исследовалось влияние подложки, представляющей собой покровное стекло с нанесенными на него нановолокнами PMGI, на морфологию клеток. На покровные стекла с нанесенными на них нановолокнами высаживались клетки HL-1. Линейная плотность волокон варьировалась в пределах от 50 до 100 волокон/мм. На рис. 1 представлена фотография элонгированных клеток HL-1 на нановолокнах PMGI, полученная методом фазового контраста. Аналогично [5] определялась коллективная соориентация актиновых филаментов клеток в направлении нановолокон рис. 2. Полученные данные свидетельствуют о схожести морфологической структуры монослоя клеток кардиомиоцитов HL-1 на анизотропной подложке с кардиомиоцитами, полученными из неонатальных крысят [5], несмотря на менее организованную ультраструктуру.
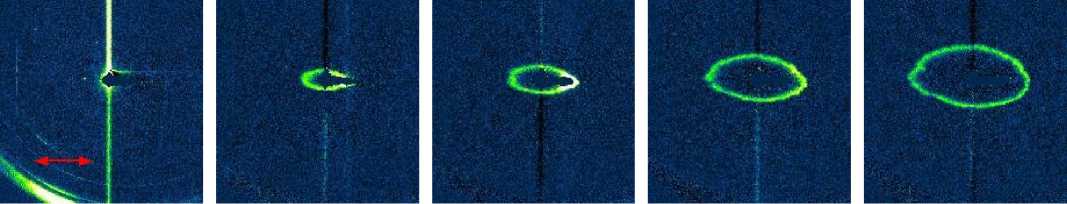
Полностью конфлюэнтные монослои клеток с канальным родопсином стимулировались импульсами лазерного излучения с длиной волны 480 нм. На рис. 4 и рис. 5 представлены фотографии фронта, индуцированной лазерным импульсом волны возбуждения в последовательные моменты времени и на рис. 3, рис. 6 пространственно-временная развертка распространяющегося фронта. Можно заметить, что фронт волны на данных изображениях имеет вид, приближенный к эллиптическому. Соотношение скоростей распространения вдоль волокон и поперек волокон составляло 1,5 для линейной плотности 50 волокон/мм и 2,0 для линейной плотности 100 волокон/мм.
Полученные результаты показывают, что характер распространения волн возбуждения в культуре HL-1 на нановолоконной подложке схож с характером распространения волн в культуре неонатальных кардиомиоцитов при аналогичной степени анизотропии на субстрате такого же типа [5]. Однако стоит отметить, что для достижения соотношения скоростей 2,0 на культуре HL-1 необходима большая линейная плотность нановолокон по сравнению с полученной для кардиомиоцитов неонатальных крысят [5].
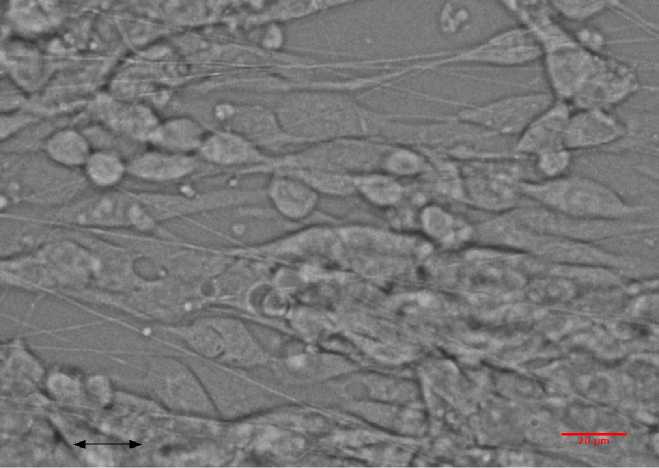
Рис. 1. Элонгация одиночных клеток кардиомиоцитов HL-1 вдоль паповолокоп PMGI. Двунаправленной стрелкой показано направление паповолокоп
Помимо круговых индуцированных волн в культуре кардиомиоцитов HL-1 наблюдались вращающиеся спиральные волны. На рис. 7 представлены снимки фронта спиральной волны в последовательные моменты времени.
С помощью обработки пространственно-временной развертки был измерен размер «псевдоядра» спиральной волны, причем продольные размеры псевдоядер для различных спиральных волн находились в диапазоне 2,5-3,7 мм, а поперечные — в диапазоне 1,42,1 мм, отношение размеров находилось в пределах 1,5-2,5, т.е. форма псевдоядра оказалась вытянутой, что соответствует литературным данным, полученным для тонких слоев эпикарда собаки и овцы [9].
3.4. Взаимодействие спиральных волн в анизотропной среде
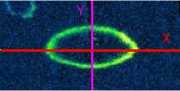
Помимо одиночных спиральных волн на анизотропных монослоях наблюдалось также взаимодействие 2-х спиральных волн с близкими частотами. На культуре монослоя клеток были инициированы 2 спиральные волны (рис. 8а) с частотами ~2,9 Гц (верхняя волна) и ~2,8 Гц (нижняя волна). Как следствие, верхняя волна подавляла нижнюю, что хорошо иллюстрируется изменением положения встречи волновых фронтов (красная горизонтальная линия на рис. 8а), для вертикальной фиолетовой линии была сделана пространственновременная развертка (рис. 8Ь), красной линией на данном рисунке показано перемещение места встречи фронтов 2-х волн с течением времени, что иллюстрирует кинетику подавления волны. Зеленой линией показано предполагаемое положение границы, если бы не происходило ее движения.
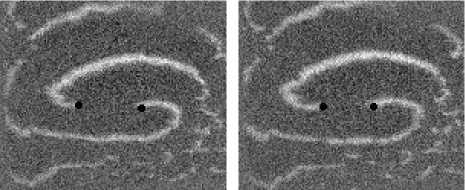
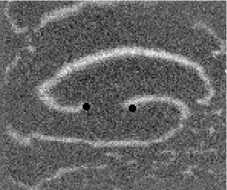
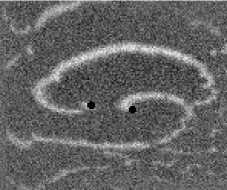
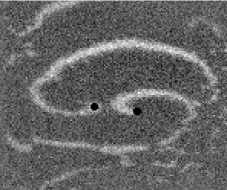
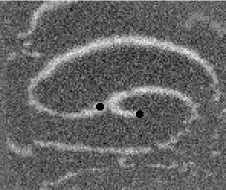
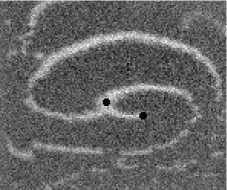
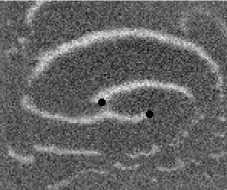
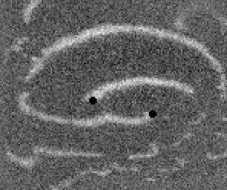
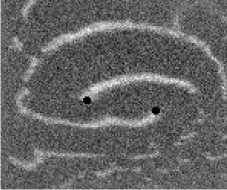
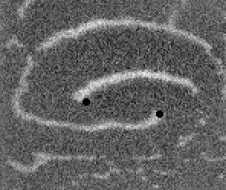
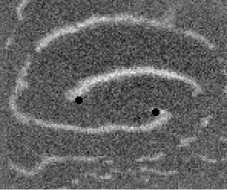
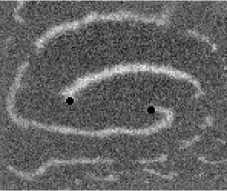
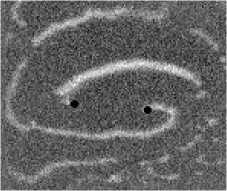
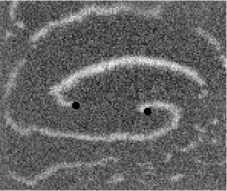
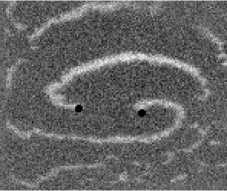
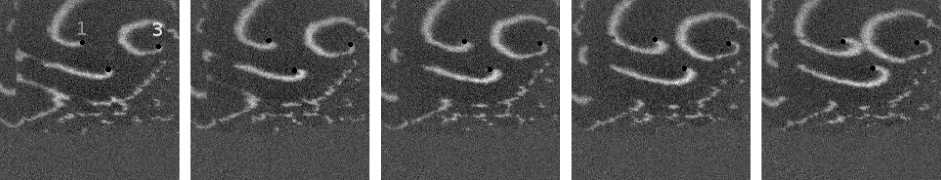
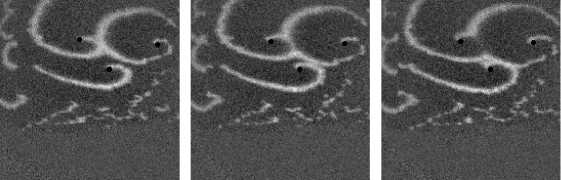
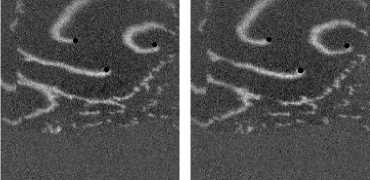
Не менее интересный эффект наблюдался в другом типе взаимодействия двух спиральных волн в анизотропной культуре кардиомиоцитов HL-1 с AR = 2. В данной среде были инициированы 2 дрейфущие спиральные волны (т. е. волны с движущимся кончиком), причем расстояние между центрами этих волн в начальный момент составляло ~ 0, 5 см, также эти волны имели одинаковую частоту 3,3 Гц. На рис. 9 изображены 2 взаимодействующие спиральные волны в последовательные моменты времени (черной точкой на каждом снимке отмечен центр каждой спирали). А на рис. 10 отмечены положения центров спиралей во все моменты времени, соответствующие снимкам на рис. 9. Из этих 2 рисунков можно видеть, что положение центров спиральных волн колеблется в горизонтальном направлении,
а
b
с
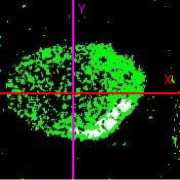
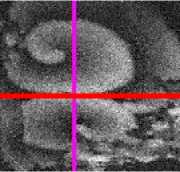
Рис. 2. Сонаправленная ориентация ct-актина монослоя клеток HL-1, выращенных на однонаправленных нановолокнах: (а) — изображение распределения актиновых, полученное при помощи флуоресцентного микроскопа; (Ь) — фотография нановолокон, на которых были выращены клетки; (с) — угловое распределение однонаправленной ориентированности а-актина
0 мс 300 мс 450 мс 900мс 1000 мс
Рис. 3. Фотографии распространения фронта волны возбуждения в среде с AR = 2 в последовательные моменты времени. Двунаправленной стрелкой показана ориентация нановолокон
причем эти колебания происходят в противофазе. Благодаря этому факту возникает следующий эффект. На рис. 9 видно, что в промежутке времени 0-250 мс центры спиральных
а

b

с
Рис. 4. Пространственно-временная развертка стимулированной волны в среде с AR = 2.0

0 мс
150 мс 300 мс
450мс 600 мс
а
Рис. 5. Фотографии распространения фронта волны возбуждения в среде с AR = 1.5 в последовательные моменты времени, двунаправленной стрелкой показана, ориентация нановолокон

Рис. 6. Пространственно-временная развертка индуцированной волны в среде с AR = 1,5

0 мс
200 мс 400 мс
550мс 700 мс
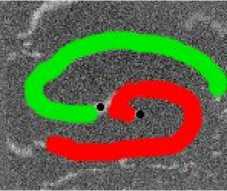
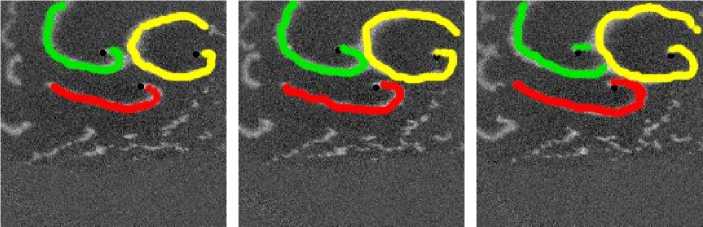
Рис. 7. Фотографии спиральной волны с AR = 2 в различные моменты времени, период спиральной волны Т = 700 мс, двунаправленной стрелкой показана ориентация иаиоволокои волн сближаются. В момент времени 250 мс центр левой волны встречается с фронтом правой волны, фактически в данный момент объединенная форма, фронтов обеих волн имеет S-образную структуру. Потом 300-350 мс центр левой волны «захватывает» часть фронта, правой волны, т. е. восстанавливается левая спиральная волна, и начинает обратный дрейф к своему положению в первоначальный момент. При этом правая спиральная волна, «захватывает» часть фронта, левой волны «взамен потерянной» части, «украденной» другой волной. Процесс «обмена» волновыми фронтами для промежутка. 250-400 мс проиллюстрирован на. рис. 11: зеленым цветом подкрашен фронт, который до момента, встречи двух волн принадлежал левой волне, а. красным — правой. С 350 мс центры спиральных волн начинают дрейфовать уже в противоположных направлениях.
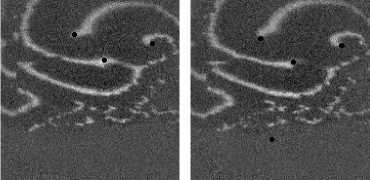
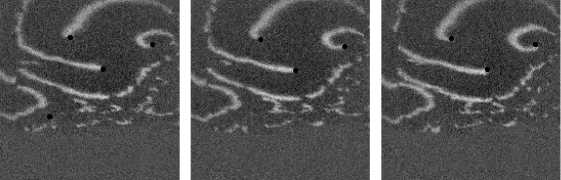
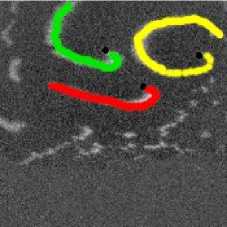
Наблюдалось также взаимодействие 3-х спиральных волн в анизотропной среде с AR = 2. На рис. 12 изображены 3 взаимодействующие спиральные волны в последователь-
а

b
Рис. 8. Движение границы столкновения 2-х спиральных воли. Красной горизонтальной линией на. рисунке (а) изображена, граница, столкновения воли. От вертикальной фиолетовой линии взята, пространственно-временная развертка. — (Ь). На рисунке (Ь) красной линией показано движение положения границы встречи 2-х воли с течением времени. Зеленой линией показано положение встречи фронтов, если бы их положение не менялось со временем
250 мс
150 мс
450 мс
550 мс
600 мс
650 мс
700 мс
750 мс
Рис. 9. Фотографии 2-х взаимодействующих дрейфующих спиральных воли в последовательные моменты времени (положение центров обеих воли на. каждой фотографии отмечены черной точкой)
ные моменты времени (на. первом снимке волны, а. именно их кончики, пронумерованы, на. всех снимках положения кончиков спиралей отмечены черной точкой). При «столкновениях» спиральных волн наблюдался эффект, аналогичный описанному в предыдущем параграфе при взаимодействии двух спиральных волн, а. именно, «обмен» волновыми фронтами

Рис. 10. Положения центров спиральных воли в последовательные моменты времени, соответству
ющие рис. 9, объединенные на. одном кадре
250 мс

300 мс 350 мс 400 мс
Рис. 11. Процесс обмена, волновыми фронтами у 2-х спиральных воли. В момент времени 250мс центр левой волны (ее фронт отмечен зеленый цветом) встречается с фронтом правой волны (отмечен красным цветом). На кадре 350 мс левая волна, «забирает» волновой фронт правой волны, теряет свой фронт, который «подхватывает» правая спиральная волна. Таким образом на. кадре 400 мс зафиксирован момент после обмена, фронтами и начало дрифта, центров спиральных воли в противоположные направления
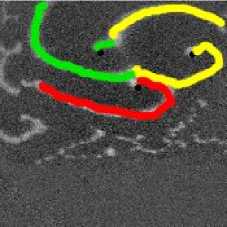
у 3 волн. На. рис. 13 изображен данный процесс: в момент времени 200 мс фронт первой спиральной волны сталкивается с фронтом третьей волны, потом на кадре 300 изображено, что 2-я волна, сталкивается с 3-й, в момент 350 мс 1-я волна, «крадет» часть фронта. 3-й волны. В то же самое время происходит встреча. 2-й спиральной волны с «оторвавшимся» фронтом первой волны. После сложного столкновения трех фронтов, в момент 400 мс 2-я спиральная волна, «захватывает» фронт первой волны, при этом от нее «отрывается» фронт, который принадлежал ей до столкновения, и начинает свободно распространяться к краю образца.
4. Выводы
В данной работе было показано, что линейная плотность нановолокон субстрата, влияет на АН анизотропного распространения волн в монослое кардиомиоцитов. В результате на. данных подложках удалось получить спиральные волны и исследовать их поведение, характеристики, различные типы взаимодействий между собой.
Данная работа была выполнена в рамках исследований, осуществляющихся по гранту № 11.G34.31.0015 от 30 ноября 2010 г. Правительства Российской Федерации для государственной поддержки научных исследований, проводимых под руководством ведущих ученых в российских образовательных учреждениях высшего профессионального образования, а. также Министерством образования и науки Российской Федерации.
0 мс 50 мс 100 мс
250 мс 300 мс 350 мс
150 мс 200 мс
500 мс 550 мс 600 мс
400 мс 450 мс
650мс 700 мс
150 мс
Рис. 12. Фотографии 3 взаимодействующих спиральных воли в последовательные моменты времени. На первом кадре спиральные волны пронумерованы
350 мс
200 мс 250 мс 300 мс
400 мс
450 мс
500 мс
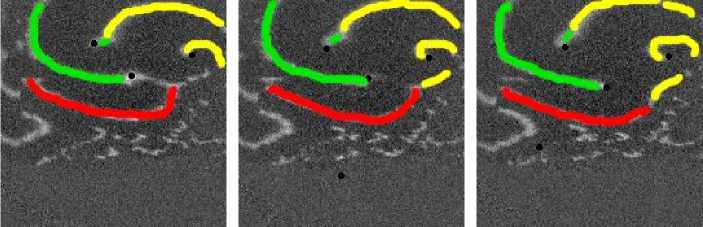
Рис. 13. Обмен волновыми фронтами у 3 спиральных воли. В момент времени 200 мс происходит встреча, волновых фронтов 1-й волны (зеленый цвет) и 3-й (желтый цвет). На кадре 350 мс 1-я «забирает» фронт у 3-й волны после столкновения, изображенного на. предыдущих кадрах. На этом же кадре 2-я волна, (красный цвет) сталкивается с оторвавшимся от 1-й волны зеленым фронтом. После этого 2-я волна, «захватывает» оторвавшийся зеленый фронт от 1-й волны. При этом она. теряет свой собственный волновой фронт (красный цвет), который она. «имела» на. снимке 350 мс. После этого красный фронт «отрывается»
Список литературы Использование полимерных нановолокон для исследования структурной анизотропии культуры иммортализованных сердечных клеток
- Baig M.K., Mahon N., McKenna W.J., Caforio a.L., Bonow R.O., Francis G.S., Gheorghiade M. The pathophysiology of advanced heart failure//Heart & lung: the journal of critical care. -1998. -V. 28, N 2. -P. 87-101.
- Chlopc.ıkov.a S., Psotov.a J., P. Miketov.a P. Neonatal rat cardiomyocytes-a model for the study of morphological, biochemical and electrophysiological characteristics of the heart//Biomedical papersof the Medical Faculty of the University Palack.y, Olomouc, Czechoslovakia. -Dec. 2001. -V. 145. -P. 49-55.
- Zhang Y., Sekar R.B., McCulloch A.D., Tung L. Cell cultures as models of cardiac mechanoelectric feedback//Progress in biophysics and molecular biology. -2008. -V. 97, N 2-3. -P. 367-82.
- Claycomb W.C., Lanson N.A., Stallworth B.S., Egeland D.B., Delcarpio J.B., Bahinski A., Izzo N.J. HL-1 cells: a cardiac muscle cell line that contracts and retains phenotypic characteristics of the adult cardiomyocyte//Proceedings of the National Academy of Sciences of the United States of America. -Mar. 1998. -V. 95. -P. 2979-84.
- Orlova Y., Magome N., Liu L., Chen Y., Agladze K. Electrospun nanofibers as a tool for architecture control in engineered cardiac tissue//Biomaterials. -Aug. 2011. -V. 32. -P. 5615-24.
- Bursac N. Cardiomyocyte Cultures With Controlled Macroscopic Anisotropy: A Model for Functional Electrophysiological Studies of Cardiac Muscle//Circulation Research. -Nov. 2002. -V. 91. -P. 45e-54.
- Bursac N., Tung L. Acceleration of functional reentry by rapid pacing in anisotropic cardiac monolayers: formation of multi-wave functional reentries//Cardiovascular research. -Feb. 2006. -V. 69. -P. 381-90.
- Motlagh D., Hartman T.J., Desai T.A., Russell B. Microfabricated grooves recapitulate neonatal myocyte connexin43 and N-cadherin expression and localization//Journal of biomedical materials research. Part A. -Oct. 2003. -V. 67. -P. 148-57.
- Davidenko J.M., Pertsov A.V., Salomonsz R. Stationary and drifting spiral waves of excitation in isolated cardiac muscle//Nature. -1992. -V. 355. -P. 349-351.
- Nagel G., Szellas T., Huhn W. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel//Proceedings of the. -2003.
- Li D., Xia Y. Electrospinning of Nanofibers: Reinventing the Wheel?//Advanced Materials. -July 2004. -V. 16. -P. 1151-1170.


