Использование спектроскопии гигантского комбинационного рассеяния для поиска фармакодинамических предикторов ответа на антиагрегантную терапию
Автор: Моисеева Е.М., Рафальский В.В., Соколов А.Н., Зюбин А.Ю., Бычкова Я.А., Самусев И.Г.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.38, 2023 года.
Бесплатный доступ
Цель исследования: изучить возможность применения спектроскопии гигантского комбинационного рассеяния света (ГКРС) для поиска фармакодинамических биомаркеров, позволяющих прогнозировать ответ пациентов на антиагрегантную терапию (АТ).Материал и методы. Общее количество участников исследования составило 152. Субъекты были разделены на 4 группы: здоровые добровольцы, не получавшие АТ (группа 1) и получавшие ацетилсалициловую кислоту (АСК) (группа 2); пациенты, страдающие сердечно-сосудистыми заболеваниями (ССЗ) без АТ (группа 3) и получавшие АТ (группа 4). У всех субъектов была проведена агрегометрия и изучение ГКРС-спектров тромбоцитов. Для получения ГКРС-спектров тромбоцитов был разработан оригинальный оптический сенсор на основе модифицированной золотыми частицами наноструктурированной титановой поверхности.Результаты. Выявлены статистически значимые различия по интенсивностям ГКРС-спектров тромбоцитов, полученных в группах 1 и 3, а также в группах 2 и 4 для четырех частотных сдвигов (ЧС) ГКРС, а именно - 485, 505, 990, 1465 см-1. Выявлены корреляции между ГКРС-спектрами группы 2 и результатами агрегометрии с активатором Coll/ADP; между ГКРС-спектрами всех субъектов групп 1-4 и результатами агрегометрии с активатором P2Y; между ГКРС-спектрами, полученными в группе 4, и результатами агрегометрии с активатором P2Y.Заключение. Метод ГКРС-спектроскопии может быть использован для диагностики состояния тромбоцитов у пациентов с ССЗ и мониторинга эффектов АТ. Для изучения фармакодинамических эффектов АТ наиболее подходящими являются значения интенсивностей ГКРС-спектров на ЧС - 485, 505, 990, 1465 см-1. Выявленные спектральные изменения тромбоцитов у пациентов с ССЗ коррелируют с изменениями агрегометрии с активатором P2Y, что указывает на возможность использования метода ГКРС-спектроскопии для оценки фармакодинамических эффектов ингибиторов P2Y12 рецепторов.
Тромбоциты, антиагреганты, гкрс-спектроскопия, фармакокинетика, ацетилсалициловая кислота, клопидогрел
Короткий адрес: https://sciup.org/149143639
IDR: 149143639 | УДК: 616.155.25-085.273.5.015:543.424.2 | DOI: 10.29001/2073-8552-2022-538
Текст научной статьи Использование спектроскопии гигантского комбинационного рассеяния для поиска фармакодинамических предикторов ответа на антиагрегантную терапию
Несмотря на значительные достижения в профилактике и лечении атеротромбоза, сердечно-сосудистые заболевания (ССЗ) остаются наиболее распространенной причиной смерти в мире. Смертность от ССЗ все еще превалирует над другими причинами смертности. Также следует отметить, что 14,5% людей, погибших от ССЗ, относятся к группе трудоспособного возраста [1].
Согласно рекомендациям Российского кардиологического общества, ацетилсалициловая кислота (АСК) 75– 100 мг ежедневно рекомендуется всем пациентам со стабильной ишемической болезнью сердца (ИБС), если она не противопоказана (Класс I, Уровень доказательств А) [2]. В то же время сохраняется проблема недостаточно высо- кого ответа пациентов на терапию антиагрегантными препаратами (АП) [3]. О данной особенности ответа на терапию АП сообщалось у пациентов с сердечно-сосудистыми, цереброваскулярными и периферическими сосудистыми заболеваниями [4, 5]. Метаанализ более 50 исследований показал, что резистентность к АСК и клопидогрелю значительно повышает риск развития больших сердечнососудистых событий (MACE) [6]. По литературным данным, распространенность резистентности к АСК варьирует от 20 до 60% [4, 6, 7]. Резистентность к клопидогрелю, по разным источникам, варьирует от 3 до 65% [6, 8].
В связи с отсутствием единообразного подхода актуальным является разработка и валидация предиктивных биомаркеров для повышения эффективности и безопасности терапии с использованием АП.
Большая часть лабораторных методов исследования функции тромбоцитов измеряет сложные процессы, которые в конечном итоге приводят к агрегации или адгезии тромбоцитов [9]. Наиболее часто используемыми методами для изучения антитромбоцитарных эффектов АСК являются методы оценки неспецифической функции тромбоцитов, такие как агрегометрия светопропускания или агрегометрия цельной крови [10]. Однако оценка тромботического статуса на основе реакции тромбоцитов только на одного или двух агонистов игнорирует сложность механизма образования тромбов in vivo, и полученные в ходе исследований лабораторные данные не всегда коррелируют с клиническими исходами.
Цель данного исследования: изучить возможности применения метода гигантского комбинационного рассеяния света (ГКРС) для поиска фармакодинамических биомаркеров, позволяющих прогнозировать ответ пациентов на антиагрегантную терапию (АТ) и возможности персонализации терапии.
Материал и методы
Субъекты исследования. В исследовании приняли участие здоровые добровольцы и пациенты с ССЗ. Протокол проведения исследования был одобрен Независимым этическим комитетом (выписка из протокола заседания № 8 от 16.05.2019 г.). Все субъекты исследования подписали 2 экземпляра информированного согласия до проведения всех процедур, предусмотренных исследованием.
У всех субъектов исследования была проведена оценка факторов сердечно-сосудистого риска. К факто- рам сердечно-сосудистого риска отнесены: мужской пол, возраст старше 55 лет у мужчин и старше 65 лет у женщин, менопауза, наследственная отягощенность по ССЗ, сахарный диабет, курение, дислипидемия, артериальная гипертензия, избыточная масса тела и ожирение, употребление алкоголя. Функциональный класс хронической сердечной недостаточности был определен по тесту дистанции ходьбы за 6 мин.
Общее количество обследованных субъектов составило 152. Субъекты были разделены на 4 группы (табл. 1), это позволило более точно стратифицировать обследованных и использовать клинические данные: группа 1 – здоровые добровольцы без ССЗ (SCORE < 1%), без приема каких-либо АП и любых нестероидных противовоспалительных препаратов (НПВП) в течение предыдущих 7 дней; группа 2 – здоровые добровольцы без ССЗ (SCORE < 1%) , получавшие АСК в дозе 100 мг 1 раз в сутки в течение 1–3 дней; группа 3 – пациенты, страдающие ССЗ (SCORE 5–10% и более 10%), без приема АП или НПВП в течение предыдущих 7 дней; группа 4 – пациенты, страдающие ССЗ (SCORE 5–10% и более 10%), получающие стабильную терапию АП (АСК – 75–100 мг 1 раз в сут 7 дней или более, клопидогрел – 75 мг 1 раз в сут 7 дней или более). В группу 3 были включены пациенты с артериальной гипертензией и атеросклерозом, которые не получают терапию антиагреганта-ми, но имеют высокий и очень высокий 10-летний сердечно-сосудистый риск. В группу 4 вошли пациенты с ИБС и перенесенным острым коронарным синдромом (ОКС).
Таблица 1. Клинико-анамнестические характеристики субъектов, включенных в исследование
Table 1. Clinical and anamnestic characteristics of subjects included in the study
|
Характеристика Characteristic |
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
Группа 4 Group 4 |
|
Количество субъектов, n Number of subjects, n |
36 |
15 |
41 |
60 |
|
Возраст, лет, Me ( Q 25; Q 75) Age, years, Me ( Q 25; Q 75) |
22,3 (20; 35) |
28 (21; 45) |
65 (56; 82) |
67 (51; 81) |
|
Женщины, n (%) Women, n (%) |
21 (58) |
9 (60) |
31 (76) |
48 (80) |
|
Мужчины, n (%) Men, n (%) |
15 (42) |
6 (40) |
10 (24) |
12 (20) |
|
Прием АСК, n (%) ASA* intake, n (%) |
0 (0) |
15 (100) |
0 (0) |
60 (100) |
|
Прием клопидогреля, n (%) Clopidogrel intake n (%) |
0 (0) |
0 (0) |
0 (0) |
15 (25) |
|
SCORE**, Me ( Q 25; Q 75) |
0,8 (0,6; 0,98) |
0,8 (0,7; 0,9) |
10,8 (5,2; 25,1) |
9,7 (5,8; 17,2) |
|
Шкала глобальной оценки 10-летнего сердечно-сосудистого риска Global 10-Year Cardiovascular Risk Scale |
– |
– |
Высокий и очень высокий High and very high |
Высокий и очень высокий High and very high |
Примечание: Ме – медиана, Q 25 – 25-й процентиль, Q 75 – 75-й процентиль.
Note: Me – median, Q 25 – 25 th percentile, Q 75 – 75th percentile. *ASA – acetylsalicylic acid, ** SCORE – Systematic Coronary Risk Evaluation
Оценку риска, согласно шкале SCORE, проводили в зависимости от пола, возраста, статуса курения, систолического артериального давления и концентрации общего холестерина [12].
Биообразцы. Для исследования тромбоцитов с помощью ГКРС образцы свежей венозной крови были взяты у здоровых добровольцев и пациентов с ССЗ в вакуумную пробирку, содержащую ЭДТА (BD Vacutainer®).
Далее образцы центрифугировали при 60g в течение 15 мин для отделения богатой тромбоцитами плазмы, затем ее второй раз центрифугировали при 60g в течение 15 мин для осаждения лейкоцитов и эритроцитов. На последнем этапе тромбоциты были осаждены путем центрифугирования супернатанта при 1500g в течение 15 мин. Все этапы центрифугирования были проведены при 4 °C.
Образцы свежей венозной крови для проведения агрегометрии были взяты в вакуумную пробирку, содержащую цитрат натрия (Vacutainer 4,5 мл с цитратом натрия 3,2%®). Далее пробирки с забранным материалом экспозировались при комнатной температуре в течение 1,5–3 ч. Затем 800 мкл крови загружались в картридж анализатора.
Агрегометрия. Методом сравнения была выбрана агрегометрия с использованием системы PFA-200 (Siemens, Германия), ключевой особенностью которой является имитация условий in vivo . Преимуществами данной системы являются использование цельной крови, картриджная система, быстрота получения результата, легкая интерпретация [13]. Технология, используемая в приборе PFA-200, — моделирование процесса адгезии и агрегации тромбоцитов, возникающих в поврежденном сосуде [13, 14].
Анализ был поведен с тремя видами картриджей: 1. Картридж, содержащий в качестве активатора коллаген с эпинефрином (Collagen/EPI). 2. Картридж, содержащий коллаген с АДФ (Collagen/ADP). 3. Картридж, содержащий простагландин Е1 (P2Y).

Рис. 1. Используемые для получения ГКРС*-спектров тромбоцитов наноструктурированные титановые поверхности, модифицированные золотыми наночастицами. Изображение получено методом сканирующей электронной микроскопии. Собственные неопубликованные данные авторов
* ГКРС - гигантское комбинационное рассеяние света
Fig. 1. Nanostructured titanium surfaces modified with gold nanoparticles used to obtain SERS** spectra of platelets. The image was obtained by scanning electron microscopy. Authors’ own unpublished data
** SERS - surface-enhanced Raman spectroscopy
Изучение тромбоцитов с помощью метода ГКРС. Для получения спектров ГКРС использовался спектрометр Centaur U HR со спектральным разрешением 2,5 см–1. Образцы тромбоцитов помещались на модифицированные фемтосекундным лазером титановые поверхности. Такие поверхности обеспечивали эффект плазмонного усиления вблизи поверхности структуры и состояли из наноструктурированного титана с нанесенным аблационным золотом (рис. 1).
На титановые поверхности наносили каплю образца объемом 5 мкл, высушивали в течение 5 мин при комнатной температуре, далее образец помещался на держатель микроскопа. Оптическое изображение тромбоцитов на титановой поверхности изображено на рисунке 2А. Для съемки был использован DPSS-лазер с длиной волны λ = 532 нм. Лазерный луч фокусировался на образце вручную с помощью USB-видеокамеры и механической системы позиционирования. Размер лазерного пятна варьировался от 1 × 10 до 1 × 25 мкм в зависимости от используемой мощности лазера. Спектры комбинационного рассеяния регистрировали в диапазоне волновых чисел «отпечатка пальца» от 400 см–1 до 1800 см–1. Для обработки полученных спектров использовалась информационная система BioRad-Know It All (Willey, UK). Для расшифровки спектров и оценки изменений в них использовалась ручная расшифровка по колебательным группам, а также литературные данные. Пример спектра изображен на рисунке 2Б.
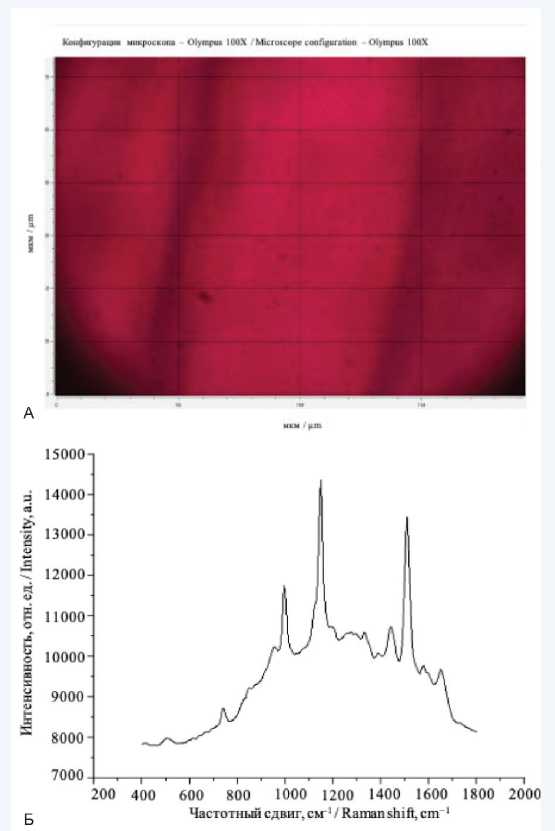
Рис. 2. Оптическое изображение тромбоцитов на титановой поверхности (A) и (Б) характерный ГКРС*-спектр тромбоцита периферической крови пациента из группы 4. Собственные неопубликованные данные авторов
* ГКРС - гигантское комбинационное рассеяние света
Fig. 2. Optical image of platelets on a titanium surface (A) and (Б) characteristic SERS** spectrum of a patient’s peripheral blood platelet from group 4. Authors’ own unpublished data
** SERS - surface-enhanced Raman spectroscopy
Статистическая обработка данных была выполнена с использованием программного пакета STATISTICA 13.3. Основным объектом для поиска потенциальных предиктивных биомаркеров являлись совокупности значений максимумов ГКРС-спектров тромбоцитов, соответствующих определенным частотным сдвигам (ЧС). Каждая выборка перед проведением статистического анализа была проверена на нормальность тестом Шапиро – Уилка (p > 0,05). Принимая во внимание, что все выборки соответствовали условиям нормального распределения, в качестве метода сравнения средних значений выборок был использован t-критерий Стьюдента для независимых переменных.
Для проведения корреляционного анализа был применен метод Пирсона, реализованный в функции «прямоугольная матрица корреляции» программного пакета STATISTICA 13.3. Для проверки статистических гипотез была использована поправка Бонферрони ( p < 0,05/m, где m – проверяемое число гипотез).
Результаты
Ранее с использованием процедур машинного обучения нами были определены ЧС ГКРС-спектров тромбоцитов периферической крови, имеющие наибольшую информативность при выявлении различий в спектрах здоровых пациентов и пациентов с ССЗ, а также для оценки фармакодинамических эффектов антитромбоци-тарных препаратов. В списке наиболее перспективных для последующего изучения ЧС было выбрано 21 значение, а именно – 420, 430, 485, 505, 605, 615, 720, 805, 955, 960, 970, 975, 980, 990, 1040, 1400, 1410, 1465, 1535, 1540, 1590 см-1 [15].
При сравнении средних значений интенсивностей ГКРС-спектров тромбоцитов, полученных для разных групп субъектов исследования, были выявлены значи- мые различия. Между спектрами тромбоцитов здоровых добровольцев и пациентов, страдающих ССЗ (группа 1 и группа 3), значимые различия были установлены для всех значений ЧС: 420, 430, 485, 505, 605, 615, 720, 805, 955, 960, 970, 975, 980, 990, 1040, 1400, 1410, 1465, 1535, 1540, 1590 см-1 (табл. 2). Абсолютная разница средних значений интенсивностей ГКРС-спектров колебалась от 2890 до 9521, при этом максимальные различия были получены для ЧС 505 и 990 см-1.
Сопоставление средних значений интенсивностей ГКРС-спектров тромбоцитов здоровых добровольцев, получавших (группа 2) и не получавших АСК (группа 1), выявило статистически значимые отличия для следующих трех ЧС: 505, 990, 1465 см-1. При этом для ЧС 505, 1465 см-1 отмечались максимальные различия средних значений интенсивностей ГКРС-спектров – 2142 и 2054 (см. табл. 2).
Установлено, что существуют статистически значимые различия средних значений интенсивностей ГКРС-спек-тров для четырех ЧС 485, 505, 990, 1465 см-1 (см. табл. 2). Для перечисленных ЧС также выявлены наибольшие различия в средних по абсолютным значениям – 1904, 2195, 3328, 2690. Интересно, что разница средних значений интенсивностей ГКРС-спектров тромбоцитов для групп 3 и 4 варьировала для разных ЧС не только по абсолютным значениям, но и по знаку. Так, для ЧС 505 и 990 см-1 разница средних составила –2195 и –3328, а для ЧС 485 и 1465 см-1 – 1904 и 2690 соответственно.
Таблица 2. Сравнение интенсивностей ГКРC*-спектров тромбоцитов периферической крови, полученных на разных значениях частотных сдвигов в разных группах
Table 2. Comparison of the intensities of SERS** spectra of peripheral blood platelets obtained at different values of frequency shifts in different groups
|
Частотный сдвиг, см -1 Frequency shift, cm -1 |
Группа 1 M ( S ), n = 385 Group 1 M (S ), n = 385 |
Группа 2 M ( S ), n = 126 Group 2 M (S), n = 126 |
Группа 3 M ( S ), n = 407 Group 3 M (S), n = 407 |
Группа 4 M ( S ), n = 348 Group 4 M (S) , n = 348 |
|
420 |
10173 (408) |
8911 (416) |
14986 (582) * |
14958 (664) |
|
430 |
10160 (409) |
8895 (419) |
14963 (582) * |
14940 (665) |
|
485 |
10255 (415) |
8954 (423) |
13499 (587) * |
15403 (674) |
|
505 |
10427 (419) |
8285 (426) " |
17553 (591) * |
15358 (678) |
|
605 |
10508 (430) |
9138 (440) |
15386 (599) * |
15539 (689) |
|
615 |
10573 (432) |
9175 (440) |
15454 (601) * |
15622 (691) |
|
720 |
10970 (442) |
9486 (452) |
15844 (610) * |
16155 (703) |
|
805 |
11220 (457) |
9670 (471) |
16255(626 ) * |
16588 (722) |
|
955 |
12973 (498) |
11328 (526) |
18344 (682) * |
18783 (775) |
|
960 |
12941 (499) |
11307 (528) |
18309 (682) * |
18759 (776) |
|
970 |
12820 (497) |
11174 (528) |
18196 (681) * |
18671 (777) |
|
975 |
12818 (497) |
11152 (527) |
18226 (681) * |
18713 (778) |
|
980 |
12907 (498) |
11198 (528) |
18379 (685) * |
18871 (782) |
|
990 |
13660 (509) |
11891 (548) " |
23181 (705) * |
19853 (798) |
|
1040 |
12962 (500) |
11248 (532) |
18191 (682) * |
18710 (777) |
|
1400 |
13460 (549) |
11653 (583) |
18924 (721) * |
19561 (815) |
|
1410 |
13479 (548) |
11664 (589) |
18940 (720) * |
19564 (814) |
|
1465 |
14261 (555) |
12207 (590) |
17151 (727) * |
19841 (815) |
|
1535 |
14229 (586) |
12650 (686) |
19376 (743) * |
19880 (831) |
|
1540 |
13837 (572) |
12054 (648) |
19012 (735) * |
19598 (828) |
|
1590 |
13205 (562) |
11341 (594) |
18592 (724) * |
19299 (822) |
Примечание: n – количество спектров, M – среднее арифметическое, S – стандартная ошибка среднего арифметического. Значение вероятности нулевой гипотезы равенства средних арифметических с использованием непарного t - критерия Стьюдента p < 0,017 при сравнении: * – группы 1 и группы 2, – группы 3 и группы 4, # – группы 1 и группы 3. * ГКРС – гигантское комбинационное рассеяние света
Note: n is the number of spectra, M is the arithmetic mean, S is the standard error of the arithmetic mean. The probability value of the null hypothesis of equality of arithmetic means using unpaired Student’s t- tes t p < 0.017 when comparing: * – groups 1 and groups 2, – groups 3 and groups 4, # – groups 1 and groups 3. ** SERS - surface-enhanced Raman spectroscopy
Корреляционный анализ для выявления потенциальных биологических механизмов, лежащих в основе выявленных спектральных различий, выполнили для всех значений интенсивностей ГКРС-спектров (всех групп пациентов) и показателей агрегометрии. Количество полу- ченных значений коэффициентов корреляции составило более 10 000, поэтому для упрощения анализа мы приводим только диапазоны коэффициентов корреляций, сгруппированных для разных категорий пациентов и разных методов изучения агрегации тромбоцитов (табл. 3).
Таблица 3. Диапазоны коэффициентов корреляции между интенсивностями ГКРC*-спектров тромбоцитов периферической крови и параметрами агрегации тромбоцитов, полученных с использованием разных картриджей системы PFA***-200
Table 3. Ranges of correlation coefficients between the intensities of SERS** spectra of peripheral blood platelets and the parameters of platelet aggregation obtained using different cartridges of the PFA***–200 system
|
Группы пациентов Patient groups |
Диапазон коэффициентов корреляции, min-max ( Me ) Correlation coefficient range, min-max (Me ) |
||
|
Coll/ADP**** |
Coll/Epi***** |
P2Y****** |
|
|
Все группы All groups |
0,05 ... 0,07 (0,06) |
0,07 ... 0,1 (0,09) |
0,31 ... 0,33 (0,32)* |
|
Группа 1 Group 1 |
–0,3 ... –0,16 (–0,23) |
–0,32 ... –0,17 (–0,24) |
–0,12 ... –0,06 (–0,09) |
|
Группа 2 Group 2 |
–0,93 ... –0,75 (–0,84)* |
–0,51 ... –0,18 (–0,34) |
–0,51 ... –0,18 (–0,34) |
|
Группа 3 Group 3 |
–0,13 ... –0,06 (–0,09) |
–0,16 ... –0,09 (–0,12) |
0,16 ... 0,19 (0,18) |
|
Группа 4 Group 4 |
–0,06 ... 0,09 (0,02) |
0,13 ... 0,15 (0,140) |
0,47 ... 0,52 (0,5)* |
Примечание: min – минимальное значение коэффициента корреляции, max – максимальное значение коэффициента корреляции, Ме – медиана, * – наличие достоверных значений коэффициентов корреляции, p < 0,008. * ГКРС – гигантское комбинационное рассеяние света
Note: Min – the minimum value of the correlation coefficient, Max – the maximum value of the correlation coefficient, Me – median, * – the presence of significant values of the correlation coefficients, p < 0.008.
** SERS - surface-enhanced Raman spectroscopy *** PFA - platelet function analyzer **** Coll/ADP - Collagen/ADP ***** Coll/Epi - Collagen / Epinephrine ******P2Y – картридж, содержащий простагландин Е1
При проведении корреляционного анализа ГКРС-спек-тров тромбоцитов разных групп и результатов агрегоме-трии для некоторых групп были выявлены статистически значимые корреляции (см. табл. 3). При рассмотрении данных корреляционного анализа видно, что ГКРС-спек-тры тромбоцитов здоровых добровольцев, получающих АСК (группа 2), имеют статистически значимую высокую отрицательную корреляцию ( r = –0,93…–0,75; p < 0,008) с результатами агрегометрии при воздействии активатора Coll/ADP, представленными в секундах (см. табл. 3).
В свою очередь суммарно ГКРС-спектры всех участников исследования (группы 1, 2, 3, 4) имеют слабую положительную связь ( r = 0,305–0,328) с результатами агрегометрии в секундах с использованием картриджа с активатором P2Y. ГКРС-спектры тромбоцитов пациентов с ССЗ, получающих терапию АСК, также коррелируют с результатами агрегометрии в секундах с использованием картриджа с активатором P2Y и показывают среднюю положительную связь ( r = 0,472–0,521).
Обсуждение
Биохимические механизмы различных фаз активации тромбоцитов – адгезии, изменения формы, реакции высвобождения и агрегации – хорошо описаны, однако полное отражение этих сложных процессов в лабораторные методы не выполнено [16]. В связи с большой распространенностью применения АП в клинической практике существует потребность оценки эффективности терапии этим классом препаратов у значительной когорты пациентов.
Метод ГКРС-спектроскопии обладает преимуществами, делающими его перспективным диагностическим подходом для использования в клинической практике [17]. ГКРС позволяет быстро и точно получать информацию о биологической структуре объекта в режиме реального времени с использованием минимальной пробо-подготовки [17]. Одними из основных преимуществ ГКРС являются высокая специфичность и возможность относительно простого масштабирования данного метода с лабораторного прототипа в портативные устройства для диагностики на месте оказания медицинской помощи – Point-of-care testing (POCT) [18].
На сегодняшний день количество работ, описывающих использование спектроскопии ГКРС для изучения форменных элементов крови, ограничено, и единые подходы к применению данного метода пока не разработаны [19].
Обнаруженные спектральные различия тромбоцитов здоровых добровольцев и пациентов с ССЗ ожидаемы, поскольку ранее исследователи уже сообщали о структурных и функциональных изменениях тромбоцитов, обнаруженных у пациентов с ССЗ [20].
Одним из самых сложных аспектов использования спектроскопии ГКРС является выделение наиболее информативных участков среди большого количества данных, получаемых при снятии ГКРС-спектров. С использованием процедур машинного обучения нами были определены ЧС ГКРС-спектров тромбоцитов периферической крови, имеющие наибольшую информативность при выявлении различий в спектрах здоровых добровольцев и пациентов с ССЗ, а также для оценки фармакодинамических эффектов АП. Результаты, представленные в настоящей статье, показывают, что анализ интенсивностей ГКРС-спектров тромбоцитов на всех перечисленных выше ЧС достовер- но отличается в группах здоровых лиц и пациентов с ССЗ. Таким образом, все вышеперечисленные ЧС являются потенциальными кандидатами для использования в методиках диагностики ССЗ и для создания соответствующих диагностических приборов (см. табл. 2).
Наиболее вероятным объяснением найденных различий, на наш взгляд, является отличие химического состава мембран тромбоцитов у здоровых лиц и пациентов с
ССЗ, которые определяют наличие структурных и функциональных изменений тромбоцитов, имеющих место у пациентов с ССЗ [20]. Это подтверждается проведенным нами ранее сопоставлением ГКРС-спектров тромбоцитов здоровых лиц и пациентов с ССЗ по наличию четких отличий в содержании амидных групп, триптофана, серина, по изменениям в структуре белков для групп Амид I, S-S связей низкочастотной области (рис. 3) [15].
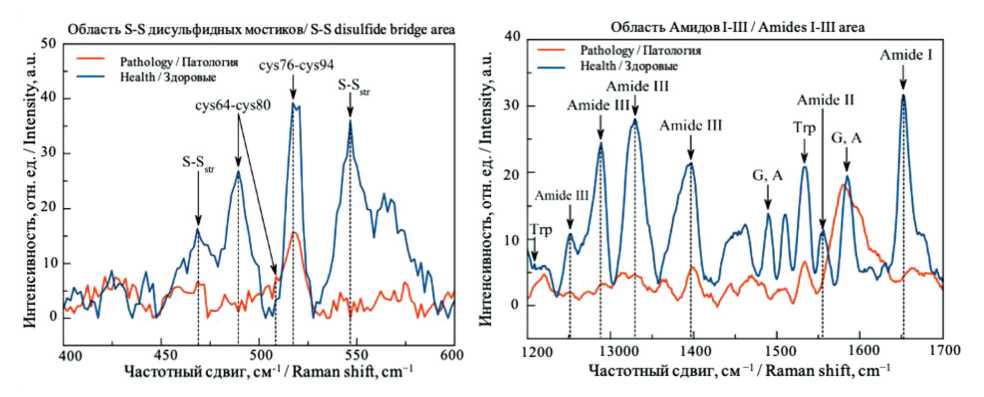
Рис. 3. Спектральные различия химического состава тромбоцитов здоровых в низкочастотном диапазоне длин волн для пациентов с сердечно-сосудистыми заболеваниями и здоровых добровольцев: сопоставление ГКРС*-спектров тромбоцитов. Ранее опубликованные данные [15]
* ГКРС – гигантское комбинационное рассеяние света
Fig. 3. Spectral differences in the chemical composition of healthy platelets in the low-frequency wavelength range for patients with CVD*** and healthy volunteers: comparison of SERS** spectra of platelets. Previously published data [15]
** SERS - surface-enhanced Raman spectroscopy *** CVD – cardiovascular diseases
В то же время основной задачей нашего исследования было обнаружить с помощью спектроскопии ГКРС тромбоцитов потенциальные биомаркеры у пациентов, получающих терапию АП, которые бы позволили изучать фармакодинамические эффекты этих препаратов. В этой связи наибольший интерес представляли различия ГКРС-спектров между здоровыми лицами, получавшими и не получавшими АСК (группа 1 и группа 2), а также пациентами с ССЗ, получавшими и не получавшими терапию АП (группа 3 и группа 4). Нами были выявлены статистически значимые различия по некоторым интенсивностям ГКРС-спектров тромбоцитов у добровольцев и пациентов с ССЗ, получающих терапию АСК и без терапии АСК только для четырех ЧС, а именно – 485, 505, 990, 1465 см-1 (см. табл. 2).
Для того чтобы определить, с каким классом АП в большей степени коррелируют выявленные нами спектральные различия тромбоцитов, был проведен корреляционный анализ между интенсивностями ГКРС-спек-тров тромбоцитов периферической крови и параметрами агрегации тромбоцитов, полученных с использованием разных картриджей системы PFA-200. Были выявлены достоверные корреляции: между ГКРС-спектрами здоровых добровольцев, получающих АСК (группа 2), и результатами агрегометрии при воздействии активатора Coll/ ADP; между ГКРС-спектрами всех участников (группы 1, 2, 3, 4) и результатами агрегометрии при воздействии активатора P2Y; между ГКРС-спектрами тромбоцитов паци- ентов с ССЗ, получающих терапию АСК, и результатами агрегометрии при воздействии активатора P2Y. Наличие данных корреляций свидетельствует о связи изменения структуры мембраны с функциональной активностью тромбоцита.
Несколько неожиданным оказался факт отсутствия достоверных корреляционных связей между ГКРС-спек-трами пациентов с ССЗ, получающими АСК (группа 4), и результатами агрегометрии при воздействии активатора Coll/ADP. Возможно несколько вероятных объяснений данному факту. Во-первых, можно предположить, что у части пациентов имела место низкая комплаентность к терапии АСК (для сравнения: пациенты из группы 2 принимали АСК в центре под контролем исследователей). Во-вторых, у части пациентов группы 4 могла развиться резистентность к действию АСК. В-третьих, возможно, статистическая мощность исследования оказалась недостаточной в силу относительно небольшого числа пациентов в группе или большой гетерогенности пациентов. Для прояснения описанного несоответствия нами планируется проведение исследований с контролем приема АСК, более жесткими критериями включения пациентов и исключения пациентов с риском резистентности к АСК.
Выводы
-
1. Метод ГКРС-спектроскопии с использованием оптического сенсора, выполненного на основе наноструктури-рованных золотыми частицами титановых поверхностей,
может быть использован для диагностики состояния тромбоцитов. Получен патент РФ № RU 2022108969/28 (018713).
-
2. Для диагностики функционального состояния тромбоцитов у пациентов с ССЗ перспективными являются значения интенсивностей ГКРС-спектров на частотах – 420, 430, 485, 505, 605, 615, 720, 805, 955, 960, 970, 975, 980, 990, 1040, 1400, 1410, 1465, 1535, 1540, 1590 см-1.
-
3. Для изучения фармакодинамических эффектов АП
наиболее подходящими являются значения интенсивностей ГКРС-спектров на ЧС – 485, 505, 990, 1465 см–1.
-
4. Выявленные спектральные изменения тромбоцитов периферической крови у пациентов с ССЗ коррелируют с изменениями агрегометрии, полученными при использовании картриджа с активатором P2Y, что обосновывает использование метода ГКРС-спектроскопии прежде всего для оценки фармакодинамических эффектов ингибиторов P2Y12 рецепторов.
Список литературы Использование спектроскопии гигантского комбинационного рассеяния для поиска фармакодинамических предикторов ответа на антиагрегантную терапию
- Ес тественное движение населения Российской Федерации. Федеральная служба государственной статистики. [The natural movement of the population of the Russian Federation. Federal State Statistics Service]. URL: https://rosstat.gov.ru/compendium/document/13269 (18.01.2023).
- Стабильная ишемическая болезнь сердца: Клинические рекомендации. Российское кардиологическое общество. Российский кардиологический журнал. 2020;25(11):4076. [Stable Coronary Heart Disease: Clinical Guidelines. Russian Society of Cardiology. Russian Journal of Cardiology. 2020;25(11):4076. (In Russ.)]. DOI: 10.15829/29/1560-4071-2020-4076.
- Гончаров М.Д., Гринштейн Ю.И., Савченко А.А. Особенности продукции активных форм кислорода тромбоцитами и нейтрофилами в формировании недостаточного ответа на ацетилсалициловую кислоту у пациентов с ишемической болезнью сердца после операции коронарного шунтирования. Трансляционная медицина. 2022;9(1):12–28. [Goncharov M.D., Grinshtein Yu.I., Savchenko A.A. Features of the reactive oxygen species production by platelets and neutrophils in the formation of an insuffi cient response to acetylsalicylic acid in patients with coronary heart disease after coronary bypass surgery. Translational Medicine. 2022;9(1):12–28. (In Russ.)]. DOI: 10.18705/2311-449-2022-9-1-12-28.
- Karunawan N.H., Pinzon R.T. Prevalence of aspirin and clopidogrel resistance in patients with recurrent ischaemic cerebrovascular disease. Eur. Cardiol. Feb. 2021;16:e72. DOI: 10.15420/ecr.2021.16.PO16.
- Ebrahimi P., Farhadi Z., Behzadifar M., Shabaninejad H., Abolghasem Gorji H., Taheri Mirghaed M. et al. Prevalence rate of laboratory defi ned aspirin resistance in cardiovascular disease patients: A systematic review and meta-analysis. Caspian J. Intern. Med. 2020;11(2):124–134. DOI: 10.22088/cjim.11.2.124.
- Guirgis M., Thompson P., Jansen S. Review of aspirin and clopidogrel resistance in peripheral arterial disease. J. Vasc. Surg. 2017;66(5):1576–1586. DOI: 10.1016/j.jvs.2017.07.065.
- Эверстова Т.Е., Николаева Т.Я. Проблемы резистентности к ацетилсалициловой кислоте в профилактике ишемического инсульта (обзор литературы). Сибирское медицинское обозрение. 2020;(3):47–53. [Everstova T.E., Nikolaeva T.Y. Problems of resistance to acetylsalicylic acid in the prevention of ischemic stroke (literature review). Siberian Medical Review. 2020;(3):47–53. (In Russ.)]. DOI: 10.20333/2500136-2020-3-47-53.
- Pereira N.L., Rihal C.S., So D.Y.F., Rosenberg Y., Lennon R.J., Mathew V.et al. Clopidogrel pharmacogenetics. Ci rc. Cardiovasc. Interv. 2019;12(4):e007811. DOI: 10.1161/CIRCINTERVENTIONS.119.007811.
- Vardon-Bounes F., Garcia C., Piton A., Series J., Gratacap M.P., Poëtte M. et al. Evolution of platelet activation parameters during septic shock in intensive care unit. Platelets. 2022;33(6):918–925. DOI: 10.1080/09537104.2021.2007873.
- 10 . Khan H., Kanny O., Syed M.H., Qadura M. Aspirin resistance in vascular disease: A review highlighting the critical need for improved point-of-care testing and personalized therapy. Int. J. Mol. Sci. 2022;23(19):11317. DOI: 10.3390/ijms231911317.
- 11 . Wan H., Han W., Wu Z., Lie Z., Li D., Su S. Whole blood dynamic platelet aggregation counting and 1-year clinical outcomes in patients with coronary heart diseases treated with clopidogrel. Pl atelets. 2021;32(7):968–974. DOI: 10.1080/09537104.2020.1817886.
- Pocock S.J., McCormack V., Gueyffi er F., Boutitie F., Fagard R.H., Boissel J.P. A score for predicting risk of death from cardiovascular disease in adults with raised blood pressure, based on individual patient data from randomised controlled trials. BMJ. 2001;323(7304):75–81. DOI: 10.1136/bmj.323.7304.75.
- 13 . Piao J., Yoo C., Kim S., Whang Y.W., Choi C.U., Shin S. Performance comparison of the PFA-200 and Anysis-200: Assessment of bleeding risk screening in cardiology patients. Clin. Hemorheol. Microcirc. 2021;79(3):445–454. DOI: 10.3233/CH-211185.
- 14 . Lordkipanidzé M., Hvas A.-M., Harrison P. Clinical Tests of Platelet Function. In: Platelets; 2019:593–608. [Internet]. URL: https://www.researchgate.net/topic/Platelets/publications (17.03.2023).
- 15 . Zyubin A., Rafalskiy V., Tcibulnikova A., Moiseeva Е., Matveeva К., Tsapkova А. et al. Surface-enhanced Raman spectroscopy for antiplatelet therapy eff ectiveness assessment. Laser Physics Letters. 2020;17(4). DOI: 10.1088/1612-202X/ab7be5.
- 16 . Paniccia R., Priora R., Liotta A.A., Abbate R. Platelet function tests: a comparative review. Vasc. Health Risk Manag. 2015;11:133–148. DOI: 10.2147/VHRM.S44469.
- 17 . Рафальский В.В., Зюбин А.Ю., Моисеева Е.М., Самусев И.Г. Перспективы применения метода спектроскопии комбинационного рассеяния света (рамановской спектроскопии) в кардиологии. Кардиоваскулярная терапия и профилактика. 2020;19(1):70–77. [Rafalsky V.V., Zyubin A.Yu., Moiseeva E.M., Samusev I.G. Prospects for Raman spectroscopy in cardiology. Cardiovascular Therapy and Prevention. 2020;19(1):70–77. (In Russ.)]. DOI: 10.15829/1728-8800-2020-1-2394.
- 18 . Quarin S., Strobbia P. Recent advances towards point-of-care applications of surface-enhanced raman scattering sensing. Front. Chem. 2021;9:714113. DOI: 10.3389/fchem.2021.714113.
- 19 . Atkins C.G., Buckley K., Blades M.W., Turner R.F. Raman spectroscopy of blood and blood components. Applied Spe ctroscopy. 2017;71(5):767–793. DOI: 10.1177/0003702816686593.
- 20 . Sang Y., Roest M., de Laat B., de Groot P.G., Huskens D. Interplay between platelets and coagulation. Blood Rev. 2021;46:100733. DOI: 10.1016/j.blre.2020.100733.


