Использование теста тромбодинамики в диагностике нарушений гемостаза у больных COVID-19 разной степени тяжести
Автор: Кречетова Любовь Валентиновна, Нечипуренко Дмитрий Юрьевич, Шпилюк Маргарита Александровна, Безнощенко Ольга Сергеевна, Береснева Евгения Александровна, Маркелов Михаил Игоревич, Иванец Татьяна Юрьевна, Гаврилова Татьяна Юрьевна, Козаченко Ирэна Феликсовна, Есаян Роза Михайловна, Пырегов Алексей Викторович, Хачатрян Нелли Артуровна, Кодацкий Дмитрий Сергеевич, Спиридонов Илья Сергеевич, Долгушина Наталия Витальевна, Городнова Елена Александровна, Атауллаханов Фазоил Иноятович, Румянцев Александр Григорьевич, Дегтярев Дмитрий Николаевич
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.12, 2021 года.
Бесплатный доступ
Обоснование. На данный момент актуальной и нерешенной задачей остается поиск диагностического метода нарушений системы гемостаза у пациентов на фоне течения новой коронавирусной инфекции. Предположительно, интегральные тесты, в частности тест тромбодинамики, дадут возможность мониторинга изменений свертывания крови, прогнозирования течения заболевания у пациентов с COVID-19. Цель исследования - сравнительная оценка параметров плазменного гемостаза и теста тромбодинамики у пациентов с вирусной инфекцией COVID-19 разной степени тяжести. Методы. В исследование включены 96 пациентов с подтвержденным диагнозом COVID-19, госпитализированных в инфекционный госпиталь на базе ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России в период с 23.04.2020 по 20.06.2020 и выписанных по окончании лечения. Идентификацию SARS-CoV-2 проводили методом полимеразной цепной реакции. Пациенты были стратифицированы по степени тяжести на 3 группы: легкое течение (n=25), среднетяжелое течение (n=54), тяжелое течение (n=17). Диагностика и лечение пациентов проводилось в соответствии с Временными методическими рекомендациями Минздрава России по профилактике, диагностике и лечению новой коронавирусной инфекции (версии 5, 6, 7). В динамике лечения у пациентов оценивали активированное частичное тромбопластиновое время (АЧТВ), протромбин по Квику, протромбиновое и тромбиновое время, концентрацию фибриногена, D-димера, количество тромбоцитов и параметры теста тромбодинамики (V/Vi/Vst, Tlag, Cs, D). Результаты. Выявлено, что перед поступлением и через неделю от начала лечения в стационаре значимые различия наблюдались для показателей тромбинового времени, D-димера, количества тромбоцитов, а также параметров тромбодинамики (V/Vst, Cs, D). Обнаружена взаимосвязь параметров гемостаза (концентрация фибриногена, протромбиновое время, протромбин по Квику, активированное частичное тромбопластиновое время (АЧТВ, Tlag, D) с длительностью пребывания в стационаре. Отмечена положительная связь между содержанием фибриногена и плотностью сгустка (r=0,6307, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Covid-19, плазменный гемостаз, d-димер, тромбодинамика
Короткий адрес: https://sciup.org/143178086
IDR: 143178086 | DOI: 10.17816/clinpract88138
Текст научной статьи Использование теста тромбодинамики в диагностике нарушений гемостаза у больных COVID-19 разной степени тяжести
Submitted 20.10.2021 Revised 09.12.2021 Published 17.12.2021
Лицензия CC BY-NC-ND 4 / The article can be used under the CC BY-NC-ND 4 license
ОБОСНОВАНИЕ
Левопредсердная тахикардия по типу макро-риентри (macro re-entry) часто обнаруживается у пациентов после операций на сердце. Такие аритмии обычно ассоциированы с послеоперационными рубцами или массивными фиброзными полями после катетерной абляции, что является субстратом для формирования кругов re-entry1 [1]. Однако есть группа пациентов с левопредсердной тахикардией по типу re-entry, у которых отсутствуют предшествующие хирургические или интервенционные вмешательства на сердце. Пациенты с такими аритмиями крайне редко встречаются в повседневной практике врачей-кардиологов и сердечно-сосудистых хирургов. Распространенные зоны фиброза в миокарде левого предсердия являются предположительной причиной возникновения таких тахикардий.
Последние достижения в области систем трехмерного картирования позволяют создавать активационные и вольтажные карты высокой плотности, что дает возможность наиболее точно оценить механизм аритмии, а также определить цели абляции.
Представлен клинический случай интервенционного лечения пациента с атипичным трепетанием предсердий, которому ранее не выполнялось хирургического или интервенционного вмешательства на сердце. В представленном клиническом случае мы применяли методику картирования высокой плотности, что позволило детально изучить механизм тахикардии, а также оценить степень распространенности низкоамплитудной активности в левом предсердии (ЛП).
КЛИНИЧЕСКИЙ ПРИМЕР
О пациенте
Пациент М., 50 лет, поступил с жалобами на слабость, ощущение перебоев в работе сердца.
Из анамнеза известно, что при плановом медицинском осмотре после перенесенной вирусной инфекции на электрокардиограмме (ЭКГ) зафиксирован пароксизм фибрилляции предсердий неизвестной давности. Неоднократно госпитализировался в стационары с целью восстановления синусового ритма, однако попытки медикаментозной и электрической кардиоверсии были безуспешными. Пациенту была назначена пульсуре-жающая и антикоагулянтная терапия. Через год по результатам суточного мониторирования ЭКГ наблюдались спонтанное восстановление синусо- вого ритма, эпизоды частой наджелудочковой экстрасистолии. Спустя 2 года на ЭКГ зафиксировано трепетание предсердий. Пациент госпитализирован в клинику для катетерного лечения аритмии.
Инструментальная и лабораторная диагностика
По данным эхокардиографии: увеличены размеры обоих предсердий: ЛП — 47 x 57 мм, 97 мл, правое предсердие — 41 x 56 мм, 68 мл; митральная регургитация 1-й степени, трикуспидальная регургитация 1-й степени; толщина миокарда левого желудочка в норме; локальных нарушений сократимости нет; фракция выброса 67%; сбросов крови нет.
По данным мультиспиральной компьютерной томографии легочных вен и ЛП : объем ушка ЛП — 6,9 см3 (мл), тромботические массы не визуализируются; объем ЛП с учетом ушка и устьев легочных вен — 117 см3 (мл); индекс ЛП (объем ЛП/S, где S — площадь поверхности тела) 53 мл/м2.
Диагноз
Предварительный диагноз. Нарушения ритма сердца: частая одиночная наджелудочковая экстрасистолия, по типу би-, три-, квадригеминии; персистирующая форма фибрилляции предсердий, атипичного трепетания предсердий. Оценка риска по шкале тромбоэмболических осложнений у больных с фибрилляцией/трепетанием предсердий (CHA2DS2-VASc) 0 баллов. Оценка риска по шкале развития кровотечений у пациентов с фибрилляцией предсердий (HAS-BLED) 0 баллов.
Клинический диагноз. Нарушения ритма сердца: частая одиночная наджелудочковая экстрасистолия, атипичное трепетание предсердий. Состояние после радиочастотной абляции субстрата атипичного трепетания предсердий от 05.2021. CHA2DS2-VASc 0 баллов. HAS-BLED 0 баллов.
Динамика и исходы
Пациент доставлен в рентгеноперационную. Под комбинированной анестезией ему пунктирована правая бедренная вена и левая подключичная вена. Через интродьюсер, позиционированный в подключичной вене, проведен 10-полюсный диагностический электрод в коронарный синус сердца. По электрофизиологическим данным: на электроде, позиционированном в коронарном синусе, левопредсердное трепетание с длиной цикла тахикардии 290 мс с проведением 2:1 (рис. 1).

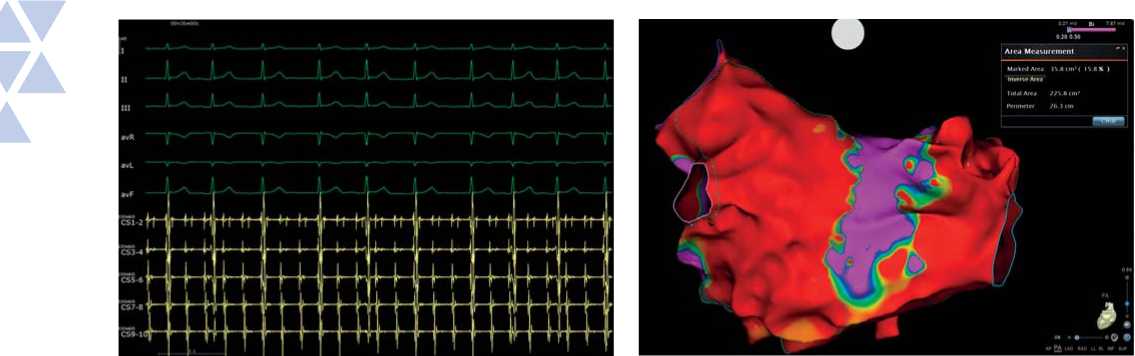
Рис. 2. Высокоплотная вольтажная карта левого предсердия, построенная с помощью системы навигационного картирования Carto 3. Красные области — участки с амплитудой эндокардиального сигнала менее 0,2 мВ, фиолетовые — с амплитудой эндокардиального сигнала более 0,5 мВ.
Fig. 2. A high-density voltage map of the left atrium, built using the Carto 3 navigation mapping system. Red areas correspond to the endocardial signal amplitude lower than 0.2 mV, purple areas — to the amplitude higher than 0.5 mV.
Рис. 1. Интраоперационная электрограмма, где I–III, aVL, aVR, aVF — отведения электрокардиограммы, CS (1–10) — запись электрограмм с электрода, размещенного в коронарном синусе. Регистрируется атипичное трепетание предсердий с длиной цикла 290 мс.
Fig. 1. An intraoperative electrogram, where I–III, aVL, aVR, aVF are electrocardiogram leads, CS (1–10) — is recording of electrograms from an electrode placed in the coronary sinus. Atypical atrial flutter with a cycle length of 290 ms is being registered.
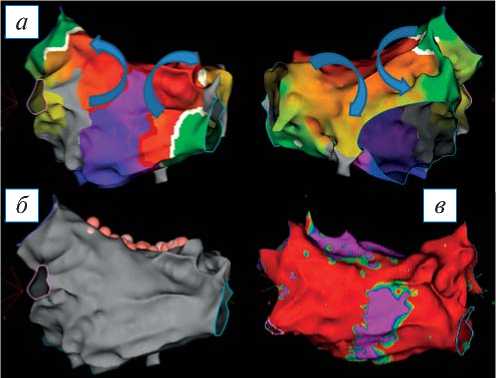
Рис. 3. Трехмерная электроанатомическая карта левого предсердия (ЛП), построенная во время атипичного трепетания предсердий с длиной цикла — 290 мс: а — активационная карта ЛП (синими стрелками обозначен ход распространения возбуждения); б — анатомическая реконструкция ЛП (розовые точки — места радиочастотных аппликаций); в — вольтажная карта ЛП. Визуализация состоятельности линейного повреждения после радиочастотных воздействий.
Fig. 3. A 3D electroanatomical map of the left atrium (LA), built during atypical atrial flutter with a cycle length — of 290 ms: а — activation map of the LA, blue arrows indicate the course of excitation propagation; б — anatomical reconstruction of the LA, pink dots are sites of radiofrequency application; в — LA voltage map. Visualization of the consistency of linear damage after radiofrequency ablation.
Выполнена транссептальная пункция; в левом предсердии позиционирован катетер для высокоплотного картирования PentaRey (Biosense Webster, США); выполнена анатомическая реконструкция ЛП с построением активационной и вольтажной карт. Электроанатомическая карта ЛП содержит 2457 аннотированных точек картирования, расстояние между точками 1–3 мм. При анализе высокоплотной вольтажной карты отмечаются распространенные зоны низкоамплитудной активности, занимающие всю антральную часть ЛП (рис. 2). Выполнен подсчет площади низкоамплитудных зон с использованием инструмента Area Measurement, определен процент от общей площади ЛП. Выявлены 42,1% областей низкоамплитудной активности в ЛП.
При анализе активационной карты визуализируется циркуляция возбуждения вокруг правых и левых легочных вен (рис. 3, а ). Выполнена серия линейных воздействий на крыше, соединяющая правую верхнюю и левую верхнюю легочные вены (рис. 3, б ). Абляция выполнялась при следующих параметрах: мощность 32 Вт, температура до 44°С, индекс абляции 460 при воздействии по передней стенке, 380 — по задней стенке. После завершения линии отмечается нарастание цикла тахикардии до 360 мс (рис. 4).
Выполнен re-map (повторная карта), построены активационная и вольтажная карта ЛП, отмечается
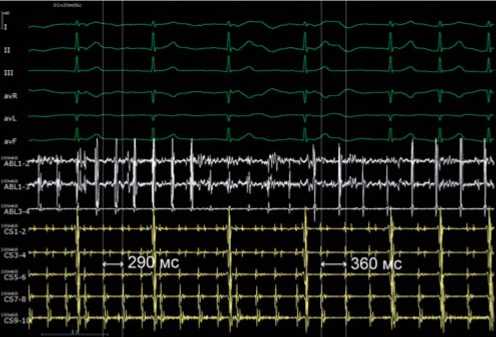
Рис. 4. Интраоперационная электрограмма, где I–III, aVL, aVR, aVF, V1–V6 — отведения электрокардиограммы, ABL (1–4) — запись электрограмм аблационного электрода, CS (1–10) — запись электрограмм с электрода, размещенного в коронарном синусе. Продемонстрировано нарастание длины цикла тахикардии с 290 до 360 мс во время радиочастотного воздействия. Fig. 4. An intraoperative electrogram, where I–III, aVL, aVR, aVF, V1–V6 are electrocardiogram leads, ABL (1–4) is recording of ablation electrode electrograms, CS (1–10) is recording of electrograms from the electrode placed in the coronary sinus. An increase in the tachycardia cycle length from 290 ms to 360 ms during radiofrequency ablation is seen.
состоятельность линии по крыше ЛП (рис. 3, в ). Элек-троанатомическая высокоплотная карта содержит 1978 EGM точек картирования, расстояние между точками 1–3 мм. При анализе активационной карты визуализируется циркуляция возбуждения вокруг митрального клапана (рис. 5, а ). Произведена серия линейных радиочастотных аппликаций от линии на крыше ЛП до митрального клапана и правой верхней легочной вены (рис. 5, б ). Абляция выполнялась при следующих параметрах: мощность 32 Вт; температура до 44°С; индекс абляции 460 при воздействии по передней стенке, 380 — по задней стенке. По завершении линии тахикардия купировалась (рис. 5, в ).
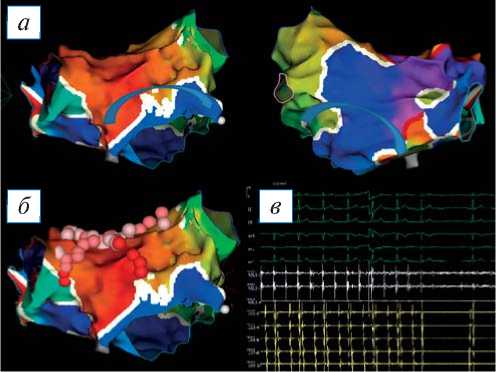
Рис. 5. Трехмерная электроанатомическая карта левого предсердия (ЛП), построенная во время атипичного трепетания предсердий с длиной цикла 360 мс: а — активационная карта ЛП (синими стрелками обозначен ход распространения возбуждения); б — активационная карта ЛП (розовые точки — места радиочастотных аппликаций); в — интраоперационная электрограмма, где I–III, aVL, aVR, aVF, V1–V6 — отведения электрокардиограммы, ABL (1–4) — запись электрограмм аблационного электрода, CS (1–10) — запись электрограмм с электрода, размещенного в коронарном синусе. Восстановление синусового ритма.
Fig. 5. A 3D electroanatomical map of the left atrium (LA), built during atypical atrial flutter with a cycle length of 360 ms: а — activation map of the LA, blue arrows indicate the course of excitation propagation; б — activation map of the LA, pink dots are sites of radiofrequency application; в — an intraoperative electrogram, where I–III, aVL, aVR, aVF, V1–V6 are electrocardiogram leads, ABL (1–4) is recording electrograms of the ablation electrode, CS (1–10) — recording electrograms from the electrode placed in the coronary sinus. See the sinus rhythm restoration.
При учащающейся и программированной стимуляции предсердий аритмия не индуцируется.
Прогноз — благоприятный.
Временная шкала: хронология развития болезни, ключевые события и прогноз для пациента М.
Timeline: Chronology of the disease development, key events and prognosis for patient M.
|
04.2018 |
09.2018 |
10.2018 |
08.2019 |
04.2021 |
05.2021 |
10.2021 |
|||||||||||||
|
• Перенесенная вирусная инфекция |
• На ЭКГ фибрилляция предсердий неизвестной давности |
• Неэффективные электрические и медикаментозные кардиоверсии |
• Спонтанное восстановление синусового ритма |
• На ХМ-ЭКГ фибрилляция предсердий, трепетание предсердий |
• Радиочастотная абляция субстрата атипичного трепетания предсердий |
• Сохранение синусового ритма |
|||||||||||||
Примечание. ЭКГ — электрокардиограмма; ХМ-ЭКГ — суточный мониторинг электрокардиограммы по Холтеру.
Note. ЭКГ — electrocardiogram; ХМ-ЭКГ — daily monitoring of the electrocardiogram.



ОБСУЖДЕНИЕ
Лечение левопредсердного трепетания — проблема, требующая глубокого понимания лежащего в основе сложного механизма аритмии. Несмотря на то, что уже имеется значительный опыт в пони- мании механизмов, лежащих в основе трепетания предсердий после абляции или хирургического вмешательства, мало что известно об атипичных формах трепетания предсердий у пациентов, ранее не подвергавшихся абляции или иным хирургическим вмешательствам на сердце. В нашей работе представлен клинический случай лечения атипичного трепетания предсердий у ранее не подвергавшегося абляции пациента. Мы использовали высокоплотное картирование для изучения механизма трепетания предсердий.
По данным мировой статистики, распространенность левопредсердного трепетания ежегодно увеличивается, что связано с увеличением числа кардиохирургических и интервенционных вмешательств за последние годы [2, 3]. Однако в 2013 г. начато изучение левопредсердного трепетания у пациентов, ранее не подвергавшихся вмешательствам на сердце. В одном из таких исследований [4], проведенном J. Coffey et al., у 10% пациентов среди всех находившихся на лечении с целью абляции атипичного трепетания предсердий не было предшествующих вмешательств на сердце. В исследовании J. Siebermair и соавт. [5], опубликованном в 2020 году, показано, что 1/3 (16 из 55; 29%)
пациентов с левопредсердным трепетанием не подвергалась абляции ЛП в прошлом.
Помимо ятрогенного создания «барьеров» во время абляции или хирургических процедур они часто обнаруживаются в предсердиях людей со структурными заболеваниями сердца, такими как ишемическая или ревматическая болезнь сердца, гипертрофическая или дилатационная кардиомиопатия, или даже при отсутствии заболеваний [6]. В исследовании A. Goette и соавт. [7] описан феноменом под названием «предсердная миопатия», который определен как «любой комплекс структурных, архитектурных, сократительных или электрофизиологических изменений, влияющих на предсердия и способных вызвать клинически значимые проявления». В нашем клиническом наблюдении эти предсердные изменения играют важную роль в создании субстрата для формирования круга re-entry.
Важную роль для оценки механизма атипичного трепетания играет высокоплотное картирование. Так, в ранее проведенных исследованиях показано, что восстановить синусовый ритм при использовании высокоплотного картирования удалось у 96,3% пациентов с левопредсердным трепетанием [5], без применения технологии — лишь в 86% случаев [4, 8]. Исследование S. Sundaram и соавт. [9] демонстриру- ет, что частота купирования левопредсердного трепетания составляет почти 100% при использовании высокоплотного картирования.
В данном клиническом случае было использовано высокоплотное картирование, что позволило определить механизм и выполнить успешную абляцию.
ЗАКЛЮЧЕНИЕ
Обширные зоны низкоамплитудной активности в левом предсердии могут создавать «барьеры» для распространения возбуждения, что может быть причиной атипичного трепетания предсердий. Визуализировать механизм такой аритмии возможно при активационном картировании с использованием катетеров для высокоплотного картирования. Понимание механизма атипичного трепетания предсердий позволит минимизировать количество радиочастотных воздействий для успешного катетерного лечения.
ИНФОРМИРОВАННОЕ СОГЛАСИЕ
От пациента получено письменное добровольное информированное согласие на публикацию описания клинического случая (дата подписания 15.04.2021).
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. Е.В. Дедух — обработка и обсуждение результатов исследования, ассистирование в процессе интервенционного лечения пациента, анализ вольтажных и активационных карт левого предсердия, написание текста статьи; Е.А. Артюхина — руководство лечением пациента и выполнение интервенционной процедуры. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Author contribution. E.V. Dedukh — processing and discussion of the results of the study, assistance for operations, analysis of voltage and activation maps of the left atrium, writing the text of the article; E.A. Ar-tyukhina — management of patient treatment and performing an interventional procedure. The authors made a substantial contribution to the conception of иническая
эактика
the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Источник финансирования. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-315-90045.
Funding source. The reported study was funded by RFBR according to the research project № 20-315-90045.
Список литературы Использование теста тромбодинамики в диагностике нарушений гемостаза у больных COVID-19 разной степени тяжести
- Tang N, Bai H, Chen X, et al. Anticoagulant treatment is associated with decreased mortality in severe Coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;18(5):1094-1099. doi: 10.1111/jth.14817
- Xie Y, Wang X, Yang P, et al. COVID-19 complicated by acute pulmonary embolism. Radiol Cardiothorac Imaging. 2020; 2(2):e200067. doi: 10.1148/ryct.2020200067
- Schmitt FC, Manolov V, Morgenstern J, et al. Acute fibrinolysis shutdown occurs early in septic shock and is associated with increased morbidity and mortality: results of an observational pilot study. Ann Intensive Care. 2019;9(1):19. doi: 10.1186/s13613-019-0499-6
- Simundic AM, Bolenius K, Cadamuro J, et al. On behalf of the Working Group for Preanalytical Phase (WG-PRE), of the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) and Latin American Working Group for Preanalytical Phase (WG-PRE-LATAM) of the Latin America Confederation of Clinical Biochemistry (COLABIOCLI) Joint EFLM-COLABIOCLI Recommendation for venous blood sampling v 1.1. Clinical Chemistry and Laboratory Medicine; June, 2018.
- Маркелов М.И., Безнощенко О.С., Иванец Т.Ю., и др. Особенности системы плазменного гемостаза у пациентов с новой коронавирусной инфекцией COVID-19 // Акушерство и гинекология. 2020. № 9. С. 138-144. [Markelov MI, Beznoshchenko OS, Ivanets TY, et al. Features of the plasma he-mostasis system in patients with the new coronavirus infection COVID-19. Obstetrics Gynecology. 2020;(9):138-144. (In Russ).] doi: 10.18565/aig.2020.9.138-144
- Helms J, Tacquard C, Severac F, et al. CRICS TRIGGERSEP Group (Clinical Research in Intensive Care and Sepsis Trial Group for Global Evaluation and Research in Sepsis). High risk of thrombosis in patients with severe SARS-CoV-2 infection: a multicenter prospective cohort study. Intensive Care Med. 2020;46(6): 1089-1098. doi: 10.1007/s00134-020-06062-x
- Pavoni V, Gianesello L, Pazzi M, et al. Evaluation of coagulation function by rotation thromboelastometry in critically ill patients with severe COVID-19 pneumonia. J Thromb Thrombolysis. 2020;50(2):281-286. doi: 10.1007/s11239-020-02130-7
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. doi: 10.1016/S0140-6736(20)30183-5
- Lippi G, Plebani M, Henry BM. Thrombocytopenia is associated with severe coronavirus disease 2019 (COVID-19) infections: a meta analysis. Clin Chim Acta. 2020;506:145-148. doi: 10.1016/j.cca.2020.03.022
- Tang N, Li D, Wang X, Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18(4):844-847. doi: 10.1111/jth.14768
- Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. J Thromb Haemost. 2020;18(5):1023-1026. doi: 10.1111/jth.14810
- Nicoll D, McPhee SJ, Pignone M, Lu CM. Pocket guide or diagnostic tests. NY: McGraw-Hill; 2008. 512 р.
- Whiting D, DiNardo JA. TEG and ROTEM: technology and clinical applications. Am J Hematol. 2014;89(2):228-232. doi: 10.1002/ajh.23599
- Атауллаханов Ф.И., Баландина А.Н., Варданян Д.М., и др. Применение теста тромбодинамики для оценки состояния системы гемостаза. Учебно-методические рекомендации. Москва, 2015. 72 с. [Ataullakhanov FI, Balandina AN, Varda-nyan DM, et al. Application of the thrombodynamics test to assess the state of the hemostasis system. Educational and methodological recommendations. Moscow; 2015. 72 р. (In Russ).]
- Баландина А.Н., Кольцова Е.М., Шибеко А.М., и др. Тром-бодинамика: новый подход к диагностике нарушений системы гемостаза // Вопросы гематологии, онкологии и иммунопатологии в педиатрии. 2018. Т. 17, № 4. С. 114-126. [Balandina AN, Koltsova EM, Shibeko AM, et al. Thrombodynamics: a new approach to the diagnosis of hemostatic disorders. Issues of Hematology, Oncology and Immunopathology in Pediatrics. 2018;17(4):114-126. (In Russ).] doi: 10.24287/1726-1708-2018-17-4-114-126
- Lipets E, Vlasova O, Urnova E, et al. Circulating con-tact-pathwayactivating microparticles together with factors IXa and XIa induce spontaneous clotting in plasma of hema-tology and cardiologic patients. PLoS One. 2014;9(1):e87692. doi: 10.1371/journal.pone.0087692
- Бовт Е.А., Бражник В.А., Буланов А.Ю., и др. Результаты многоцентрового мониторинга показателей гемостаза у больных с COVID-19 // Педиатрия. Журнал им. Г.Н. Сперанского. 2020. Т. 99, № 6. С. 62-73. [Bovt EA, Brazhnikova VA Bulanov AY, et al. Results of multicenter monitoring of hemostasis indicators in patients with COVID-19. Pediatrics. 2020;99(6):62-73. (In Russ).] doi: 10.24110/0031-403X-2020-99-6-62-73


