Испытание системы доставки для транскатетерного протезирования митрального клапана
Автор: Шарифулин Равиль Махарамович, Богачев-прокофьев А.В., Журавлева И.Ю., Тимченко Т.П., Зыков И.С., Бояркин Е.В., Овчаров М.А., Караськов А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4 т.22, 2018 года.
Бесплатный доступ
Цель Оценка опытного образца системы доставки для транскатетерного протеза митрального клапана в эксперименте in vitro и при имплантации крупному лабораторному животному. Методы В эксперименте in vitro проведено испытание прототипов системы доставки и транскатетерного митрального биопротеза при имплантации в позицию нативного митрального клапана изолированного свиного сердца с использованием трансапикального доступа. В эксперименте на крупном лабораторном животном (свинье) имплантация проведена трансатриальным доступом. Результаты Выявлено, что прототип устройства доставки позволяет адекватно осуществить доставку и высвобождение транскатетерного протеза в зоне имплантации при использовании трансатриального и трансапикального доступов без деформации каркаса и нарушения функции клапанного аппарата. Заключение Опытный образец системы доставки для транскатетерного протезирования митрального клапана продемонстрировал удовлетворительные характеристики в эксперименте in vitro и при имплантации в позицию нативного митрального клапана крупного лабораторного животного.
Биологический протез, митральный клапан, транскатетерное протезирование митрального клапана
Короткий адрес: https://sciup.org/142230606
IDR: 142230606 | DOI: 10.21688/1681-3472-2018-4-80-87
Текст научной статьи Испытание системы доставки для транскатетерного протезирования митрального клапана
Значительной доли пациентов с патологией митрального клапана стандартная операция протезирования митрального клапана в условиях искусственного кровообращения не может быть выполнена в связи с тяжестью порока либо наличием тяжелых сопутствующих заболеваний [1, 2]. Для лечения данной группы пациентов предложена методика транскатетерного протезирования митрального клапана (англ. Transcatheter Mitral Valve Implantation, TMVI). В литературе описано 9 различных устройств для TMVI, имплантированных человеку [3]. К настоящему времени выполнено небольшое количество TMVI с непродолжительным сроком послеоперацион- ного наблюдения, однако данное направление является одним из перспективных и быстро развивающихся в кардиохирургии [4]. Устройство доставки является неотъемлемым компонентом системы для транскатетерного протезирования, от которого во многом зависит успех процедуры имплантации клапана. Ранее мы представили результаты испытания in vitro созданного в ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России прототипа нового протеза для TMVI при имплантации в позицию биологического протеза и нативного митрального клапана [5, 6].

Статья доступна по лицензии Creative Commons Attribution 4.0.
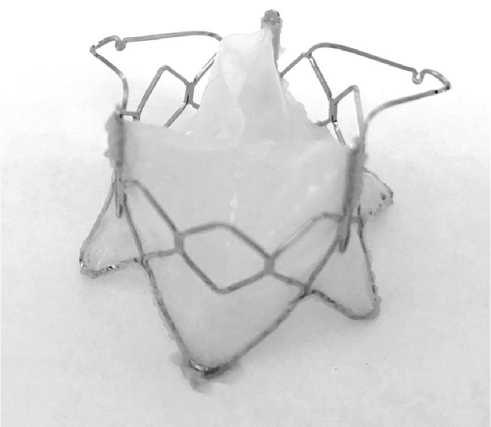
Рис. 1. Прототип транскатетерного протеза митрального клапана «Солертис»
Fig. 1. A prototype of “Solertis” transcatheter mitral valve prosthesis
Настоящая статья посвящена испытанию прототипа системы доставки для транскатетерного протеза митрального клапана.
Методы
В эксперименте in vitro и in vivo проведено испытание прототипов протеза «Солертис» и системы транскатетерной доставки. Эксперимент на лабораторном животном проведен в соответствии с Европейской конвен- цией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (EST № 123 от 18.03.1986 г., Страсбург), и приказом Минздрава России «Об утверждении правил надлежащей лабораторной практики» (№ 199н от 01.04.2016 г.). Протез «Солертис» представляет из себя нитиноловый опорный каркас, на котором монтированы створчатый аппарат и обшивка. Каркас протеза изготовлен по разработанному нами дизайну из медицинского никелида титана SE508LVM с использованием метода лазерной резки и электрохимической полировки трубчатой заготовки с последующим приданием каркасу конечной формы термообработкой на специальной матрице (компания MEKO Laser Processing, Германия). Створки и обшивка протеза изготовлены из свиного перикарда, обработанного диглицидиловым эфиром этиленгликоля. Конструкцией каркаса предусмотрено три зоны фиксации протеза в позиции нативного митрального клапана: за счет предсердной манжеты, радиальных распирающих сил аннулярной части каркаса и двух желудочковых фиксаторов, крепящихся за заднюю створку митрального клапана (рис. 1).
Прототип системы доставки представляет собой катетер диаметром 27 Fr, состоящий из ручки управления, с помощью которой осуществляется контроль степени высвобождения протеза из кожуха, катетерной части, которая придает основную длину, необходимую для доступа к месту имплантации, и рабочей части, удерживающей и обеспечивающей доставку
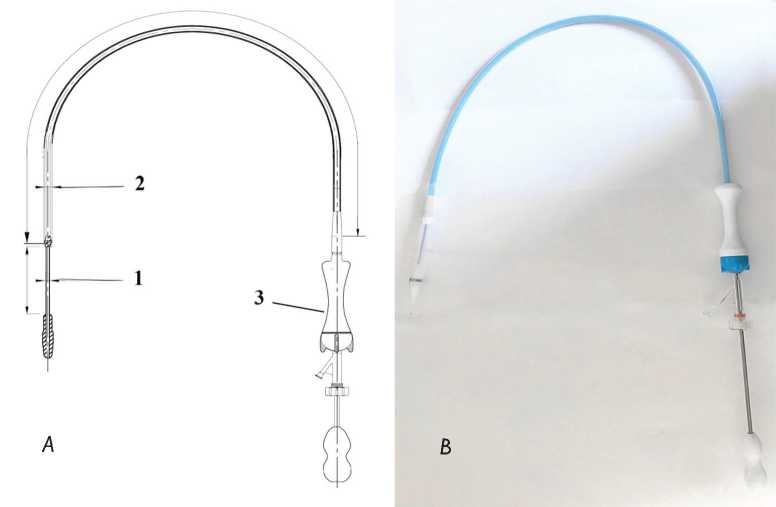
Рис. 2. Прототип системы доставки: схема системы доставки ( А ): 1 — рабочая часть, 2 — катетерная часть, 3 — ручка управления; фотография прототипа системы доставки ( B )
Fig. 2. Delivery system prototype: delivery system scheme ( A ): 1, shaft part, 2, catheter part, 3, control handle; photo of delivery system prototype ( B )
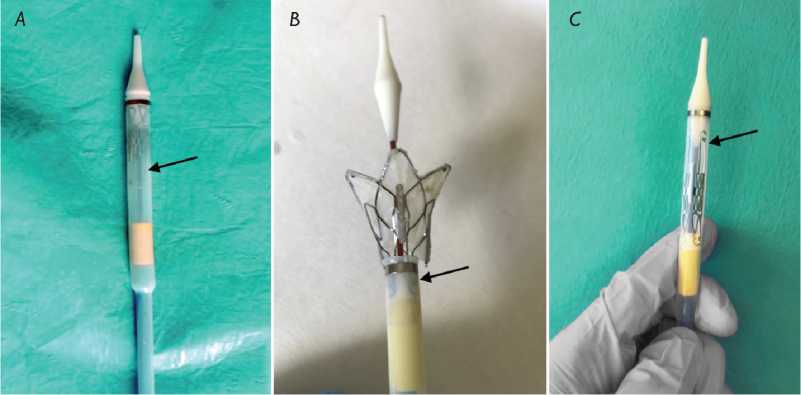
Рис. 3. Варианты загрузки протеза в систему доставки: рабочая часть системы доставки с полностью упакованным протезом для трансапикальной имплантации ( А ); протез, упакованный для трансапикальной имплантации, в частично раскрытом состоянии, фиксированный в системе доставки за желудочковые крючки ( B ); упаковка протеза для трансатриальной имплантации ( C ). Стрелками указаны желудочковые крючки протеза
Fig. 3. Variants of prosthesis insertion in delivery system: delivery system shaft with completely inserted prosthesis for transapical implantation (A); partly opened prosthesis inserted for transapical implantation, fixed in the delivery system by ventricular clamps (B); prosthesis insertion for transatrial implantation (C). The arrows point to prosthesis ventricular clamps прототипа протеза (рис. 2). Прототипирование системы доставки выполнила по разработанному нами дизайну компания ELLA-CS (Чехия).
Используя различную последовательность загрузки протеза в систему доставки, можно применить ее как для трансатриальной (при упаковке протеза желудочковыми фиксаторами в сторону рабочей части), так и трансапикальной (фиксаторы направлены в сторону ручки управления) имплантации (рис. 3).
Ранее мы описали имплантацию протеза и системы доставки in vitro с использованием трансатриального доступа [6]. В данном эксперименте проведены испытания прототипов in vitro с использованием трансапикального и in vivo трансатриального доступов.
В качестве in vitro модели выбрано изолированное сердце свиньи весом 750 г. Исходя из размеров фиброзного кольца митрального клапана (26 мм), выбрали протез типоразмера 30 мм. Подготовительный этап процедуры заключался в кримпировании прототипа протеза с использованием охлажденного физиологического раствора температурой 10 °C, который позволил обратимо пластически деформировать опорный каркас и упаковать его в систему доставки — в рабочую часть с фиксацией кожухом (рис. 3, А ).
Далее осуществляли пункцию миокарда в области верхушки левого желудочка с использованием порта. Затем через порт к месту имплантации заводили систему доставки со сжатым протезом (рис. 4, А ), таким образом, чтобы визуально оценивать глубину введения системы через левое предсердие (рис. 4, B ).
После позиционирования протеза, манипулируя ручкой управления, проводили сдвиг кожуха доставочной системы таким образом, чтобы обеспечить контролируемое последовательное извлечение элементов протеза: сначала предсердной манжеты, затем аннулярной части и в последнюю очередь желудочковых фиксаторов. При этом визуализацию места имплантации и контроль процедуры осуществляли видом «из левого предсердия» путем иссечения его стенки (рис. 4, C ). После имплантации, удаления системы доставки оценивали качество позиционирования и закрытие створок видом «из левого желудочка», который обеспечивали путем отсечения соответствующей части миокарда (рис. 4, D ).
В качестве модели для имплантации in vivo выбрана свинья женского пола массой 80 кг. До операции животному выполнена трансторакальная эхокардиография с целью определения необходимого размера протеза. Учитывая то, что диаметр фиброзного коль-
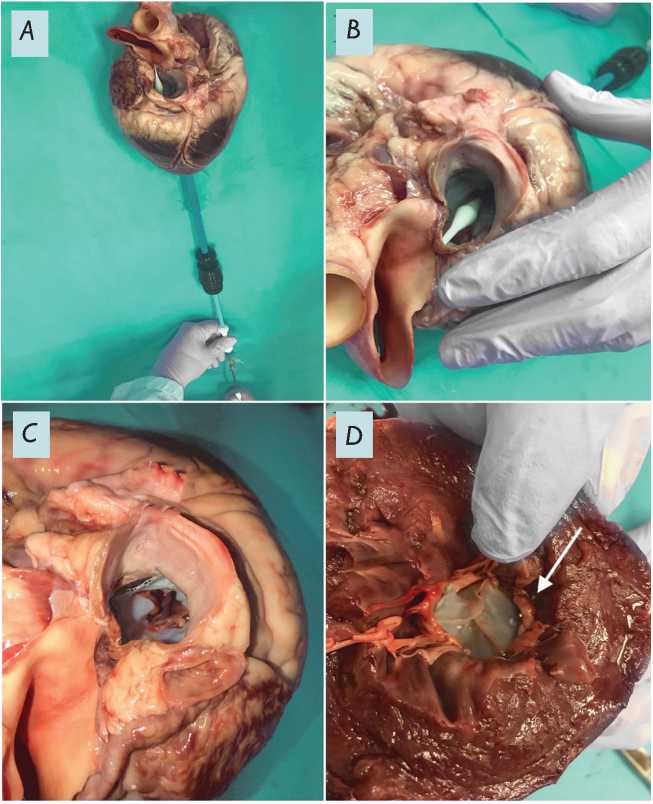
Рис. 4. Имплантация протеза трансапикальным доступом in vitro : введение системы доставки с протезом через порт, установленный в верхушку левого желудочка ( А ); визуализация степени погружения доставочной системы с видом «из левого предсердия» ( B ); протез после имплантации и удаления системы доставки, вид из левого предсердия ( C ); вид протеза «из левого желудочка»: стрелкой отмечен один из якорных элементов протеза ( D )
Fig. 4. Implantation of prosthesis in vitro : insertion of the delivery system with prosthesis through the port inserted into the left ventricle apex ( A ); visualization of insertion degree of the delivery system as viewed from the left atrium ( B ); prosthesis after implantation and delivery system retrieval as viewed from the left atrium ( C ); prosthesis as viewed from the left ventricle: the arrow points to one of the ventricular clamps ( D )
ца митрального клапана экспериментального животного составил 28 мм, для имплантации выбрали протез «Солертис» 32 мм.
Вмешательство выполняли в условиях экспериментальной операционной с соблюдением принципов асептики и антисептики. Использовали комбинированную общую анестезию. На подготовительном этапе упаковывали протез в систему доставки для трансатриального доступа (рис. 3, C ). Выполняли левосторон-
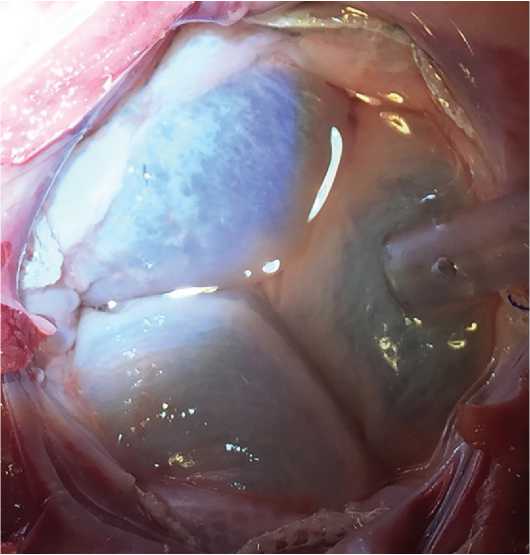
Рис. 5. Имплантация протеза in vivo : протез «Солертис» в митральной позиции (вид из левого предсердия), отсутствие сброса при гидравлической пробе
Fig. 5. Implantation of prosthesis in vivo: “Solertis” prosthesis in mitral valve position (view from the left atrium), absence of regurgitation during saline test нюю боковую торакотомию слева по 4-му межреберью. Вскрывали полость перикарда, после гепаринизации осуществляли канюляцию восходящей аорты с использованием бедренной артериальной канюли диаметром 18 Fr и правого предсердия моноканюлей 32 Fr. Для дренирования левых отделов сердца устанавливали канюлю 7 Fr в ствол легочной артерии. Операцию выполняли в условиях параллельного искусственного кровообращения на фибриллирующем сердце. Доступ к левому предсердию осуществляли через ушко левого предсердия. В левый желудочек заводили систему доставки с кримпированным протезом. После позиционирования и ориентации протеза в проекции фиброзного кольца митрального клапана осуществляли высвобождение желудочковых фиксаторов, учитывая их ориентацию по отношению к задней створке митрального клапана, далее последовательно высвобождали аннулярную и предсердную части протеза. Дополнительной фиксации протеза не производили. После отсоединения элементов протеза от держателей в системе доставки, последнюю извлекали, оценивали замыкательную функцию клапана с помощью гидравлической пробы. Атриотомный доступ герметизировался двурядным непрерывным швом нитью полипропилен 5/0. Пос-
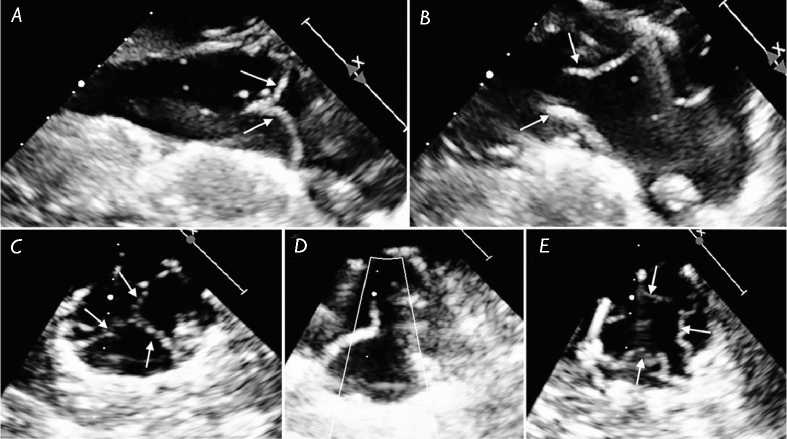
Рис. 6. Чреспищеводная эхокардиография после имплантации протеза «Солертис» в митральную позицию экспериментальному животному: длинная ось, вид протеза в систолу ( А ); длинная ось, вид протеза в диастолу ( В ); поперечный вид протеза в систолу ( C ); короткая ось, цветная допплерография, отсутствие транспротезной и парапротезной регургитации ( D ); поперечный вид протеза в диастолу ( Е ). Стрелками указаны створки протеза
Fig. 6. Transesophageal echocardiography after “Solertis” prosthesis implantation to experimental animal: long axis, view of the prosthesis in systole (А); long axis, view of the prosthesis in diastole (В); transverse view of the prosthesis in systole (C); short axis, color doppler ultrasonography, absence of transprosthetic and paraprosthetic regurgitation (D); transverse view of the prosthesis in diastole (Е). The arrows point to prosthesis leaflets ле отключения от искусственного кровообращения выполняли чреспищеводную эхокардиографию с целью оценки функции протеза.
Результаты
В ходе экспериментов in vitro и in vivo все элементы разрабатываемой системы протезирования функционировали прогнозируемо. Система доставки позволила вместить в рабочую область сжатый протез без деформирования створок или их разрыва и в дальнейшем осуществить последовательное высвобождение элементов протеза в зоне митрального клапана в соответствии с особенностями имплантации при трансатриальном и трансапикальном доступах. Упругие свойства материала каркаса обеспечили восстановление формы протеза после высвобождения из системы доставки и адекватное функционирование всех элементов протеза.
При использовании обоих способов имплантации фиксирующие элементы каркаса заняли предусмотренное конструкцией положение и обеспечили стабиль- ное закрепление транскатетерного протеза в позиции нативного митрального клапана.
В эксперименте in vitro после вентрикулотомии оценили ориентацию желудочковых элементов каркаса: оба крючка-фиксатора позиционированы адекватно, фиксировали заднюю створку митрального клапана, не создавая при этом препятствия в выходном отделе левого желудочка (рис. 4, D ).
Гидравлическая проба, выполненная после имплантации протеза экспериментальному животному, продемонстрировала удовлетворительную замыкательную функцию клапанного аппарата протеза, плотное прилегание каркаса к фиброзному кольцу митрального клапана с отсутствием парапротезного сброса (рис. 5).
По данным чреспищеводной эхокардиографии, проведенной после отключения от искусственного кровообращения, траспротезная регургитация была незначительной, парапротезной регургитации не зафиксировано (рис. 6). Пиковый транспротезный градиент составил 5 мм рт. ст. Элементы каркаса протеза и клапанный аппарат нативного митрального клапана не создавали обструкции на уровне выходного отдела левого желудочка.
Ранний послеоперационный период протекал без осложнений.
Обсуждение
Устройство транскатетерной доставки является одним из основных компонентов систем для транскатетерного протезирования клапанов сердца. Конструкция систем доставки определяется особенностями устройства протеза: размерами протеза, особенностями фиксации, материала и конструкции каркаса. Трансапикальный доступ является основным для TMVI, что объясняется относительно большими габаритами протезов, а также тем, что он обеспечивает наиболее короткий и прямой путь к месту имплантации [2]. Размеры описанных в литературе систем доставки варьирует в пределах 30–42 Fr (9–12,6 мм), поэтому для большинства протезов эндоваскулярная имплантация невозможна [3, 7]. Известно только о единичных операциях с использованием транссептального доступа для протезов CardiAQ и Caisson [8, 9].
Мы провели испытание прототипа системы доставки в эксперименте in vitro и при имплантации лабораторному животному. Разрабатываемая система продемонстрировала состоятельность с позиции обеспечения процедуры транскатетерной имплантации биологического протеза митрального клапана при использовании как трансапикального, так и трансатриального доступов. Устройство позволяет без деформации каркаса и нарушения целостности створок осуществить доставку и высвобождение протеза в зоне имплантации. Все элементы каркаса протеза после высвобождения занимают предусмотренное конструкцией положение, а клапанный аппарат адекватно выполняет замыкательную функцию.
Тем не менее в ходе эксперимента был выявлен ряд конструктивных особенностей прототипа протеза, усложняющих процедуру имплантации. Особенностью устройства каркаса протеза «Солертис» является то, что он имеет асимметричную желудочковую часть, представленную двумя якорными элементами, которые дополнительно играют роль фиксаторов в системе доставки, в то время как основная часть протеза имеет три симметричных элемента. Подобное несоответствие приводит к неравномерному кримпированию, что значимо усложняет данную процедуру и способно вызвать асимметричное раскрытие протеза. Возможным решением данной проблемы является создание радиальной симметрии на основе трех элементов-фиксаторов. Ранее мы отказались от использования каркаса с тремя желудочковыми фиксаторами, что было связано с обструкцией выходного отдела левого желудочка крючком, проецирующимся на переднюю створку митрального клапана. Таким образом, необходима модификация каркаса протеза с поиском баланса между созданием симметричной конструкции с тремя фиксаторами и сведением к минимальному риску обструкции выходного отдела левого желудочка.
Кроме того, выявлено, что высокая радиальная жесткость опорного каркаса приводит к незначительному эффекту «проваливания» центральных ячеек внутрь к центральной оси протеза в области асимметрии. С учетом необходимости сжатия протеза до 9 мм, такое поведение, вероятно, ассоциировано с риском образования микротрещин ячеек или участков необратимой деформации в закритической области петли гистерезиса нитинола. Возможное решение — переработка дизайна каркаса с учетом габаритов системы доставки: возврат к симметрии, удлинение ячеек центральной зоны, снижение радиальной жесткости.
В ходе настоящего эксперимента воспроизведены основные этапы имплантации транскатетерного протеза в позицию нативного митрального клапана лабораторного животного. Следует отметить, что имплантация клапана произведена «открытым» способом под прямым визуальным контролем. В дальнейшем необходимо проведение экспериментов по имплантации прототипа протеза в условиях, приближенных к клиническим: под рентгеноскопическим контролем, без использования искусственного кровообращения. Кроме того, для полноценной оценки созданной системы для транскатетерного протезирования митрального клапана необходимо осуществить серию имплантаций экспериментальным животным с изучением долгосрочных результатов.
Заключение
Опытный образец системы доставки для транскатетерного протезирования митрального клапана продемонстрировал удовлетворительные характеристики в эксперименте in vitro и при имплантации в позицию нативного митрального клапана крупного лабораторного животного.
Финансирование
Работа выполнена при поддержке гранта Российского научного фонда (16-15-10315).
Список литературы Испытание системы доставки для транскатетерного протезирования митрального клапана
- Журавлева И.Ю., Богачев-Прокофьев А.В., Демидов Д.П., Караськов А.М. Транскатетерное протезирование митрального клапана: современное состояние проблемы. Кардиология. 2017;57(8):51-9. 10.18087/ cardio.2017.8.10018 DOI: 10.18087/cardio.2017.8.10018
- Шарифулин Р.М., Богачев-Прокофьев А.В., Журавлева И.Ю., Тимченко Т.П., Железнев С.И., Караськов А.М. Результаты транскатетерного протезирования митрального клапана. Российский кардиологический журнал. 2018;23(11):137 144. DOI: 10.15829/1560-4071-2018-11-137-144
- Regueiro A., Granada J.F., Dagenais F., Rodes-Cabau J. Transcatheter mitral valve replacement: insights from early clinical experience and future challenges. J Am Coll Cardiol. 2017;69:2175-92. PMID: 28449780. 10.1016/j. jacc.2017.02.045 DOI: 10.1016/j.jacc.2017.02.045
- Sorajja P., Maisano F. Percutaneous treatment for native mitral regurgitation. Progress in Cardiovascular Diseases. 2017;60(3):405 14. PMID: 29133070. 10.1016/j. pcad.2017.11.003 DOI: 10.1016/j.pcad.2017.11.003
- Журавлева И.Ю., Нуштаев Д.В., Тимченко Т.В., Требушат Д.В., Майоров А.П., Железнев С.И., Демидов Д.П., Богачев-Прокофьев А.В. Модель устройства для транскатетерной замены митрального биопротеза при его дисфункции. Современные технологии в медицине. 2017;9(3):7 14. DOI: 10.17691/stm2017.9.3.0
- Богачев-Прокофьев А.В., Журавлева И.Ю., Шарифулин Р.М., Железнев С.И., Демидов Д.П., Кливер Е.Э., Караськов А.М. Имплантация in vitro первого отечественного транскатетерного протеза в нативный митральный клапан. Патология кровообращения и кардиохирургия. 2018;22(1):22-8. http:// dx.doi.org/10.21688-1681-3472-2018-1-22-28
- De Backer O., Piazza N., Banai S., Lutter G., Maisano F., Herrmann H.C., Franzen O.W., S0ndergaard L. Percutaneous transcatheter mitral valve replacement: an overview of devices in preclinical and early clinical evaluation. Circ Cardiovasc Interv. 2014;7(3):400-9. PMID: 24944303. 10.1161/ CIRCINTERVENTIONS.114.001607 DOI: 10.1161/CIRCINTERVENTIONS.114.001607
- Ussia G.P., Quadri A., Cammalleri V., De Vico P., Muscoli S., Marchei M., Ruvolo G., Sondergaard L., Romeo F. Percutaneous transfemoral-transseptal implantation of a second-generation CardiAQ mitral valve bioprosthesis: first procedure description and 30-day follow-up. Eurolntervention. 2016;11(10):1126-31. PMID: 26342591. DOI: 10.4244/EIJY15M09_01
- Ussia G.P., Cammalleri V., Mehta J.L., Sarkar K., Muscoli S., de Vico P., Ruvolo G., Romeo F. Transcatheter mitral valve replacement with a novel self-expandable prosthesis: single institutional experience procedural outcomes and follow-up. J Cardiovasc Med (Hagerstown). 2017;18(6):415-4. PMID: 28240641. DOI: 10.2459/JCM.0000000000000513


