Исследование алкилирования натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин- 7(4Н)-она методом ЯМР 1Н спектроскопии
Автор: Ильиных Елена Сергеевна, Ташкинов Павел Юрьевич, Ким Дмитрий Гымнанович, Русинов Владимир Леонидович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.8, 2016 года.
Бесплатный доступ
По данным ЯМР 1Н, при алкилировании натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин-7(4Н)-она 3-бромпропеном в системе К2СО3-ДМФА образуется смесь N(1), N(3) и N(4) аллильных производных, а реакции с 1,2-дибромэтаном и цис-1,4-дихлор-2-бутеном в тех же условиях не останавливаются на стадии алкилирования и протекают с образованием трициклических систем. Взаимодействие натриевой соли 2 метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин-7(4Н)-она с 3-бром-пропином в суперосновной среде ДМСО-КОН сопровождается ацетилен-алленовой перегруппировкой, в результате чего получен 2-метилтио-4-(пропа-1,2-диенил)-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин-7(4H)-он.
2-метилтио-6-нитро[1, 4]триазоло[5, 4]триазин-7(4н)-он, алкилирование, 3-бромпропен, 2-дибромэтан, цис-1, 4-дихлор-2-бутен, 3-бромпропин, ямр 1н спектроскопия, ацетилен-алленовая перегруппировка, 4]triazine-7(4н)-one, 1н nmr spectroscopy
Короткий адрес: https://sciup.org/147160351
IDR: 147160351 | УДК: 547.792 | DOI: 10.14529/chem160202
Текст научной статьи Исследование алкилирования натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин- 7(4Н)-она методом ЯМР 1Н спектроскопии
Дигидрат натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-она ( 1 ) (Триазавирин®) (см. рисунок) является новым эффективным нетоксичным противовирусным препаратом, созданным совместными исследованиями Уральского федерального университета, Института органического синтеза УрО РАН, ФГБУ НИИ группа Минздрава России, а также Уральского центра биотехнологий и завода «Медсинтез» [1]. Препарат продемонстрировал высокую эффективность при лечении различных типов вируса гриппа, включая свиной и птичий грипп.
Структура Триазавирина (1)
Известно, что нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазины способны к существованию в виде четырёх таутомерных форм A – D и, как следствие, к образованию четырех изомерных продуктов алкилирования по атомам N(1), N(3), N(4) и по атому кислорода (схема 1) [2].
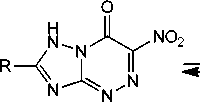
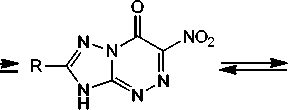
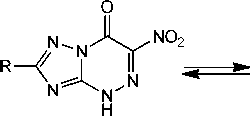
он
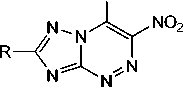
Схема 1. Таутомерные формы нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазинов
Целью данной работы является исследование реакций алкилирования соединения 1 3-бром-пропеном, 3-бромпропином, 1,2-дибромэтаном и цис -1,4-дихлор-2-бутеном.
Экспериментальная часть
Спектры ЯМР 1Н растворов веществ в ДМСО- d6 записаны на спектрометре Bruker DRX-400 (400 МГц), внутренний стандарт ТМС. Контроль состава смесей продуктов реакции осуществляли методом ТСХ на пластинках Silufol UV-254, обнаружение в УФ-свете (254 нм) облучателя хроматографического УФС 254/365.
Алкилирование дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ]-[1,2,4]триазин-7(4 H )-она (1) 3-бромпропеном. К раствору натриевой соли 2-метилтио-6-нитро-[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-она 1 (0,286 г, 1 ммоль) в ДМФА (5 мл) добавляли К2СО3 (0,138 г, 1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин, после чего к ней по каплям добавляли 3-бромпропен (0,18 мл, 2 ммоль) и перемешивали еще в течение 72 ч. После чего фильтровали, отгоняли растворитель из фильтрата, обрабатывали остаток смесью эфира и ацетонитрила (4:1) (20 мл) и снова фильтровали. После испарения растворителей получали смесь соединений 2 , 3 и 4 в виде масла вишневого цвета, которую исследовали методом ЯМР 1H. Общий выход смеси изомеров 2–4 0,030 г.
2-Метилтио-4-аллил-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он (2). Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , δ, м.д., J /Гц): 2,67 (3Н, с, SCH 3 ); 5,03 (2Н, д.т, 3 J = 5,6, 4 J trans = 1,4, NCH 2 ); 5,36 (1H, м, =СН 2 ); 5,47 (1H, м, =СН 2 ); 6,04 (1Н, м, С Н =СН 2 ).
2-Метилтио-3-аллил-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он (3). Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , δ, м.д., J /Гц): 2,66 (3Н, с, SCH 3 ); 4,69 (2Н, д.т, 3 J = 5,4, 4 J trans = 1,5, NCH 2 ); 5,10 (1H, м, =СН 2 ); 5,25 (1H, м, =СН 2 ); 5,84 (1Н, м, С Н =СН 2 ).
1-Аллил-2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он (4). Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , δ, м.д., J /Гц): 2,62 (3Н, с, SCH 3 ); 4,76 (2Н, м, NCH 2 ); 5,17 (1H, м, =СН 2 ); 5,25 (1H, м, =СН 2 ); 5,94 (1Н, м, С Н =СН 2 ).
Взаимодействие дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ]-[1,2,4]триазин-7(4 H )-она (1) с 1,2-дибромэтаном. К раствору натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-она 1 (0,286 г, 1 ммоль) в ДМФА (5 мл) добавляли К 2 СО 3 (0,138 г, 1 ммоль) и 1,2-дибромэтан (0,09 мл, 1 ммоль). Через 24 ч реакционную смесь фильтровали, отгоняли растворитель из фильтрата, обрабатывали остаток 2-пропанолом (20 мл) и снова фильтровали. После испарения растворителя получали соединение 5 в виде масла желтого цвета, которое исследовали методом ЯМР 1H. Выход 0,070 г.
Бромид 3-метилтио-6-нитро-5-оксо-2,5-дигидро-1 H -2a,4,4a,7,7a-пентаазациклопента[ cd ]-индения (5). Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , δ, м.д., J /Гц): 2,62 (3Н, с, SCH 3 ); 3,39 (2Н, м, 2-CH 2 ); 4,45 (2Н, м, 1–CH 2 ).
Взаимодействие дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ]-[1,2,4]триазин-7(4 H )-она (1) с цис -1,4-дихлор-2-бутеном. К раствору натриевой соли 2-метил-тио-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-она 1 (0,286 г, 1 ммоль) в ДМФА (5 мл) добавляли К 2 СО 3 (0,138 г, 1 ммоль) и цис -1,4-дихлор-2-бутен (0,11 мл, 1 ммоль). Через 72 ч реакционную смесь фильтровали, отгоняли растворитель из фильтрата, обрабатывали остаток ди-хлорметаном (20 мл) и снова фильтровали. После испарения растворителя получали соединение 6 в виде масла желтого цвета, которое исследовали методом ЯМР 1H. Выход 0,130 г.
Хлорид 1-метилтио-4-нитро-3-оксо-6,9-дигидро-3 H -2,2a,5,5a,9a-пентаазабензо[ cd ]азу-ления (6). Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , δ, м.д., J /Гц): 2,68 (3Н, с, SCH 3 ); 4,46 (2Н, д, 3 J = 7,7, 9–CH 2 ); 5,20 (2Н, д, 3 J = 6,3, 6–CH 2 ); 5,83 (1Н, м, –СН=); 6,00 (1Н, м, –СН=).
2-Метилтио-4-(пропа-1,2-диенил)-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он (7).
К раствору натриевой соли 2-метилтио-6-нитро-[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-она 1 (0,286 г, 1 ммоль) в ДМСО (10 мл) добавляли предварительно прокаленный KOH (0,056 г, 1 ммоль) и 3-бромпропин (0,09 мл, 1 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 1,5 ч при 190–200 оС. После чего отгоняли растворитель, остаток последовательно обрабатывали гексаном (10 мл), сероуглеродом (10 мл) и толуолом (10 мл) и фильтровали. После отгонки растворителей получали соединение 7 в виде коричневого порошка. Выход 0,040 г (15%).
Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , δ, м.д., J /Гц): 2,62 (3Н, с, SCH 3 ); 5,60 (1Н, м, =CH 2 ); 5,70 (1Н, м, =CH 2 ); 6,00 (1Н, м, –СН=).
Ильиных Е.С., Ташкинов П.Ю., Исследование алкилирования натриевой соли
Ким Д.Г., Русинов В.Л. 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин-7(4Н)-она…
Обсуждение результатов
Детальное исследование алкилирования 6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 Н )-онов показало, что реакции их натриевых, а также калиевых или тетрабутиламмониевых солей с алкилгалогенидами или диметилсульфатом протекают по атомам азота N(1), N(3), N(4) с образованием смеси всех трех изомерных N-алкильных производных (схема 2) [2–5].
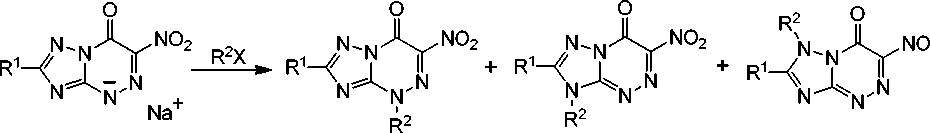
R 1 — |_| |\ло QR/lo- P2 — |\ло Pi n Dr / Dr nRu С H Г4 Ы PH ГППР+ p|-| ГН-r4U ■ ¥ — Dr I СП R/lo — n, ivie, oivie, — ivie, ы, п-г r, rri, //-du, ЬйП1я, ^яп17, ьгьиииы. ипоип—uno, a — di, i, oOAivie
Схема 2. Алкилирование 6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 Н )-онов
На направление реакции алкилирования 6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 Н )-онов и соотношение продуктов влияют такие факторы, как природа противоиона, растворителя и алкилирующего агента [2–5]. Так, в случае использования натриевой, калиевой или триэтилам-мониевой солей образуется смесь изомеров, а при использовании тетрабутиламмониевой соли реакция протекает селективно по атому N(4). При выборе в качестве реакционной среды метанола, ацетонитрила, диоксана реакция протекает медленно и с образованием всех трех возможных изомеров, тогда как в ДМФА алкилирование осуществляется наиболее быстро, полно и региосе-лективно с образованием преимущественно N(4)-производного (более 80 %).
Структура продуктов N(1)-, N(3)- и N(4)-алкилирования установлена авторами на основе данных ИК, ЯМР 1Н и 13С спектроскопии. В спектре ЯМР 1Н сигналы соответствующих протонов алкильных заместителей N(1)-, N(3)- и N(4)-алкильных производных 6-нитро[1,2,4]триазоло-[5,1- c ][1,2,4]триазин-7(4 Н )-онов расположены при переходе от более сильного поля к более слабому полю.
Ранее авторами работы [5] осуществлено алкилирование натриевой соли 2-метил-6-нитро-[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-она 3-бромпропеном в ДМФА при нагревании. Основной продукт, 2-метил-4-аллил-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он, был выделен из полученной смеси методом колоночной хроматографии. В его спектре ЯМР 1Н протоны -NCH 2 – аллильного фрагмента образуют мультиплет в слабом поле при δ 4,88 м.д., а при δ 2,52 м.д. расположен синглет метильной группы.
Нами исследовано алкилирование дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]-триазоло[5,1- c ][1,2,4]триазин-7(4 H )-она 1 двукратным избытком 3-бромпропена в системе К 2 СО 3 –ДМФА. По данным ЯМР 1Н найдено, что в результате реакции образуется смесь изомерных N(4)-, N(3)- и N(1)-производных – 2-метилтио-4-аллил-6-нитро[1,2,4]триазоло[5,1- c ]-[1,2,4]триазин-7(4 H )-он ( 2 ), 2-метилтио-3-аллил-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он ( 3 ) и 1-аллил-2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он ( 4 ) в соотношении ~ 1.0 : 0.2 : 0.3 (схема 3).
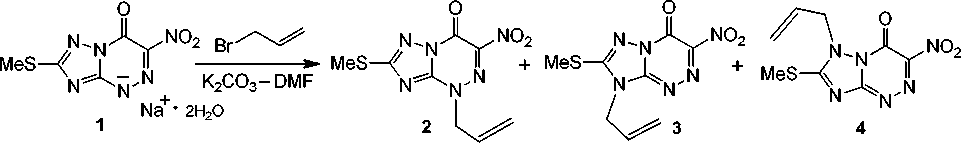
Схема 3. Алкилирование дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ]-[1,2,4]триазин-7(4 H )-она (1) 3-бромпропеном
В спектре ЯМР 1Н смеси соединений 2, 3 и 4 сигналы (дублеты триплетов) протонов –NCH2– аллильного фрагмента расположены при δ 5,03 м.д., δ 4,69 м.д. и δ 4,76 м.д. соответственно. Сле- дует отметить, что алкенильные протоны и протоны группы –SCН3 продукта алкилирования по атому N(4) триазинового цикла 2 закономерно дают сигналы в спектре в более слабом поле по сравнению с аналогичными протонами в производных 3 и 4.
Найдено, что реакции дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ]-[1,2,4]триазин-7(4 H )-она 1 с такими бифункциональными реагентами, как 1,2-дибромэтан и цис -1,4-дихлор-2-бутен, в тех же условиях (К 2 СО 3 –ДМФА) не останавливаются на стадии алкилирования, а сопровождаются дальнейшим замыканием цикла по атому N(2) и образованием трициклических систем – бромида 3-метилтио-6-нитро-5-оксо-2,5-дигидро-1 H -2a,4,4a,7,7a-пентааза-циклопента[ cd ]индения ( 5 ) и хлорида 1-метилтио-4-нитро-3-оксо-6,9-дигидро-3 H -2,2a,5,5a,9a-пентаазабензо[ cd ]азуления ( 6 ) соответственно (схема 4).
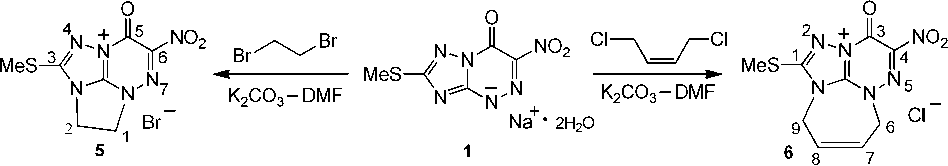
Схема 4. Взаимодействие дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ]-
[1,2,4]триазин-7(4 H )-она (1) с 1,2-дибромэтаном и цис -1,4-дихлор-2-бутеном
Наборы сигналов протонов солей 5 и 6 в спектрах ЯМР 1Н содержат сигналы протонов -NCH2– аннелированных циклов в виде двухпротонных мультиплетов при δ 3,39 м.д., δ 4,45 м.д. и дублетов при δ 4,46 м.д., δ 5,20 м.д. соответственно. Кроме того, в спектре соединения 6 имеются мультиплеты протонов –СН= при δ 5,83 м.д. и δ 6,00 м.д.
Известно, что в присутствии сильных оснований терминальные алкины вступают в реакцию ацетилен-алленовой изомеризации, являющейся одной из стадий перегруппировки Фаворского, с образованием алленов. Селективная изомеризация пропаргиловых эфиров в аллениловые эфиры впервые была осуществлена при действии t -BuOK на винилпропаргиловые эфиры олигоэтиленгликолей. Впоследствии был разработан эффективный и высокоселективный метод получения алкилаллениловых эфиров с использованием суперосновной системы ДМСО–КОН.
Нами установлено, что взаимодействие натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло-[5,1- c ][1,2,4]триазин-7(4 Н )-она 1 с 3-бромпропином в суперосновной среде ДМСО–КОН при нагревании приводит к образованию не ожидаемого 2-метилтио-4-(пропинил)-6-нитро[1,2,4]три-азоло[5,1- c ][1,2,4]триазин-7(4 H )-она, а сопровождается его ацетилен–алленовой перегруппировкой (схема 5). В результате чего получен 2-метилтио-4-(пропа-1,2-диенил)-6-нитро[1,2,4]три-азоло[5,1- c ][1,2,4]триазин-7(4 H )-он ( 7 ) в виде индивидуального соединения.
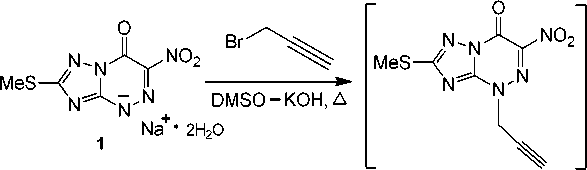
Схема 5. Алкилирование дигидрата натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ]-[1,2,4]триазин-7(4 H )-она (1) 3-бромпропином в системе ДМСО-КОН
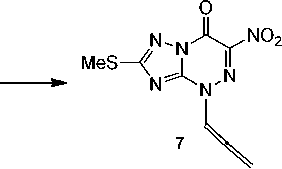
Действительно, в спектре ЯМР 1Н продукта 7 отсутствуют сигналы протонов пропинильной группы, в частности, сигнал терминального ≡С–Н протона около δ 3,00 м.д., но присутствуют мультиплет протона –СН= при δ 6,00 м.д. и два мультиплета при δ 5,60 м.д., δ 5,70 м.д., соответствующие терминальным протонам =СН 2 алленильной группы. Полученные данные доказывают образование в исследуемой реакции N-алленового производного 7 .
Ильиных Е.С., Ташкинов П.Ю., Исследование алкилирования натриевой соли Ким Д.Г., Русинов В.Л. 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин-7(4Н)-она…
Заключение
По данным ЯМР 1Н установлено, что при алкилировании натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 Н )-она 3-бромпропеном в системе К 2 СО 3 –ДМФА образуется смесь N(1), N(3) и N(4) аллильных производных с преобладанием последнего. Реакции натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 Н )-она с 1,2-ди-бромэтаном и цис -1,4-дихлор-2-бутеном в системе К2СО3–ДМФА приводят к образованию трициклических систем. Найдено, что алкилирование натриевой соли 2-метилтио-6-нитро[1,2,4]-триазоло[5,1- c ][1,2,4]триазин-7(4 Н )-она 3-бромпропином в суперосновной среде ДМСО–КОН сопровождается ацетилен-алленовой перегруппировкой, в результате чего синтезирован 2-метилтио-4-(пропа-1,2-диенил)-6-нитро[1,2,4]триазоло[5,1- c ][1,2,4]триазин-7(4 H )-он.
Список литературы Исследование алкилирования натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин- 7(4Н)-она методом ЯМР 1Н спектроскопии
- Противовирусный препарат Триазавирин®: от скрининга до клинической апробации/Э.Г. Деева, В.Л. Русинов, В.Н. Чарушин и др.//Разработка и регистрация лекарственных средств. -2014. -№ 2. -С. 144-151.
- Нитроазины. 7. Алкилирование 6-нитро-7-оксо-4,7-дигидроазолотриазинов и идентификация продуктов/Е.Н. Уломский, В.Л. Русинов, О.Н. Чупахин и др.//Химия гетероцикл. соед. -1987. -№ 11. -C. 1543-1550.
- Азоло-1,2,4-триазины -новый класс противовирусных соединений/В.Л. Русинов, Е.Н. Уломский, О.Н. Чупахин и др.//Изв. АН. Сер. хим. -2008. -№ 5. -C. 967-995.
- Русинов, В.Л. Синтез нитропроизводных азолотриазина/В.Л. Русинов, А.Ю. Петров, И.Я. Постовский//Химия гетероцикл. соед. -1980. -№ 9. -C. 1283-1285.
- Синтез и противовирусная активность 6-нитро-7-оксо-4,7-дигидроазоло-триазинов/В.Л. Русинов, Е.Н. Уломский, О.Н. Чупахин и др.//Хим.-фармац. журн. -1990. -Т. 24, № 9. -C. 41-44.

![Исследование алкилирования натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин- 7(4Н)-она методом ЯМР 1Н спектроскопии Исследование алкилирования натриевой соли 2-метилтио-6-нитро[1,2,4]триазоло[5,1-c][1,2,4]триазин- 7(4Н)-она методом ЯМР 1Н спектроскопии](/file/cover/147160351/issledovanie-alkilirovanija-natrievoj-soli-2-metiltio-6-nitro-124-triazolo.png)
