Исследование антимюллерова гормона у собак
Автор: Хуснетдинова Н.Ф., Ипполитова Т.В.
Статья в выпуске: 2 т.242, 2020 года.
Бесплатный доступ
По количеству антимюллерова гормона можно определить отсутствие или наличие яичников у самок. Показаны достоверные различия содержания АМГ у самок интактных и стерилизованных. Содержание АМГ у самок в разные периоды полового цикла не одинаковы. У собак с овариореминантным синдромом уровень АМГ не всегда различается от уровня АМГ у стерилизованных.
Гормон, амг, собаки, эндокринология
Короткий адрес: https://sciup.org/142224228
IDR: 142224228 | УДК: 636.7:612.08 | DOI: 10.31588/2413-4201-1883-242-2-198-202
Текст научной статьи Исследование антимюллерова гормона у собак
Эндокринные исследования для оценки функционального состояния животных имеют огромное значение. Достижения, отметившие развитие эндокринологии за последние годы, заставили переосмыслить и существенно дополнить наши преставления о механизмах репродуктивных процессов. Гормонов, отвечающих за исправное функционирование репродуктивной системы животных много. Одним из наименее изученных среди них является антимюллеров гормон (АМГ).
В 19 веке немецким анатомом и физиологом Иоганном Мюллером был описан проток, названный мюллеровым. Первоначально мюллеров проток есть у зародышей как женского, так и мужского пола. У будущих особей мужского рода Мюллеров проток редуцируется под действием антимюллерова гормона. Об этом свидетельствуют исследования, проведенные [4, 8] на мышах и овцах. А у зародышей жен- ского пола недостаток АМГ позволяет Мюллерову протоку формироваться дальше и из него образуется матка и верхняя часть влагалища.
Секреция АМГ у особей мужского рода начинается в период эмбриогенеза и продолжается на протяжении всей жизни. Секретируется АМГ у самцов клетками Сертоли. АМГ у самок синтезируется клетками гранулезы первичных, преан-тральных и антральных фолликулов [6]. В работах на мышах показано, что наиболее высокая концентрация АМГ определялась в преантральных и малых антральных фолликулах [9], а в более крупных антральных фолликулах количество АМГ постепенно снижается. В этом случае АМГ, секретируемый пулом растущих фолликулов, выступает в качестве сигнала обратной связи, подавляя первоначальный выбор первичных фолликулов [2].
Выявлено, что в естественных усло- виях и в условиях эксперимента in vitro на мышах усиливается переход примордиальных фолликулов в первичные при отсутствии АМГ, что приводит к раннему истощению яичников. Основная функция АМГ это торможение роста фолликулов яичника при выборе доминантных фолликулов. Достигается это путем ингибирования перехода примордиальных фолликулов в первичные, растущие фолликулы и путем ингибирования чувствительности к фолликулостимулирующему гормону преантраль-ных и малых антральных фолликулов.
В связи с тем, что АМГ синтезируется исключительно в половых железах [3], он может быть использован в качестве теста, подтверждающего наличие или отсутствия ткани гонад. Ряд авторов [1] исследуя АМГ у собак на различных тест системах сообщают о различной чувствительности теста. Разногласия связаны очевидно с тем, что АМГ является видоспецифичным гормоном (по химической структуре является гликопротеином, относится к семейству В-трасформирующих факторов роста [6]) и не каждая тест система может быть пригодна для его выявления.
В этой связи целью нашей работы было определить концентрацию АМГ в сыворотке крови у стерилизованных самок, интактных и у самок с реминантным яичником на тест системе АМГ GEN 2.
Причиной появления реминантного яичника является неполное удаление тканей яичника во время овариоэктомии или реваскуляризация тканей яичников, по неосторожности уроненных в брюшную полость. Синдром реминантного яичника у собак впервые описали Le Roux и Van Der Walt d в 1977 году. Подозрение на оварио-реминантный синдром возникает тогда, кода у ранее стерилизованного животного появляются признаки течки. Остатки тканей яичников приводят к продолжению выработки гормонов, которые вызывают половое поведение.
Материал и методы исследований. Данное исследование проведено на клинически здоровых собаках разных пород в возрасте от 2 до 14 лет. Перед взятием крови собирали анамнез, проводили клинический осмотр, производили цитологию мазков, УЗИ яичников и матки. Самки были разделены на три группы: интактные самки (n=15) в возрасте 2-6 лет, самки с реминантным яичником (n=7) в возрасте (4-8 лет) и стерилизованные самки без ре-минанта (n=10) в возрасте от 3 до 12 лет. Диагноз овариореминантный синдром был подтвержден диагностической лапарато-мией. Для исследования кровь брали из подкожной вены предплечья в количестве 2-3 мл, затем ее отстаивали в течение 30 мин и центрифугировали при 3300 об\мин в течение 10 мин. Сыворотку отделяли, замораживали и хранили при t -20 °C до использования в исследованиях. Размораживание и повторное замораживание не допускалось. У всех сук были взяты образцы крови для определения АМГ и прогестерона в сыворотки крови.
Определение содержания АМГ проводили иммуноферментным методом с помощью наборов фирмы Beckman Coulter на анализаторе Sunrise Touch. Набор для определения АМГ – AMG GEN 2. Уровень прогестерона в сыворотке крови измеряли с использованием серийно выпускаемых наборов фирмы Хема. Результаты вагинальной цитологии, концентрацию прогестерона оценивали для определения стадии полового цикла. Мазки окрашивали набором для быстрого дифференциального окрашивания Диахим-Дифф-Квик. Цифровые данные, полученные в эксперименте, обработаны биометрически на персональном компьютере с использованием прикладной программы GraphPad Prism v.8. Выборки проходили проверку на нормальность распределения по тесту Шапиро-Вилк. Проверка гипотез проводилась с помощью двухфакторного дисперсионного анализа и t-тест в случае необходимости. Значение p<0,05 считалось статистически значимым.
Результаты исследований. Проведенное исследование на самках собак показало, что у интактных собак АМГ в зависимости от стадии полового цикла составил в период анэструса 2,14±0,36 нг/мл (0,63-4,8) и в период диэструса 1,58±0,1 нг/мл (1,4-1,76). У четырех самок с подтвержденным по узи реминантным яични- ком АМГ в фазу анэструса составил 1,42±0,13 нг/мл, (1,2-1,8). Однако у трех самок с подтвержденным по узи реми- нантным яичником АМГ в фазу диэструса был менее 0,19 нг/мл. Данные приведены на рисунке 1.
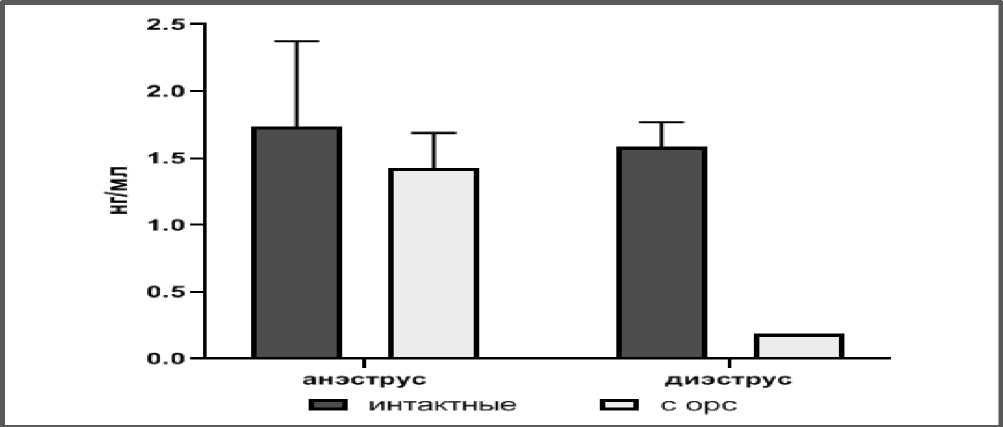
Рисунок 1 – Содержание АМГ в анэструс и диэструс у интактных самок и самок с овариоре-минантным синдромом
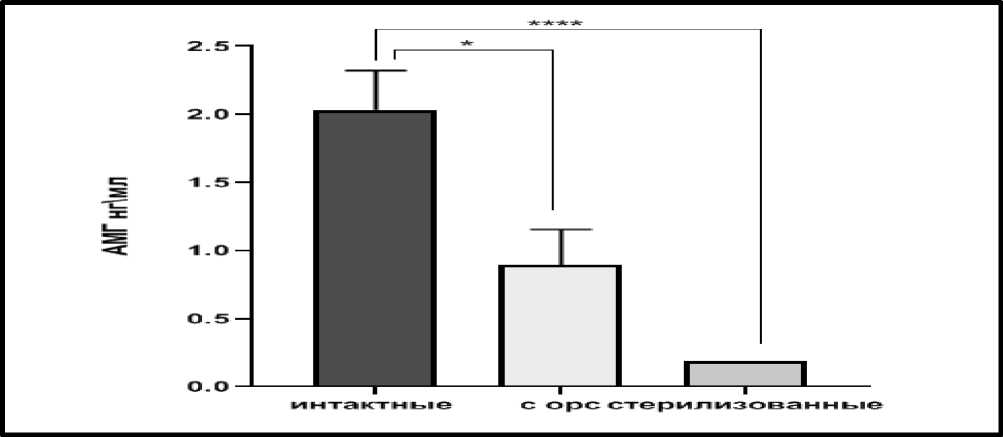
Рисунок 2 – Содержание АМГ у интактных, стерилизованных и с ОРС самок. *p= 0,0129,
****p <0,0001.
Все стерилизованные самки имели уровни АМГ ниже предела обнаружения анализа (<0,19 нг/мл). Таким образом, специфичность правильной идентификации по АМГ самок без яичников составила 100 %. То есть у стерилизованных самок АМГ не выявлен.
Разница между стерилизованными самками и нестерилизованными достоверно различалась (p<0,0001). У 7 собак с овариореминантным синдромом была проведена лапаратомия для подтверждения наличия ткани яичника. Гистологическое исследование подтвердило, что все образцы представляли собой ткань яичника. Концентрация АМГ в сыворотке крови у самок с овариореминантным синдромом была достоверно ниже, чем у группы не-стерилизованных сук (p<0,01). Данные приведены на рисунке 2.
Цитологическое исследование мазков влагалища, клинические данные и уровень прогестерона в сыворотке крови позволили определить стадию полового цикла у каждой самки. В период анэструса у интактных самок прогестерон составил 2,6±0,25 нмоль/л, у собак с овариореми-нантным синдромом – 3,6±0,5 нмоль/л, у стерилизованных – 2,0±0,2 нмоль/л.
В период диэструса у интактных прогестерон составил 28,7±1,02 нмоль/л, у собак с овариореминантным синдромом – 24,1±3,04 нмоль/л. Данные приведены в таблице 1.
Таблица 1 – Содержание антимюллерова гормона и прогестерона у собак разных групп
|
Наименование групп |
Уровень АМГ, нг/мл |
Уровень прогестерона, нмоль\л |
|
Интактные самки в фазе анэструса(n=12) |
2,14±0,36 |
2,6±0,25 |
|
Интактные самки в фазе диэструса (n=3) |
1,58±0,1 |
28,7±1,02 |
|
Стерилизованные самки с реминантным яичником в фазе диэструса (n=3) |
<0,19 |
24,1±3,04 |
|
Стерилизованные самки с реминантным яичником в фазе анэструса (n=4) |
1,42±0,13 |
3,6±0,5 |
|
Cтерилизованные самки (n=10) |
<0,19 |
2,0±0,2 |
Заключение. Настоящее исследование показало, что уровень АМГ в сыворотке крови у стерилизованных самок значительно ниже, чем у интактных. Это заключение указывает на то, что измерение АМГ в сыворотке крови является полезным инструментом для диагностики того, была ли проведена овариоэктомия и это может быть использовано в приютах как наиболее простой тест для диагностики.
Резюме
По количеству антимюллерова гормона можно определить отсутствие или наличие яичников у самок. Показаны достоверные различия содержания АМГ у самок интактных и стерилизованных. Содержание АМГ у самок в разные периоды полового цикла не одинаковы. У собак с овариореминантным синдромом уровень АМГ не всегда различается от уровня АМГ у стерилизованных.
Список литературы Исследование антимюллерова гормона у собак
- Broekmans, F.J. Anti-mllerian hormone and ovarian dysfunction / F.J. Broekmans, J.A. Visser, J.S. Laven [et al.] // Trends Endocrinol Metab. - 2008. - V. 19. - P. 340-347.
- Durlinger, A.L. Control of primordial follicle recruitment by anti-Mullerian hormone in the mouse ovary/ A.L. Durlinger, P. Kramer [et al.] // Endocrinology. - 1999. - V.140 - P. 589-5796.
- La Marca, A. The Anti-Mullerian Hormone and Ovarian Cancer / A. La Marca, A. Volpe // Human Reproduction Update. - 2005. - V. 13. - P. 265-273.
- Munsterberg, A. Expression of the mouse anti-Mullerian hormone gene suggests a role in both male and female sexual differentiation / A. Munsterberg, R. Lovell // Development. - 1991. -V.113. - P. 613-624.
- Nagashima, J.B. Anti-mullerian hormone in the domestic dog during the anestrus to oestrous transition / J.B. Nagashima, B.S. Hansen, M.M. Matzuk [et al.] // Reprod. Domest. Anim. - 2016. - V. 51. - P. 158-164.
- Picard J.Y. Purification of testicular anti-mullerian hormone allowing direct visualization of the pure glycoprotein and determination of yield and purification factor / J.Y. Picard, N. Josso // Mol. Cell. Endocrinol. - 1984. - V. 34. - P. 23-29.
- Pir, Y.I. Does serum anti-mullerian hormone levels always discriminate presence of the ovaries in adult bitches? / Y.I. Pir [et al.] // Comparison of two ELISA kits. Reprod. Domest. Anim. - 2016. - P. 910-915.
- Sweeney, T. Ontogeny of anti-Mullerian hormone, 3-B-hydroxysteroid dehydrogenase and androgen receptor expression during / T. Sweeney, P.K. Saunders, M.R. Millar [et al.]. -1997. - V. 153. - P. 27-32.
- Weenen, C. Anti-Mullerian Hormone expression pattern in the human ovary: potential implications for intial and cyclic follicle retuitment / C. Weenen, J.S. Laven // Mol. Hum. Reprod. - 2004. - V. 10. - P. 77-83.


