Исследование антимутагенного действия гидрофильной криофракции селезенки крупного рогатого скота
Автор: Востроилова Г.А., Шабунин С.В., Шабанов Д.И., Хохлова Н.А., Корчагина А.А., Сыромятников М.Ю., Некрасов А.В., Селютина М.А., Морозова Д.Д.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Тканевые препараты
Статья в выпуске: 6 т.59, 2024 года.
Бесплатный доступ
Высокие производственные нагрузки и ухудшение экологической обстановки приводят к усилению действия различных факторов, которые способны вызывать мутации в клетках сельскохозяйственных животных. Накопление мутаций приводит к возникновению заболеваний, нарушению иммунных функций, снижению набора массы, частичной или полной стерильности, потере ценных признаков породы, вызывает гибель, а также отражается на следующих поколениях. Одним из способов снижения накопления повреждений ДНК в организме считают применение препаратов, обладающих антимутагенным действием. Фармакологические субстанции, полученные из тканей животных, например селезенки крупного рогатого скота (КРС), могут стать перспективной основой для препаратов с такими свойствами. В настоящей работе впервые установлено антимутагенное действие гидрофильной криофракции селезенки КРС на клетки костного мозга мышей, а также ДНК-защитное действие по отношению к митохондриальной ДНК (мтДНК) печени мышей в условиях цитогенетической нестабильности, индуцированной экспериментальным мутагеном митомицином С. Также показано влияние гидрофильной криофракции селезенки КРС на некоторые маркеры окислительного стресса в клетках печени мышей при введении животным митомицина С. Целью работы было определение влияния гидрофильной криофракции селезенки крупного рогатого скота на цитогенетическую стабильность клеток костного мозга и целостность мтДНК печени мышей, а также оценка ее антимутагенного и ДНК-протекторного действия на мышах с индуцированной митомицином С (ММС) цитогенетической нестабильностью. Гидрофильная криофракция селезенки КРС (ГКСК) была получена в ФГБНУ ВНИВИПФиТ. Положительным контролем служил препарат Митомицин С Киова («Kyowa Hakko Kogyo Co., Ltd», Япония), содержащий в качестве действующего вещества митомицин. Опыты проводили в 2024 году. Использовали самцов белых беспородных мышей (Mus albus officinarum) (n = 30) с массой тела 26,0±2,0 г. Были сформированы пять групп животных (n = 6). В I группе (отрицательный контроль) животным однократно внутримышечно вводили стерильный изотонический раствор хлорида натрия в объеме 0,1 мл. Во II группе мыши получали однократно внутримышечную инъекцию ГКСК в дозе 0,5 мл/кг в объеме 0,1 мл. Животным III группы вводили 3-кратно внутримышечно с интервалом в 24 ч ГКСК в дозе 0,5 мл/кг в объеме 0,1 мл и совместно с последней инъекцией ГКСК однократно внутрибрюшинно ММС в дозе 10 мг/кг в объеме 0,5 мл. Животным IV группы вводили внутримышечно однократно ГКСК в дозе 0,5 мл/кг в объеме 0,1 мл и однократно внутрибрюшинно ММС аналогично III группе. Мыши из V группы (положительный контроль) получали однократно интраперитонеально ММС в дозе 10 мг/кг в объеме 0,5 мл. Мышей выводили из эксперимента через 24 ч после последней инъекции посредством передозировки углекислого газа в специальной камере. Для исследования частоты полихроматофильных эритроцитов (ПХЭ) с микроядрами (микроядерного теста) клетки костного мозга из бедренных костей добавляли к инактивированной фетальной телячьей сыворотке («БиолоТ», Россия) и наносили на предметные стекла, далее препараты высушивали и окрашивали по Папенгейму. Исследовали частоту ПХЭ с микроядрами на 1000 ПХЭ, также учитывали отношение ПХЭ к нормохромным эритроцитам (НЭ). Относительное количество повреждений в мтДНК оценивали методом qPCR. Для этого выделяли тотальную ДНК из 25 мг гомогенизированной печени мышей при помощи набора ПРОБА-ГС («ДНК-технология», Россия). Расчет повреждений мтДНК проводили в участках, кодирующих 12S и 16S рРНК (12S-16S) и ген ND5 (ND5). Суммарное относительное содержание внутриклеточных активных форм кислорода (АФК) определяли с помощью клеточного зонда - 2´,7´-дихлордигидрофлуоресцеиндиацетата («Sigma-Aldrich», США), который, окисляясь внутри живых клеток, образует флуоресцирующую форму (DCF), детектируемую с помощью спектрофлуориметра RF-5301 («Shimadzu», Япония). Содержание внутриклеточных АФК оценивали в суспензии клеток печени мышей (3×106 кл/мл). Концентрацию малоновогодиальдегида (МДА) определяли в гомогенате печени мышей с помощью спектрофотометра UV-1700 («Shimadzu», Япония) по окрашиванию раствора при l = 535 нм триметиновым комплексом. В результате экспериментов мы не обнаружили значимых отличий от негативного контроля всех исследуемых параметров у мышей из II группы. Так во II группе частота ПХЭ с микроядрами составляла 0,41±0,080 %, количество повреждений мтДНК во фрагментах 12S-16S и ND5 - соответственно 0,0±0,92 и 2,2±0,45. Введение ММС в V группе приводило к увеличению частоты ПХЭ с микроядрами в костном мозге мышей до 11,20±1,000 %. Количество повреждений мтДНК печени возрастало до 4,1±0,44 и 4,2±0,30 во фрагментах 12S-16S и ND5, что сопровождалось увеличением содержания внутриклеточных АФК до 314,0±44,20 отн. ед и концентрации МДА до 1,7±0,15 мкмоль/г.
Гидрофильная криофракция селезенки крс, мутагенность, антимутагенное действие, повреждение днк, митохондриальная днк, митомицин, микроядерный тест, свободнорадикальное окисление, мыши
Короткий адрес: https://sciup.org/142244143
IDR: 142244143 | УДК: 619:615.36:575.224.46 | DOI: 10.15389/agrobiology.2024.6.1192rus
Текст научной статьи Исследование антимутагенного действия гидрофильной криофракции селезенки крупного рогатого скота
В условиях интенсификации сельского хозяйства животные подвергаются воздействию множества стресс-факторов, что ведет к возрастанию нагрузки на организм. Широкая химизация промышленности и сельского хозяйства, нарушение технологических цепочек, а также ухудшение экологической обстановки приводят к активному распространению мутагенов в окружающей среде и производственных цепочках, что становится причиной возникновения множества патологий (1, 2).
Ряд заболеваний различной этиологии (вирусной, бактериальной, паразитарной и др.) также может повышать нагрузку на целостность генетического аппарата животных и стимулировать увеличение количества мутаций (3-5). Нарушение процессов обмена веществ и окислительный стресс стимулируют образование токсических эндогенных соединений, обладающих мутагенным действием, которые индуцируют повреждение молекул ДНК, например малонового диальдегида (5, 6). Мутации, возникающие в соматических и половых клетках в течение жизни животного, способны приводить к канцерогенезу, гибели клеток, нарушениям обмена веществ и функционирования внутриклеточных процессов, вызывая каскад изменений: усиление деградации ДНК, нарушение выработки цитокинов и процессов фагоцитоза, угнетение факторов иммунитета (7-10). В результате повреждения генетического аппарата высока вероятность передачи возникших мутаций потомству, снижения фертильности продуктивных животных, гибели потомства, потери ценных признаков сельскохозяйственных пород. Эти факторы в конечном итоге приводят к экономическим потерям (10, 11). Поэтому большую значимость приобретает поиск природных антимутагенов, способных предотвратить вредное действие мутагенных факторов, а также способов их применения (12).
Для современного сельского хозяйства актуально создание протек-тивных лекарственных средств, обладающих антимутагенным эффектом. Антимутагенез — биологическое явление подавления мутационного процесса, выражающееся в снижении частоты спонтанного и индуцированного мутирования под действием природных и синтетических соединений (13).
Поскольку некоторые ткани животных содержат большое количество гормонов, цитокинов и других биологически активных веществ, в ряде исследований были показаны иммуномодулирующие, антиоксидантные, цито- и радиопротекторные свойства препаратов, содержащих различные экстракты этих тканей, например селезенки крупного рогатого скота (КРС), что делает их перспективными для изучения антимутагенных свойств (14, 15). Вместе с тем антимутагенное действие фармацевтических субстанций животного происхождения при генотоксическом воздействии, индуциро- ванном химическими мутагенами, изучено недостаточно.
Поскольку процесс мутагенеза можно существенно модифицировать в сторону снижения мутагенных эффектов, направленный поиск антимутагенов представляет актуальную тему для исследования. Полученные сведения могут быть использованы для создания функциональных продуктов с антимутагенными свойствами и разработки эффективных лекарственных препаратов с генопротекторным действием.
Митомицин С (ММС) — антибиотик, применяемый в противоопухолевой терапии, который используется для экспериментального моделирования цитогенетической нестабильности (16). Мутагенное действие ММС хорошо проявляется на клетках, обладающих высокой пролиферативной активностью, например клетках костного мозга или печени мышей, что делает их удобной тест-системой для исследования биологических свойств фармацевтических субстанций (17).
В настоящей работе впервые установлено антимутагенное действие гидрофильной криофракции селезенки КРС на клетки костного мозга мышей, а также ДНК-защитное действие по отношению к митохондриальной ДНК печени мышей в условиях цитогенетической нестабильности, индуцированной экспериментальным мутагеном митомицином С. Также показано влияние гидрофильной криофракции селезенки КРС на некоторые маркеры окислительного стресса в клетках печени мышей при введении животным митомицина С.
Целью работы было определение влияния гидрофильной криофракции селезенки крупного рогатого скота на цитогенетическую стабильность клеток костного мозга и целостность мтДНК печени мышей, а также оценка ее антимутагенного и ДНК-протекторного действия на мышах с индуцированной митомицином С цитогенетической нестабильностью.
Методика. Гидрофильная криофракция селезенки КРС (ГКСК) была получена во Всероссийском научно-исследовательском ветеринарном институте патологии, фармакологии и терапии (ФГБНУ ВНИВИПФиТ). Положительным контролем служил препарат Митомицин С Киова («Kyowa Hakko Kogyo Co., Ltd», Япония), содержащий в качестве действующего вещества митомицин.
В опытах использовали самцов белых беспородных мышей ( Mus albus officinarum ) ( n = 30) с массой тела 26,0±2,0 г, которых разводили в виварии ФГБНУ ВНИВИПФиТ (2024 год). Подопытные животные содержались в стандартных условиях вивария (температура воздуха 18-23 ° C, относительная влажность 45-60 %). Доступ к воде и корму был свободным. Все процедуры с животными, предусмотренные в исследовании, были рассмотрены и одобрены на заседании биоэтической комиссии ФГБНУ ВНИ-ВИПФиТ до начала экспериментальной работы и соответствовали правилам, принятым в European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes (ETS 123), Strasbourg, 1986; Директиве 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 года по охране животных, используемых в научных целях; Guide for the Care and Use of Laboratory Animals, Washington (DC), 1996; Этическом кодексе ветеринарного врача Российской Федерации, рекомендованном на XIII Московском международном ветеринарном конгрессе Ассоциации практикующих ветеринарных врачей России, 2005 год.
Были сформированы пять экспериментальных групп животных ( n = 6 в каждой группе). В I группе (отрицательный контроль) животным однократно внутримышечно вводили стерильный изотонический раствор хлорида натрия в объеме 0,1 мл. Во II группе мыши получали однократно внут-1194
римышечную инъекцию ГКСК в дозе 0,5 мл/кг в объеме 0,1 мл. Животным III группы вводили трехкратно внутримышечно с интервалом в 24 ч ГКСК в дозе 0,5 мл/кг в объеме 0,1 мл и совместно с последней инъекцией ГКСК однократно внутрибрюшинно ММС в дозе 10 мг/кг в объеме 0,5 мл. Животным IV группы вводили внутримышечно однократно ГКСК в дозе 0,5 мл/кг в объеме 0,1 мл и однократно внутрибрюшинно ММС аналогично III группе. Мыши из V группы (положительный контроль) получали однократно интраперитонеально ММС в дозе 10 мг/кг в объеме 0,5 мл. Мышей выводили из эксперимента через 24 ч после последней инъекции посредством передозировки углекислого газа в специальной камере.
Для проведения микроядерного теста (определение частоты полихроматофильных эритроцитов — ПХЭ с микроядрами в костном мозге мышей как один из методов, рекомендуемых при оценке мутагенного действия веществ) (18) клетки костного мозга, полученные из бедренных костей, добавляли к инактивированной фетальной телячьей сыворотке («БиолоТ», Россия) и наносили на предметные стекла, далее препараты высушивали и окрашивали по Папенгейму. Препараты костного мозга изучали при увеличении ½1000 (микроскоп Микромед-3, «Микромед», Китай). Исследовали частоту ПХЭ с микроядрами на 1000 ПХЭ, всего изучали 2000 ПХЭ на животное. Также учитывали долю ПХЭ относительно нормохромных эритроцитов (НЭ) при общем подсчете 500 эритроцитов, которая может быть использована в качестве маркера токсичности исследуемых препаратов (17, 19).
Относительное число повреждений в мтДНК оценивали методом qPCR, который позволяет проводить специфичное для последовательности обнаружение и точную количественную оценку повреждений в длинных участках митохондриальных ДНК (20). Для этого выделяли тотальную ДНК из 25 мг гомогенизированной печени мышей при помощи набора ПРОБАГС (ООО «ДНК-технология», Россия), следуя инструкции производителя. Число повреждений мтДНК измеряли с помощью qPCR длинных фрагментов с использованием ПЦР смеси 5x qPCRmix-HS SYBR (ЗАО «Евроген», Россия) на амплификаторе DTlite 4 (ООО «ДНК-технология», Россия) (21). Режим амплификации был следующим: 3 мин при 95 ° С (общая денатурация); 30 с при 95 ° С (денатурация), 30 с при 57 ° С (отжиг праймеров), 30 с при 72 ° С (элонгация) (38 циклов); 5 с при 72 ° С (общая элонгация).
Расчет повреждений мтДНК проводили в участках, кодирующих 12S и 16S рРНК (12S-16S) и ген ND5 (ND5), которые проявляют чувствительность к повреждению, с использованием опубликованных ранее праймеров
|
(21): |
|||
|
Фрагмен |
Прямой праймер 5' ^ 3' |
| Обратный праймер 5' ^ 3' |
Длина фрагмента, п.н. |
|
12S-16S |
TAAATTTCGTGCCAGCCACC |
GTTGACACGTTTTACGCCGA (short) ATGCTACCTTTGCACGGTCA (long) |
72 1739 |
|
ND5 |
TCATTCTTCTACTATCCCCAATCC |
ATGTGGTGGTGTACAGTGGG (short) TGGTTTGGGAGATTGGTTGATG (long) |
81 1942 |
|
16S-Nd1 |
ACGAGGGTCCAACTGTCTCTTA |
AGCTCCATAGGGTCTTCTCGT |
97 |
|
Gapdh |
GGCTCCCTAGGCCCCTCCTG |
TCCCAACTCGGCCCCCAACA |
84 |
Число повреждений в мтДНК нормировали на 10000 п.н. по формуле: D tDNA = ^1-2-(Δlong – Δshort)^ × fragment length (bp) m 10000 , где DmtDNA — число повреждений мтДНК на 10000 п.н., Δlong — разница между Cq контрольных и опытных длинных фрагментов, Δshort — разница между Cq контрольных и опытных коротких фрагментов.
За контрольный показатель Cq принимали число повреждений в мтДНК мышей из I группы.
Число повреждений рассчитывали с помощью программного обес- печения Microsoft Excel. Для определения DmtDNA использовали по четыре мыши из группы (22).
Число копий мтДНК определяли с помощью qPCR, используя фрагмент мтДНК, кодирующий гены 16S и Nd1 (16S-Nd1) и ядерный ген gapdh в качестве референса (21, 22).
Нормализованный уровень мтДНК (NLmtDNA) относительно ядер-ной ДНК рассчитывали по формуле (22):
NLmtDNA = 2–ΔΔCq .
Суммарное относительное содержание внутриклеточных активных форм кислорода (АФК) определяли с помощью клеточного зонда — 2´,7´-дихлордигидрофлуоресцеиндиацетата («Sigma-Aldrich», США), который окисляясь внутри живых клеток, образует флуоресцирующую форму (DCF), детектируемую с помощью спетрофлуориметра RF-5301 («Shimadzu», Япония).
Суспензию клеток печени получали посредством гомогенизации 200 мг печени в 3 мл буферного раствора Хенкса (рН 7,4) с помощью ручного пестикового гомогенизатора (23). Концентрацию клеток в суспензии определяли с использованием камеры Горяева.
Содержание внутриклеточных АФК оценивали в суспензии клеток печени мышей (3½106 кл/мл). Для этого клетки инкубировали в темноте в течение 30 мин при 37 ° С с флуоресцентным зондом в конечной концентрации 10 мкмоль/л в растворе Хенкса (рН 7,4), дважды отмывали от непоглощенного флуоресцентного зонда центрифугированием (CM-50, «ELMI», Эстония) и определяли интенсивность флуоресценции образцов с помощью спектрофлуориметра при длине волны возбуждения X = 488 нм и испускания — X = 520 нм (24). Содержание внутриклеточных АФК выражали в относительных единицах (отн. ед.) интенсивности флуоресценции DCF (I dcf ).
Концентрацию МДА (мкмоль/г белка) определяли в гомогенате печени мышей с помощью спектрофотометра UV-1700 («Shimadzu», Япония) при X = 535 нм по окрашиванию раствора триметиновым комплексом, который образуется после взаимодействия МДА с тиобарбитуровой кислотой (25). Для расчета концентрации МДА количество белка в гомогенате печени определяли с помощью набора «Общий белок — Ольвекс» (ООО «Ольвекс Диагностикум», Россия).
Статистическую обработку данных проводили с помощью пакетов программы STATISTICA 10 («StatSoft, Inc.», США). Сравнение выборок осуществляли с использованием парного U-теста Мана-Уитни, поскольку исследуемые параметры не соответствовали нормальному распределению. Полученные результаты представляли как среднее арифметическое ( M) и стандартную ошибку среднего (±SEM).
Результаты. В результате проведенных исследований мы оценили частоту ПХЭ с микроядрами в костном мозге мышей (рис. 1).
Введение ГКСК не индуцировало статистически значимого изменения частоты ПХЭ с микроядрами относительно отрицательного контроля: значение показателя в I группе составило 0,47±0,140 %, во II группе — 0,41±0,080 % (рис. 2). Введение ММС в дозе 10 мг/кг вызывало значимое (p < 0,005) увеличение ПХЭ с микроядрами в костном мозге мышей в группах III, IV и V относительно отрицательного контроля: значения составляли соответственно 8,15±1,070, 10,12±1,200 и 11,23±1,000 %. При этом курсовое введение ГКСК (III группа) вызвало значимого (p < 0,05) снижения показателя на 27,4 % относительно мышей, которые получали только ММС (V группа). Вместе с тем в IV группе однократная совместная инъекция ГКСК и ММС не вызывала значимого снижения доли ПХЭ с микроядрами отно-1196
сительно положительного контроля. Таким образом, ГКСК при ее курсовом применении оказала антимутагенное действие на животных с цитогенетической нестабильностью, индуцированной высокими дозами ММС.
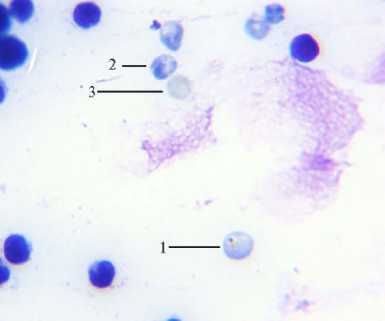
Рис. 1. Микрофотография препарата костного мозга белой беспородной мыши ( Mus albus offici-narum ) : 1 — полихроматофильный эритроцит с микроядром, 2 — полихроматофильный эритроцит, 3 — нормохромный эритроцит (микроскоп Микромед-3, «Микромед», Китай; окрашивание по Папенгейму, увеличение ½1000).
В костном мозге мышей из I группы ПХЭ составили 48,6±2,53 %. Применение ГКСК (II группа) не вызывало значимых изменений — 46,2±1,93 %. Введение ММС индуцировало значимое (p < 0,01) снижение доли ПХЭ: она составила соответственно 36,7±3,67, 31,5±5,25 и 30,9±5,55 % в III, IV и V группах. При этом курсовое или однократное применение ГКСК не приводило к значимым изменениям в содержании ПХЭ, что может свидетельствовать об отсутствии антитоксического действия ГКСК по отношению к пролиферирующим клеткам эритроидного ряда в костном мозге животных при индуцированной ММС цитотоксичности.
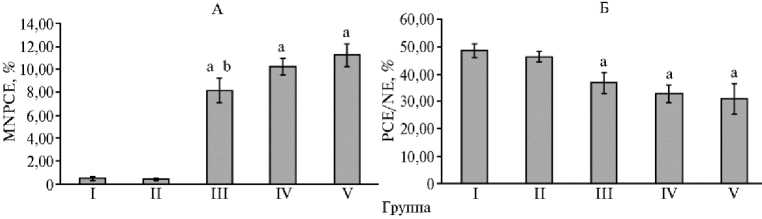
Рис. 2. Частота полихроматофильных эритроцитов с микроядрами (MNPCE) (А) и доля полихроматофильных эритроцитов относительно нормохромных эритроцитов (PCE/NE) (Б) в костном мозге белых беспородных мышей ( Mus albus officinarum ) под влиянием гидрофильной криофракции селезенки крупного рогатого скота ( n = 6, Ì ±SEM) . Описание групп см. в разделе «Методика».
a, b Статистически значимые (p < 0,05) отличия соответственно от I группы и от V группы.
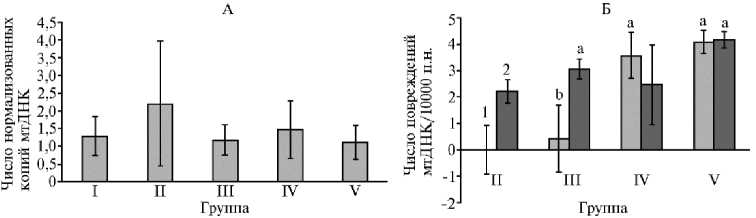
Рис. 3. Число нормализованных копий мтДНК (относительное число копий мтДНК, нормализованное по ядерному гену gapdh ) (А) и относительное число повреждений мтДНК (чисор повреждений в мтДНК относительно 10 000 п.н.) (Б) в печени белых беспородных мышей ( Mus albus officinarum ) под влиянием гидрофильной криофракции селезенки крупного рогатого скота: 1 — участок мтДНК, содержащий гены 12S-16S, 2 — участок мтДНК, содержащий ген Nd5 ( n = 4, Ì ±SEM) . Описание групп см. в разделе «Методика».
a, b Статистически значимые (p < 0,05) отличия соответственно от I группы и от V группы.
Далее мы определили влияние ГКСК на митохондриальный биогенез в печени мышей, который можно оценить по числу копий мтДНК в образце (рис. 3, А) (26). Ранее мы показали, что введение ММС в дозе 10 мг/кг сохраняло митохондриальный биогенез в печени мышей, значения которого не отличались от показателей в отрицательном контроле (27). В настоящем исследовании введение ГКСК отдельно или совместно с ММС не приводило к статистически значимому изменению числа копий мтДНК. Таким образом, не наблюдалось изменения митохондриального биогенеза во всех исследованных группах.
Помимо этого, было определено число повреждений мтДНК в участках 12S-16S и ND5 (см. рис. 3, Б). Введение ГКСК не вызывало изменения относительного числа повреждений мтДНК как в 12S-16S, так и в ND5 фрагментах — соответственно 0,0±0,92 и 2,2±0,45 повреждений. При этом внутрибрюшинная инъекция ММС (группа V) индуцировала увеличение числа повреждений мтДНК в 4 раза (p < 0,05) в обоих фрагментах мтДНК. Так, в 12S-16S число повреждений составило 4,1±0,44, в ND5 — 4,2±0,30. Курсовое применение ГКСК перед инъекцией ММС индуцировало статистически значимое (p < 0,05) снижение числа повреждений мтДНК на 89,7 % во фрагменте 12S-16S до 0,4±1,27. В то же время число повреждений мтДНК в ND5 составило 3,1±0,38, что было в 3 раза выше (p < 0,05) показателя отрицательного контроля и не имело значимых отличий от числа повреждений мтДНК мышей в группе положительного контроля. При этом однократное введение ГКСК в IV группе не вызывало статистически значимого снижения числа повреждений мтДНК, индуцированных применением ММС. Так, во фрагменте 12S-16S оно составило 3,6±0,85, а в ND5 — 2,5±1,52. Таким образом, курсовое введение ГКСК мышам индуцировало в клетках печени снижение числа повреждений мтДНК, вызванных ММС.
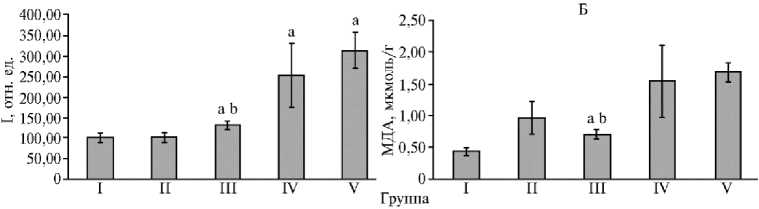
Рис. 4. Относительное содержание внутриклеточных АФК (I — интенсивность флуоресценции DCF при λ = 488 нм) (А) и концентрация малонового диальдегида (МДА) (Б) в клетках печени белых беспородных мышей ( Mus albus officinarum ) под влиянием гидрофильной криофракции селезенки крупного рогатого скота ( n = 6, Ì ±SEM) . Описание групп см. в разделе «Методика». a, b Статистически значимые (p < 0,005) отличия соответственно от I группы и от V группы.
Поскольку ММС способен вызывать повреждение ДНК не только посредством образования аддуктов с ДНК, но и через индукцию окислительного стресса в организме (28), мы оценили относительное содержание внутриклеточных АФК в клетках печени мышей (рис. 4, А). В I группе Idcf составляла 100,3±11,02 отн. ед., и введение ГКСК (II группа) не приводило к изменению содержания внутриклеточных АФК. В то же время инъекция ММС вызывала значимое (p < 0,05 для III группы и p < 0,005 для IV и V групп) увеличение Idcf относительно I группы. Так, у мышей в III, IV и V группах величина Idcf составила соответственно 131,7±9,84; 253,8±78,69 и 314,0±44,21 отн. ед. При этом в III группе мы обнаружили значимое (p < 0,005) снижение Idcf на 58,1 % относительно положительного контроля. Следовательно, курсовое применение ГКСК перед введением ММС вызывало уменьшение содержания внутриклеточных АФК в клетках печени мышей, что может быть свидетельством снижения окислительного стресса в организме мышей.
Другим маркером активности окислительных процессов в организме животных может служить изменение концентрации МДА (25), поэтому мы определили содержание МДА в печени мышей исследуемых групп (см. рис. 4, Б). В I группе этот показатель составил 0,4±0,06 мкмоль/г. Во II группе показатель незначимо возрастал до 1,0±0,26 мкмоль/г. Количество МДА в печени мышей, получивших инъекцию ММС, статистически значимо увеличивалось в III группе (p < 0,05) и в IV-V группах (p < 0,005). Содержание МДА в группе положительного контроля составило 1,7±0,15 мкмоль/г. Трехкратное введение ГКСК в III группе приводило к достоверному (p < 0,005) снижению показателя на 58,6 % (0,7±0,08 мкмоль/г) относительно положительного контроля. Однократное применение ГКСК вместе с ММС (IV группа) не вызывало снижения содержания МДА в печени мышей, которое составило 1,5±0,56 мкмоль/г.
Таким образом, при многократном введении ГКСК мышам с индуцированным ММС свободнорадикальным окислением наблюдалось снижение окислительного стресса в печени, что согласуется с данными по снижению содержания внутриклеточных АФК в клетках печени мышей.
Мы установили отсутствие мутагенного действия ГКСК на клетки костного мозга мышей, определяемого по частоте ПХЭ с микроядрами, вместе с сохранением целостности мтДНК печени животных. Помимо этого, не наблюдалась стимуляция свободнорадикального окисления в клетках печени у мышей из II группы. Представленные данные согласуются с материалами публикаций, свидетельствующими об отсутствии мутагенного действия, а также снижении окислительного стресса в доклинических исследованиях безопасности некоторых тканевых препаратов, основанных на экстрактах плаценты свиньи или лейкоцитов быка (29, 30).
Курсовое введение ГКСК в дозе 0,5 мл/кг мышам из III группы приводило к снижению частоты ПХЭ с микроядрами у животных, получивших высокую дозу ММС. Эти данные могут свидетельствовать об антимутаген-ном действии фармакологической субстанции ГКСК, что соответствует полученным ранее данным о снижении частоты ПХЭ с микроядрами после применения препарата кластогена — циклофосфамида на мышах, которым вводили препарат аминоселетон, содержащий гидрофильную фракцию селезенки КРС (31). В других исследованиях также было обнаружено уменьшение частоты эритроцитов с микроядрами после использования экстракта селезенки КРС на мышах, подвергнутых радиационному облучению, что подтверждает полученные нами данные (32).
Причиной образования микроядер становится нарушение расхождения хромосом или их фрагментов в дочерние клетки в процессе деления (33). В свою очередь, кластогенное действие веществ может проявляться посредством прямого разрушения цепочки ДНК, образования нуклеотидных сшивок или модификации нуклеотидов, что в результате действия механизмов репарации приводит к формированию фрагментов хромосом (34). Антибиотик-алкилятор ДНК ММС может выступать индуктором образования разрывов в ДНК, он способен оказывать влияние как на ядерную, так и на митохондриальную ДНК (35, 36). Поэтому обнаруженное нами снижение числа повреждений мтДНК во фрагменте 12S-16S у мышей, получивших трехкратную инъекцию ГКСК перед введением ММС (III группа), указывает на ДНК-протекторное действие ГКСК, которое, по-видимому, обусловливает антимутагенный эффект исследуемой фармакологической субстанции. В нескольких работах было показано уменьшение индуцированного радиацией повреждения ДНК в костном мозге, печени и других органах мышей под действием экстракта человеческой плаценты, что подтверждает полученные нами данные (37, 38).
Помимо этого, ММС способен вызывать повреждение ДНК не только в реакциях прямого алкилирования, но и через индукцию свободнорадикального окисления в организме после метаболической активации антибиотика in vivo (39). В связи с тем, что в митохондриях нет сложных систем репарации ДНК, присущих ядру эукариотической клетки, мтДНК проявляет высокую чувствительность к повреждению со стороны АФК и других свободных радикалов (26, 40). То есть выявленное нами увеличение числа повреждений мтДНК в печени мышей после введения ММС частично может быть обусловлено повышенной генерацией АФК в клетках печени, что подтверждается данными об увеличении I dcf и концентрации МДА в печени мышей. Вместе с тем снижение этих параметров у мышей из III группы относительно положительного контроля может свидетельствовать об уменьшении свободнорадикального стресса в организме мышей с ММС под действием ГКСК, которое, вероятно, проявляется за счет антиоксидантного действия исследуемой фармакологической субстанции. Действительно, ряд исследований тканевых препаратов, в том числе содержащих ГКСК, демонстрируют снижение процессов свободнорадикального окисления и стимуляцию различных систем антиоксидантной защиты (31, 41). Таким образом, один из механизмов обнаруженного нами антимутагенного и ДНК-протекторного действия ГКСК может проявляться через снижение окислительного стресса, вероятно, связанного с активизацией систем антиоксидантной защиты.
Итак, гидрофильная криофракция селезенки крупного рогатого скота не проявляла собственного мутагенного и ДНК-повреждающего действия в опытах на белых беспородных мышах. Введение исследуемой фармакологической субстанции сохраняло процессы свободнорадикального окисления сходными с таковыми у здоровых мышей из группы отрицательного контроля. Курсовое введение гидрофильной криофракции селезенки крупного рогатого с кота перед индукцией цитогенетической нестабильности, окислительного стресса и повреждения ДНК клеток с помощью митомицина С вызывало значимое снижение интенсивности этих процессов, оцениваемых по частоте полихроматофильных эритроцитов с микроядрами в костном мозге (на 27,4 %), относительному содержанию внутриклеточных активных форм кислорода (на 58,1 %), концентрации малоновыого диальдегида (на 58,6 %) и числк повреждений в мтДНК клеток печени мышей (на 89,7 % во фрагменте 12S-16S) (p < 0,05). Эти данные свидетельствуют о наличии у гидрофильной криофракции селезенки крупного рогатого скота антимутагенных, ДНК-протекторных свойств, которые обусловлены ее антиоксидантным действием, вероятно, за счет активации систем антиоксидантной защиты.


