Исследование бактериостатических свойств хлорсодержащего препарата для свеклосахарного производства
Автор: Кульнева Н.Г., Гойкалова О.Ю., Шматова А.И.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 4 (62), 2014 года.
Бесплатный доступ
Одной из важнейших причин снижения качества сахара-песка является бактериальная обсемененность сахарной свеклы. Это связано с тем, что свеклосахарное производство является хорошим объектом для развития разных групп микроорганизмов. Основными источниками инфицирования продуктов сахарного производства могут быть почва, вода, воздух, тара, упаковочные материалы, транспортные средства, спецодежда, инвентарь Чем выше обсемененность свеклы микроорганизмами, тем больше они разлагают сахарозы и выделяют побочных продуктов метаболизма. В связи с этим существует необходимость снижения негативного воздействия различных групп микроорганизмов и уменьшения потерь сахарозы от разложения. В соответствии с изложенной проблемой были проведены исследования по определению бактериостатических свойств хлорсодержащего препарата для сахарного производства. В качестве объекта исследования использовали культуральную жидкость, обсемененную чистой культурой Leuconostoc mesenteroides и обработанную реагентом. В экспериментах определяли накопление биомассы L. mesenteroides нефелометрическим методом путем измерения оптической плотности суспензии бактерий. Установлено, что через 24 ч культивирования бактерий уровень оптической плотности среды в контроле и активная кислотность были значительно выше по сравнению с образцом, обработанным бактерицидным препаратом. Численность микроорганизмов в питательной среде определяли методом Виноградского-Шульгиной-Брида. По результатам исследования в контроле содержание клеток 1,7×10 16, в опыте с введением хлорсодержащего препарата 5,8×10 14. Результаты эксперимента свидетельствуют, что исследуемый хлорсодержащий препарат обладает бактериостатическим действием в отношении грамположительных сапрофитных кокков L. mesenteroides и может быть рекомендован к использованию в условиях свеклосахарного производства.
Свеклосахарное производство, хлорсодержащий препарат, бактериостатическое действие
Короткий адрес: https://sciup.org/14040315
IDR: 14040315 | УДК: 579.678
Текст научной статьи Исследование бактериостатических свойств хлорсодержащего препарата для свеклосахарного производства
Для повышения сохранности сахарной свеклы, роста хозяйственной и экономической эффективности ее переработки большое внимание уделяется разработке новых способов обработки свекловичной стружки с применением бактерицидных препаратов широкого спектра действия.
Нами был изучен хлорсодержащий препарат, обладающий фунгицидными, вируле-цидными и спороцидными свойствами [1].
Целью работы явилось исследование бактериостатического действия хлорсодержащего препарата, т.к. конкретные данные о его влиянии на рост микроорганизмов отсутствуют. Для достижения поставленной цели проводили ряд экспериментов, связанных с культивированием микроорганизмов на среде, содержащей исследуемый препарат.
Объектом исследования служила чистая культура бактерий Leuconostoc mesenteroides штамм В-4177, полученная из Всероссийской коллекции промышленных микроорганизмов (ВКПМ, г. Москва). Физиологически активную культуру L. mesenteroides вносили в свежую селективную питательную среду, рекомендованную ВКПМ, инкубировали в термостате при 37 ° С в анаэробных условиях в течение 5 суток. Хлорсодержащий препарат вносили в питательную среду (MRS (г/дм3): Бактопептон – 10,0; мясной экстракт – 10,0; дрожжевой экстракт – 5,0; глюкоза – 20,0; твин 80 – 1,0; аммоний лимоннокислый – 2,0; натрий уксуснокислый – 5,0; MgSO 4 x7H 2 O – 0,1; MnSO 4 x5H 2 O – 0,05; Na 2 HPO 4 – 2,0; агар – 20,0) в количестве 2 см3 при рН 6,5 и температуре 30 0С. В качестве контроля использовали питательную среду без добавления препарата [1].
Накопление биомассы Leuconostoc mes-enteroides контролировали нефелометрическим методом путем измерения оптической плотности питательной среды на разных этапах процесса культивирования. Рабочая длина волны была выбрана в соответствии с положениями, что для измерения светорассеяния выбирается светофильтр, обеспечивающий максимум пропускания света данной суспензии. В нашем случае рабочая длина волны – 560 нм [3]. Данный метод основан на том, что микроорганизмы в большинстве случаев не окрашены и почти прозрачны, поэтому суспензия клеток поглощает свет в видимой области спектра незначительно. Уменьшение интенсивности света после прохождения через суспензию связано, главным образом, с его рассеянием. В определенных пределах количество света, рассеивае- 188
мого суспензией микроорганизмов, пропорционально содержанию клеток [2].
Количественный анализ накопления биомассы бактерий проводили на фиксированных мазках по методу Виноградского-Шульгиной-Брида [4]. Метод предназначен для определения численности микроорганизмов в различных естественных субстратах. Отбор суспензии был произведен по истечение 24 ч – время, когда было достигнуто максимальное количество клеток в питательной среде. Для подсчета клеток брали строго определенное количество исследуемой суспензии, наносили микропипеткой на хорошо обезжиренное сухое предметное стекло. К капле суспензии добавляли стерильный водный раствор агар-агара с массовой долей 0,03 %, быстро перемешивали стерильной бактериологической петлей и равномерно распределяли по отмеченной на бумаге площади. Мазок высушивали на воздухе, фиксировали 20-30 мин 96 % спиртовым раствором и окрашивали красителем в течение определенного времени. За- тем препарат осторожно промывали в кристаллизаторе водой. Подсчет клеток микроорганизмов проводили с иммерсионным объективом и рассчитывали по формуле [3]:
x ■ 4 - 10 8 ■ K 0,05 ■ S
где х - число клеток в поле зрения; К – степень разведения суспензии; S - площадь поля зрения, S = 0,02мм2; 0,05 - объем суспензии, см3;
4 - 10 8 - площадь мазка, мкм2.
Еще одним параметром, косвенно характеризующим накопление биомассы, является активная кислотность суспензии, которую определяли по изменению рН среды через каждые 6 ч культивирования. Как известно, по изменению рН среды можно контролировать интенсивность метаболических процессов микроорганизмов, что служит показателем трансформации сахаров в органические кислоты как конечные продукты метаболизма. В частности, Leuconostoc mesenteroides для синтеза декстрана выделяет ферменты, расщепляющие сахарозу.
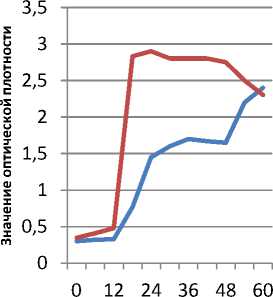
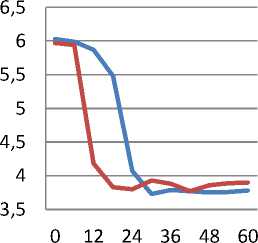
При изучении динамики роста и кисло-тообразования бактериальной культуры исследуемые показатели определяли в динамике через каждые 6 ч в течение 5 суток роста. Результаты эксперимента приведены графически на рисунках 1, 2.
с опт
; контроль продолжительность процесса, ч
Рисунок 1. Динамика оптической плотности суспензии микроорганизмов
^^^^^^опт г контроль
Продолжительность процесса,ч
Рисунок 2. Динамика рН среды при культивировании Leuconostoc mesenteroides
Анализ полученных результатов показал, что изменение оптической плотности в опыте с введением хлорсодержащего препарата во времени протекает с меньшей скоростью по сравнению с контролем. Так, к 24 ч культивирования бактерий уровень оптической плотности среды в контроле был в 1,8 раза выше по сравнению с опытом. Так же способность бактериальной культуры к кислотообразованию при отсутствии препарата в среде значительно выше. Это свидетельствует о снижении скорости роста и физиологических возможностей бактериальной культуры, выращенной с добавлением хлорсодержащего препарата.
Полученные данные хорошо коррелируют с численностью бактериальных клеток в опытном и контрольном вариантах. Так, в кон- трольном образце содержание клеток составило 1,7⋅1016, в опыте с введением хлорсодержащего препарата в среду культивирования это значение на два порядка ниже 5,8⋅1014. На рисунке 3 (а, б) представлены фотографии контрольного и опытного образцов соответственно.
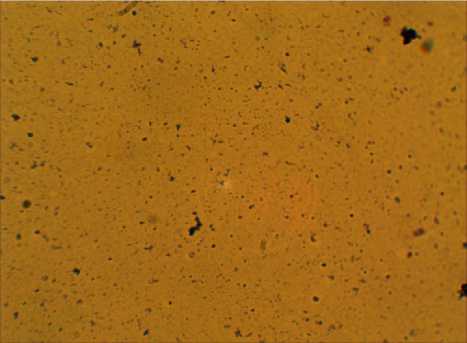
а)
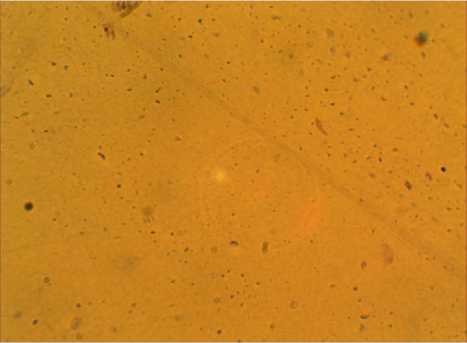
б)
Рисунок 3. Интенсивность роста бактерий Leuco-nostoc mesenteroides: а – контроль, б – опыт (с введением хлорсодержащего препарата)
Исходя из результатов эксперимента можно сделать вывод, что хлорсодержащий препарат обладает бактериостатическим действием в отношении грамположительных сапрофитных кокков Leuconostoc mesenteroides и может быть рекомендован к использованию в условиях свеклосахарного производства.
Вестник ВГУИТ, №4, 2014


