Исследование биологической совместимости биопластического материала «Гиаматрикс» на культуре дермальных фибробластов
Автор: Гильмутдинова Ильмира Ринатовна, Россинская Виктория Викторовна, Болтовская Виолетта Викторовна, Кулагина Лариса Николаевна
Рубрика: Фундаментальная медицина
Статья в выпуске: 2-2 т.17, 2015 года.
Бесплатный доступ
В данной статье представлены результаты исследования биосовместимости биопластического материала «Гиаматрикс» in vitro на культуре дермальных фибробластов человека.
Эксперименты in vitro, культура клеток
Короткий адрес: https://sciup.org/148102259
IDR: 148102259 | УДК: 57.085.23
Текст научной статьи Исследование биологической совместимости биопластического материала «Гиаматрикс» на культуре дермальных фибробластов
В настоящее время имеется целый ряд искусственных и биогенной природы материалов, применяемых в современной комбустиологии для лечения поверхностных ран и ожогов [1]. Ведутся разработки по созданию биодеградируемых матриксов для решения задач тканевой скаффолд-инженерии, в частности, для создания протезов кожи для лечения поверхностных ожогов и ран [2; 3]. Наиболее перспективным направлением считается использование для лечения ожоговых ран таких биополимеров как коллаген, желатин, гиалуроновая кислота и др. [4].
В последние годы уделяется большое внимание именно гиалуроновой кислоте (ГК), которая представляет собой естественный компонент межклеточного вещества различных тканей.
Матриксы для использования в регенеративной медицине и создания биоискусственных тканей должны характеризоваться:
-
- многофункциональностью (одновременно выполнять роль каркаса, подложки и питательной среды для клеточных культур);
-
- механической прочностью и эластичностью, достаточной для хирургических манипуляций;
-
- биосовместимостью на белковом и клеточном уровнях;
-
- способностью стимулировать пролиферацию и дифференциацию клеток;
-
- пористостью, обеспечивая процессы неоваскуля ризации;
-
- возможностью стерилизации стандартными
способами без изменения медико-технических свойств [5].
Целью нашего исследования явилась оценка цитотоксичности биопластического материала «Гиаматрикс» и его влияния на функциональную и пролиферативную активность дермальных фибробластов человека. Фибробласты играют одну из главных ролей в регенерации кожи. Они представляют собой наиболее многочисленную популяцию клеток дермы, функция которых состоит в построении межклеточного вещества соединительной ткани.
МАТЕРИАЛЫ И МЕТОДЫ
Для тестирования на биосовместимость были представлены стерильные образцы биопласти-ческого материала «Гиаматрикс», полученного с помощью метода фотохимического наноструктурирования гидроколлоида ГК (патент РФ № 2367476 от 21.03.2008) в виде пленок толщиной 1 мм. В качестве тест-системы была использована культура дермальных фибробластов человека 7 пассажа, выращенных из кожи доноров.
Исследование осуществляли методом прямого контакта в культуральных чашках Петри диаметром 3,5 см («Orange Sciеntific», Бельгия) в условиях СО2-инкубатора (Sanyo MCO-18AC, Япония) при t 37ºС, содержании СО2 5% и постоянной влажности в полной ростовой среде (среда 199 с 10% эмбриональной телячьей сыворотки). В работе использованы реактивы ООО «Биолот», Россия. Все манипуляции с культурой проводили в ламинарном боксе БАВп-01 «Ламинар С» (ЗАО «Ламинарные системы», Миасс, РФ).
Для оценки цитотоксичности материала (1 серия) применяли ЛДГ-тест. Фибробласты снимали со дна культурального флакона стандартным способом (при помощи 0,25% раствора трипсина и 0,02% раствора Версена) и пересевали в культуральный 24-луночный планшет в дозе 30 тыс. клеток на лунку. Через 24 часа на сформированный монослой помещали образцы материала размером 3х3 мм. Фибробласты в присутствии материала культивировали 48 часов. Активность ЛДГ определяли в культуральной среде и в клетках монослоя по убыли NADH в ходе реакции превращения пирувата в лактат.
Количество поврежденных клеток выражали как процентное отношение активности ЛДГ в среде к суммарной активности ЛДГ в лизате и в ростовой среде.
Для оценки пролиферативной активности фибробластов в присутствии биоматериала «Ги-аматрикс» (2 серия) клетки высевали в культуральные чашки Петри диаметром 3,5 см («Orаnge Sciеntific», Бельгия). Посевная доза составляла 5 тыс. клеток/см2 (1х104). Через 24 ч на образовавшийся монослой фибробластов помещали образцы материала размером 5x5 мм.
С целью выяснения влияния биоматериала «Гиаматрикс» на адгезивную способность дермальных фибробластов (3 серия), на дно чашек сначала помещали образцы материала, а затем высевали клетки. Посевная доза составляла 10 тыс. клеток/см2 (1х104).
Контролем во всех сериях служили чашки или лунки с культурой фибробластов без образцов материала, которые пассировали и наблюдали одновременно с экспериментальными. Продолжительность наблюдения во 2 и 3 сериях – 7 суток.
Нативные культуры изучали, фотографировали и морфометрировали с помощью инвертированного микроскопа «Биолам-П2-1» при увеличении 63 и 100 (окуляры – 6,3 и 10, объектив – 10). Оценивали целостность монослоя, наличие слущенных клеток в культуральной жидкости, форму и размеры клеток, структуру клеток. Плотность клеток монослоя на единицу площади определяли с помощью окулярной сетки Автандилова, а количество слущенных клеток в культуральной жидкости и соотношение живых и мертвых клеток (при пересеве) – с помощью камеры Горяева. На основании данных о плотности монослоя рассчитывали индекс адгезии, время удвоения культур, индекс пролиферации по формулам:
Время удвоения культуры
TD=t lg2/lg(Nt/N0), где t – время инкубации (ч);
-
N0– начальная доза клеток на пластике;
Nt– количество клеток выросших за время t;
Количество удвоений
Кол-во удвоений = (lgNt - lgN0) / lg2
где Nt– количество клеток, выросших за время t;
-
N0– начальная доза клеток на пластике;
Индекс адгезии
Считают через 24 ч после посадки клеток ИА = N2·100 / N1, где N1 – посевная доза;
N2 – кол-во клеток на пластике через 24 ч после посева.
По окончании каждого срока эксперимента готовили гистологические препараты клеточных культур. Препараты, окрашенные по Романовскому, гематоксилином Майера, трипановым синим изучали и фотографировали с помощью автоматизированной аналитической системы, включающей микроскоп «Olympus ВX 41», цифровую фотокамеру Prog RCF системный блок на базе процессора Intel Pentium 4. Для анализа изображений использовали программу «Видеотест Морфология 5.2». В окрашенных препаратах также считали количество клеток на единицу площади. Всего изучено 64 препарата.
Статистическая обработка данных выполнена с помощью пакета прикладных программ Statistica 10.0 с учетом современных требований к предъявлению результатов статистического анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изучение пролиферативной активности дермальных фибробластов при культивировании их в присутствии биоматериала «Гиаматрикс»
Через 1 сутки после помещения на монослой образца материала каких-либо изменений пролиферативной активности дермальных фибробластов по сравнению с контролем не наблюдалось. Клетки располагались по дну культурального пластика неравномерно. Большинство клеток имело характерную веретенообразную форму. Вместе с тем дермальные фибробласты четко контурировали, крупные ядра были расположены ближе к периферии, имели овальную форму и ровные границы оболочки (рис. 1).

Рис 1 . Опыт. Культура фибробластов человека в присутствии материала «Гиаматрикс».
1 сутки эксперимента.
Клетки в непосредственной близости от образца. Нативный препарат.
Инвертированный микроскоп.
Увеличение 100
В течение 2 и 3 суток эксперимента наблюдалось увеличение количества клеток, локализующихся вокруг образца. Фибробласты располагались плотно друг к другу, формируя тяжи. Отмечалось большое количество делящихся клеток. Однако, по сравнению с контролем их пролиферативная способность была снижена, о чем свидетельствовала меньшая площадь монослоя в присутствии биоматериала. Морфологически клетки не отличались от контрольной группы. Каждая клетка имела по два-четыре отростка разной длины, с помощью которых соседние клетки соединялись между собой, в результате чего формировался равномерный монослой. На периферии отмечались единичные клетки с пикнотичными ядрами и вакуолизированной цитоплазмой. Однако в последующие сроки активная пролиферация фибробластов как вблизи образца, так и в отдаленных от него зонах восстанавливалась, за счет чего через 5 суток индекс пролиферации был выше, а время удвоения – короче, чем в контроле. Такое же соотношение этих показателей отмечалось по окончании эксперимента, в результате чего плотность монослоя через 7 суток в контроле и опыте была практически одинаковой (рис. 2, 3).
Количество поврежденных фибробластов в монослое в течение первых трех суток эксперимента было несколько больше в опытной серии, что можно связать с незначительным повреждающим действием образца на прикрепленные к пластику клетки.
Морфофункциональные характеристики культуры фибробластов при культивировании в присутствии биоматериала «Гиаматрикс» представлены в табл. 1.
Результаты ЛДГ-теста показали, что доля поврежденных клеток в присутствии материала не отличается от таковой в контрольной культуре (7,22% и 7,47%), что говорит об отсутствии цитотоксичности «Гиаматрикса».
БИОСОВМЕСТИМОСТЬ МАТЕРИАЛА «ГИАМАТРИКС» ПРИ ОДНОВРЕМЕННОМ КУЛЬТИВИРОВАНИИ ФИБРОБЛАСТОВ
Через сутки после постановки эксперимента фибробласты как в контроле, так и в опыте равномерно были распределены по дну культуральных чашек. Индекс пролиферации (90% и 90%) и соотношение живых и поврежденных клеток также были одинаковы. Клетки имели типичную для фибробластов вытянутую веретенообразную, продолговатую и звездчатую форму с гомогенной цитоплазмой и ядром овальной формы. В ядре хроматин распределялся диффузно. Данная морфология характерна для молодых активных фибробластов. Все это свидетельствует об отсутствии изменений адгезивной способности дермальных фибробластов в присутствии биоматериала «Гиаматрикс».
К 3 суткам при наблюдении в инвертируемый микроскоп количество клеток увеличивалось, однако плотность монослоя была меньше, чем в контроле. На поверхности материала было заметно незначительное количество прикрепленных к нему клеток. В непосредственной близости от Гиаматрикса отмечалось наличие делящихся фибробластов. Основное количество фибробластов локализовалось ближе к материалу. По периферии плотность клеток была меньше, наблюдались единичные клетки с нарушением структурной организации (цитоплазматические включения в виде вакуолей, пикноз ядра).
В более поздние сроки рост культуры фибробластов в присутствии биоматериала «Гиама-трикс» подчинялся той же закономерности, что и при помещении материала на монослой.
Морфометрические показатели морфофункциональной активности дермальных фибробластов представлены в табл. 2.

Рис. 2. Контроль. Культура фибробластов человека.
7 суток эксперимента.
Клетки веретенообразной формы с отростками разной длины. Окраска гематоксилином и суданом IV.
Увеличение 200
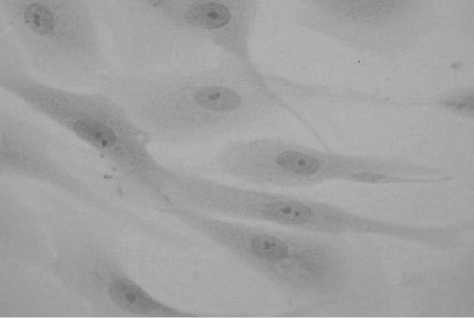
Рис. 3. Опыт. Культура фибробластов человека в присутствии материала «Гиаматрикс». 7 суток эксперимента.
Клетки сохраняют обычную структуру. Окраска гематоксилином и суданом IV.
Увеличение 400
Таблица 1 . Характеристики культур фибробластов при помещении. Гиаматрикса на монослой
|
Показатели |
Исходные данные |
1 сут |
3 сут |
5 сут |
7 сут |
|||||
|
M±m |
M±m |
M±m |
M±m |
M±m |
||||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
|
|
Плотность монослоя, кл/0,1 мм 2 |
4,7± 0,4 |
4,7± 0,4 |
9,1±1,5 |
9,2± 2,0 |
36,5± 6,1 |
29,8± 4,5** |
151,7± 19,6 |
136,6± 7,4** |
352± 6,5 |
387,8± 6,2 |
|
Индекс пролиферации, отн. ед. |
- |
- |
1,8± 0,15 |
1,76± 0,2 |
2,1± 0,3 |
1,6± 0,5* |
2,1±0,2 |
2,3± 0,2* |
1,1± 0,1 |
2,9± 0,1** |
|
Время удвоения, ч |
- |
- |
29,72± 4,6 |
29,24± 4,7 |
22,1± 4,5 |
28,6± 2,6*** |
23,4± 1,6 |
21,8± 1,5** |
35,1± 0,2 |
28,8± 2,6 |
|
Живые // поврежденные клетки, % |
- |
- |
91,4± 0,5 // 8,6± 0,5 |
81,6± 1,0 // 18,4± 1,2 |
95,0± 0,8 // 5,0± 0,8 |
89,0± 0,8 // 11,0± 0,8 |
94,6± 0,8 // 5,4±0,8 |
92,2± 1,4 // 7,8± 1,4 |
91,9± 0,8 // 8,1± 0,9 |
89,9± 1,0 // 10,1± 1,0 |
Примечание: различия достоверны по сравнению с соответствующими значениями в контрольной группе при: * - р<0,05; ** - р<0,01; *** - р<0,001
Таблица 2. Характеристики культур фибробластов при одновременном культивировании
|
Показатели |
1 сут |
3 сут |
5 сут |
7 сут |
||||
|
M±m |
M±m |
M±m |
M±m |
|||||
|
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
Контроль |
Опыт |
|
|
Плотность монослоя, кл/0,1 мм 2 |
9,0 ± 1,5 |
9,1± 1,35 |
38,0± 0,4 |
26,8± 0,8*** |
150± 0,4 |
126,6± *1*,0* |
352± 6,5 |
344,6± *4*,6* |
|
Индекс пролиферации, отн.ед. |
- |
- |
2,1± 0,3 |
1,5±0,1** |
2,1±0,2 |
2,4±0,1 |
1,13±0,1 |
1,4±0,05 |
|
Время удвоения, ч |
- |
- |
22,1± 4,5 |
28,6± 1,4*** |
23,4±1,6 |
21,2±0,4 |
35,1±0,2 |
33,3±0,4 |
|
Живые // поврежденные клетки, % |
91,4± 0,5 // 8,6±0,5 |
90,6± 0,5 // 9,4±0,5 |
95,0± 0,8 // 5,0±0,8 |
89,6± 0,5 // 10,4± 0,5 |
94,6±0,8 // 5,4±0,8 |
92,9±0,7 // 7,1±0,7 |
91,9±0,8 // 8,1±0,9 |
86,5 ±0,5 // 13,5± 0,5 |
Примечание: *** – различия достоверны (при p<0,001) относительно соответствующего значения в контрольной группе.
ЗАКЛЮЧЕНИЕ
Результаты проведенного нами с помощью морфологических и биохимических методов исследования биосовместимости биопластического материала «Гиаматрикс» in vitro показали, что данный материал не оказывает цитотоксического действия на культуру дермальных фибробластов человека и не влияет на адгезивную способность этих клеток. Вместе с тем при культивировании дермальных фибробластов в присутствии образ- цов «Гиаматрикса» происходит волнообразное изменение пролиферативной активности клеток тест-системы, которое выражается в уменьшении этого показателя в ранние сроки эксперимента (до конца третьих суток) и в последующем нарастании его вплоть до окончания исследования. Все это свидетельствует о биосовместимости данного материала и является предпосылкой к использованию его для лечения ожогов и впоследствии – к разработке тканеинженерных конструкций на его основе для использования в клинической практике.
Список литературы Исследование биологической совместимости биопластического материала «Гиаматрикс» на культуре дермальных фибробластов
- Аганина Е.Н., Ведерникова О.Л. Новые технологии местного лечения ожоговых ран у детей//Вопросы травматологии и ортопедии. 2012. № 2 (3). С.28-41.
- Бодун Р.Д., Островский Н.В., Шиповская А.Б., Чернова Р.К., Белянина И.Б., Моисеенко Д.С. На пути к созданию живого дермального эквивалента//Бюллетень Волгоградского научного центра РАМН. 2008. № 1. С.37-38.
- Адельшин А.И. Нативные матриксы для создания живого эквивалента кожи//Морфологические ведомости. 2003. № 3. С. 4-8.
- Севастьянов В.И. Биоматериалы, системы доставки лекарственных веществ и биоинженерия//Вестник травматологии и искусственных органов. 2009. Т IX. № 3. С. 14-24.
- Рахматуллин Р.Р. Биопластический материал на основе гидроколлоида гиалуроновой кислоты и пептидного комплекса для восстановительной и реконструктивной хирургии: дис. докт. биол. наук. М., 2014.


