Исследование биосовместимости пористых 3D-TiNi имплантатов в условиях in vivo
Автор: Марченко Е. С., Гордиенко И. И., Козулин А. А., Байгонакова Г. А., Борисов С. А., Гарин А. С., Черный С. П., Чойнзонов Е. Л., Кульбакин Д. Е.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Введение. Пористые сплавы никелида титана (TiNi), благодаря своим уникальным свойствам сверхэластичности и биосовместимости, находят широкое применение в медицине и используются в качестве костнозамещающих имплантатов, однако длительное ручное изготовление и невозможность создания точной геометрии существенно ограничивают их клиническое применение. В реконструктивной хирургии при замещении костных дефектов необходимы биосовместимые эндопротезы индивидуальной формы и сложной геометрии. Применение пористых 3D-TiNi имплантатов может стать решением многих проблем в области травматологии и костной онкологии.Цель: оценка возможности применения пористых 3D-TiNi имплантатов в остеопластических операциях на основе исследования структуры и биосовместимости материала в условиях in vivo.Материал и методы. Пористые образцы в виде конусов и индивидуального имплантата для челюстно-лицевой хирургии были получены методом селективного лазерного плавления из порошка TiNi. Для печати индивидуального имплантата для челюстно-лицевой хирургии использовали персональные данные пациента НИИ онкологии. Макроструктуру, элементный и фазовый состав пористых образцов никелида титана исследовали методами растровой микроскопии и рентгеноструктурного анализа. Оценку биосовместимости пористых образцов в виде конусов проводили в условиях in vivo с использованием лабораторных морских свинок, состояние которых анализировали с помощью КТ-сканирования.Результаты. Структурные исследования пористых образцов TiNi показали, что методом селективного лазерного плавления можно получить сквозную пористую структуру с прочными контактными перемычками между частицами порошка трехфазного состава. В результате испытаний in vivo имплантатов в виде конусов не наблюдалось местных воспалительных изменений, отторжения и деформаций осей задних конечностей лабораторных животных. Показана принципиальная возможность изготовления индивидуального имплантата сложной геометрии из порошка TiNi методом селективного лазерного плавления, по данным МСКТ больного.Выводы. Пористые 3D-TiNi имплантаты, полученные методом селективного лазерного плавления, показали высокую биосовместимость в условиях in vivo. Экспериментальное исследование подтвердило эффективность и простоту применения 3D-TiNi имплантатов, их отличную самофиксацию в костной ткани, а также аугментацию костной ткани на границе с имплантатом. Выявлено, что макроструктура, химический и фазовый состав материала имплантата близки к традиционным пористым сплавам TiNi. Показано, что метод селективного лазерного плавления позволяет создавать сложные геометрические дефекты костных тканей из TiNi.
Никелид титана, микроструктура, пористый 3d имплантат, биосовместимость, остеопластика
Короткий адрес: https://sciup.org/149144781
IDR: 149144781 | УДК: 616.71-089.844:546.3:546.82-034.24-19:57.085.1 | DOI: 10.29001/2073-8552-2024-39-1-184-193
Текст научной статьи Исследование биосовместимости пористых 3D-TiNi имплантатов в условиях in vivo
УДК 616.71-089.844:546.3:546.82-034.24-19:57.085.1
Пористые сплавы на основе TiNi на сегодняшний день активно используются в качестве материалов медицинского назначения [1–3]. Термоупругие мартенситные превращения обусловливают возможность обеспечения физико-механических свойств изделий на основе TiNi, максимально соответствующих свойствам биологических тканей [4]. Благодаря обратимым фазовым превращениям материалы из никелида титана обладают превосходной прочностью и усталостной стойкостью, что позволяет разрабатывать прочные и долговечные медицинские изделия. Наряду с фазовым составом, который определяет механические свойства сплавов TiNi и возможность реализации термомеханических эффектов памяти формы и сверхэластичности, обеспечение заданной пористой или ячеистой структуры материала будет влиять на механические характеристики материала и обеспечивать интеграцию имплантата биологической ткани [2, 5, 6].
Конструкции из пористого сплава никелида титана, полученные методом самораспространяющегося высокотемпературного синтеза, удовлетворяют всем требованиям биосовместимости, однако длительное ручное изготовление и невозможность создания точной геометрии существенно ограничивают их клиническое применение. Несмотря на превосходные функциональные свойства данных сплавов и высокую коррозионную стойкость в реконструктивной хирургии при замещении костных дефектов, необходимы биосовместимые эндопротезы индивидуальной формы и сложной геометрии, которые могли бы, имея сложную геометрическую пористую форму тонких костей при большом объеме костного дефекта, выдерживать интенсивные механические нагрузки без разрушения. В настоящее время комплексу этих требований не удовлетворяет ни одно из существующих решений. Метод селективного лазерного плавления дает возможность создавать материалы с заданной пористостью и решетчатой геометрией, которые имитируют естественную структуру кости, что позволяет улучшить остеоинтеграцию и потенциально снизить вероятность отказа имплантата [7, 8]. Аддитивные технологии позволяют точно контролировать размеры и свойства имплантата, что может улучшить функциональные результаты и снизить риск осложнений [9]. Используемый в данной работе метод селективного лазерного плавления является технологически новым и представляет собой инновационный подход к производству имплантатов из никелида титана, который может предложить новые возможности и преимущества в области медицинской имплантологии [10, 11].
Цель работы: оценка возможности применения пористых 3D-TiNi имплантатов в остеопластических операциях на основе исследования структуры и биосовместимости материала в условиях in vivo .
Материал и методы
Пористые образцы в виде конусов и индивидуального имплантата для челюстно-лицевой хирургии были получены методом селективного лазерного плавления из никелид-титанового порошкового продукта с однородной гранулометрией и структурой с применением селективного лазерного плавления на установке Russian SLM Factory (3D SLA, Санкт-Петербург, Россия). Размеры пористых конусов выбирали, исходя из диаметра бедренной кости лабораторных животных (диаметр основания – 3,5 мм, высота – 5 мм).
Для печати индивидуального имплантата для челюстно-лицевой хирургии использовали персональные данные пациента НИИ онкологии. Для получения имплантатов с разной пористой структурой подобраны параметры печати, соответствующие пористости 55, 60 и 65%.
Важным фактором, обеспечивающим возможность печати и качество, является морфология исходного порошка. Поэтому была проведена предварительная обработка порошка в устройствах для воздушно-центробежного разделения и пневмоциркуляционного дробления с целью устранения частиц аномальной формы, дробления и приобретения сферической морфологии (ТГУ, Томск).
Макроструктуру, пористость, элементный и фазовый состав пористых образцов никелида титана исследовали методами растровой микроскопии и рентгеноструктурного анализа. Оценку биосовместимости пористых образцов в виде конусов проводили в условиях in vivo с использованием лабораторных морских свинок, состояние которых анализировали с помощью КТ-сканирования.
In vivo исследования были выполнены согласно Правилам лабораторной практики в Российской Федерации (Приказ Министерства здравоохранения и социального развития Российской Федерации № 199н от 01.04.2016) и «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ». Эксперименты на животных проводили в соответствии с правилами, принятыми Европейской Конвенцией по защите позвоночных животных, используемых для эксперимен- тальных и иных научных целей (European Convention for the Protection of Vertebrate Animals Used for Experimental and other Scientific Purposes (ETS 123). Strasbourg, 1986). Исследования выполнялись согласно утвержденному письменному протоколу и в соответствии со Стандартными операционными процедурами исследователя (СОП); в соответствии с санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев).
Исследование выполнено на базе вивария ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России. В процессе эксперимента использовались лабораторные морские свинки линии Агути. Возраст животных к началу введения в эксперимент составил 1,5 мес., средний вес – 570 ± 80 г. В исследовании использовались 6 самцов морских свинок.
В соответствии с правилами, морские свинки содержались в отдельной комнате вивария в специальных клеточных батареях стандартной комплектации и выполненных из стали с цинко-хромовым покрытием, в индивидуальных клетках (0,27 м2 на одного животного). Каждая клетка имела свои этикетки с соответствующей маркировкой. На этикетках обозначались основные сведения о содержащихся в них лабораторных животных (линия, пол, возраст) с указанием принадлежности к лаборатории, названием эксперимента и установленного имплантата, ответственного экспериментатора, даты поступления животных, начала эксперимента и его окончания, дозы и другие пометки. В качестве подстила использовалась мелкая древесная стружка, обработанная в автоматическом режиме в воздушном стерилизаторе ГП-640 при температуре 120 °С в течение 90 мин.
Морским свинкам корм давался ad libitum. В качестве корма использовался стерилизованный полнорационный гранулированный комбикорм, соответствующий требованиям ГОСТ Р 50258-92, ГОСТ Р 51849-2001 (с изм. № 1, п.5, п.7.) и Ветеринарно-санитарным нормам и требованиям к качеству кормов для непродуктивных животных № 13-7-3/1010 от 15.07.97 г. и изменениям к ним № 135-2/1600 от 06.05.99 г. Вода лабораторного качества давалась ad libitum в стандартных автоклавированных бутылочках со стальными крышками-носиками. Образцы воды периодически анализировались на микробиологическое загрязнение.
До начала и весь период экспериментов животные находились в виварии при температуре воздуха 18–26 °С, относительной влажности 30–70%, объеме воздухообмена (вытяжка: приток) 8 : 10, с 10-кратной сменой объема воздуха комнаты/ч, в световом режиме (день – ночь) 12 : 12 ч, цикл освещения искусственный. Уровень шума – не более 65 дБ.
От поступления животных в виварии до введения в эксперимент выдерживался карантин (адаптация) в течение 14 дней. Во время этого периода осуществлялся ежедневный осмотр внешнего состояния животных и еженедельный клинический осмотр до рандомизации. Животные с обнаруженными в ходе осмотра отклонениями в экспериментальные группы включены не были.
Животные распределялись по группам случайным образом так, чтобы индивидуальная масса животных не отличалась более чем на 10% от средней массы животных одного пола. Каждому животному был присвоен индивидуальный номер.
Результаты и обсуждение
Проведен структурно-фазовый анализ конусных 3D образцов TiNi, полученных методом селективного лазерного плавления . На электронно-микроскопических изображениях макроструктуры пористых 3D образцов видно, что морфология порового пространства связана со структурой исходного порошка никелида титана (рис. 1). Средний размер пор составляет 360 мкм. Особенностью структуры является образование контактных перемычек между частицами порошка, что обеспечивает высокую прочность и механическую стабильность материала.
Установлено, что основными элементами в составе пористых 3D образцов являются титан (~33%) и никель (~27%). Присутствие кислорода в количестве ~39% указывает на процессы окисления, которые могли произойти при высоких температурах под воздействием лазера во время плавления. Кроме того, в образцах были выявлено содержание кальция, что связано с получением исходного порошка методом гидридно-кальциевого восстановления.

а
Рис. 1. РЭМ-изображение образца TiNi ( а ), ЭДС-картирование по элементам образца TiNi ( б )
Fig. 1. SEM image of the TiNi sample ( a ), EDS elemental mapping of the TiNi sample ( b )
Кислород и кальций должны оказать положительное влияние на биохимическую совместимость поверхности пористых 3D образцов никелида титана. Рентгеноструктурный анализ был проведен на трех 3D образцах никелида титана разной пористости (образец 7 – 55%, образец 8 – 60%, образец 9 –65%). Был определен фазовый состав образцов, состоящий из группы интерме-таллидов системы Ti-Ni: TiNi(B2), TiNi3 и Ti3Ni4 (рис. 2). В образце никелида титана с пористостью 65% выявлено меньшее содержание вторичных фаз TiNi3 и Ti3Ni4. Основная доля приходится на аустенитную фазу TiNi(B2), ответственную за мартенситные превращения, что и будет обеспечивать сплаву более высокую прочность и сверхэластичность. Поэтому для дальнейших in vivo испытаний были выбраны 3D образцы никелида титана с пористостью 65%.
»TiNi(B2>
= TiNii
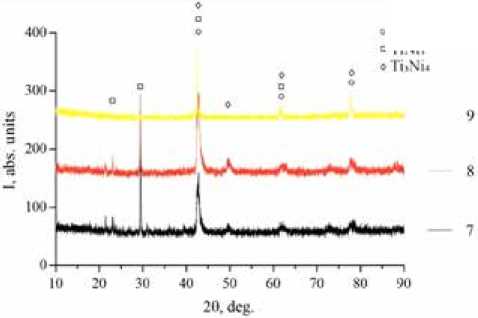
Рис. 2. Рентгенограммы пористого образца, полученного методом селективного лазерного плавления
Fig. 2. X-ray images of porous samples obtained by the SLM method
До начала in vivo испытаний пористых 3D образцов из никелида титана лабораторным морским свинкам проведена периоперационная антибактериальная профилактика однократно за 30 мин до операции. Обезболивание в послеоперационном периоде: нестероидные противовоспалительные средства. Под общей анестезией (золе-тил + ксилазин) после удаления шерсти производилась обработка операционного поля раствором антисептика. В положении на контрлатеральном боку скальпелем выполнялся разрез по наружной поверхности бедра в проекции дистальной трети.
После рассечения кожи рассекалась собственная фасция бедра. В межмышечном пространстве между передней и латеральной группой мышц путем раздвигания тканей тупым способом достигали надкостницы. Надкостница отсепаровывалась от кости. В наружной части дистального метаэпифиза бедра с помощью шаровидной фрезы и электродрели выполнялось моделирование костной полости до 4 мм в диаметре (рис. 3 а ). Костный дефект плотно заполнялся конусным 3D имплантатом из никелида титана, изготовленным с помощью селективного лазерного плавления, соответствующим полости размером (рис. 3 б ). После заполнения полости производилось послойное ушивание раны, швы на кожу (рис. 3 в ).
Общее состояние: все животные с первых послеоперационных суток активны, интересуются пищей, прибавляют / не теряют в массе тела.
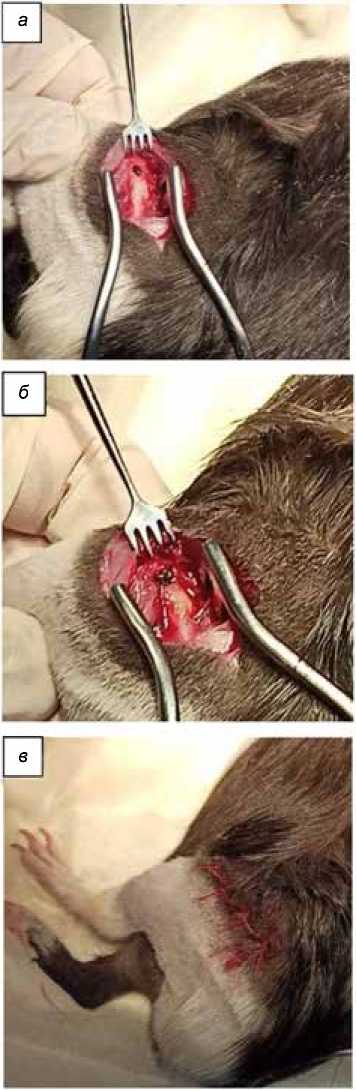
Рис. 3. Процесс операции внедрения 3D-TiNi имплантата в костную полость бедра
Fig. 3. Process of implanting the 3D-TiNi implant into the femoral bone cavity
Местные проявления: у всех животных с первых послеоперационных суток отмечалась полная опороспо-собность на задние конечности, полный объем движений в коленных суставах. Деформаций осей задних конечностей не отмечалось. Отторжения импланта не наблюдалось. Местных воспалительных изменений (отек, гнойные скопления, инфильтраты, серозное отделяемое, повышение местной температуры) не отмечалось. Кожные швы сняты на 10-е сут.
Анализ образцов методом компьютерной томографии проводился на сроке 4 нед. после аугментации на аппарате Philips (Нидерланды). На томографических срезах во фронтальной плоскости при последовательном шаге среза в 0,5 мм оценивали коэффициент абсорбции костной ткани в единицах Хаунсфилда (HU). Расчет искомых величин проводили в программе RadiAnt DICOM Viewer 4.5.1. Для стратификации перифокальной костной ткани после имплантации остеопластических материалов была предложена схема периимплантных критических зон (рис. 4). Согласно предложенной схеме, выделялось семь основных точек аттестации по отношению к аугмен-тированному имплантату:
-
– точка, расположенная в самом имплантате;
-
– две точки, расположенные вентрально от имплантата на расстоянии в 1 и 2 мм соответственно;
-
– две точки, расположенные дорсально от имплантата на расстоянии в 1 и 2 мм соответственно;
-
– две точки, расположенные кнутри от имплантата на расстоянии в 1 и 2 мм соответственно.
В совокупности четыре точки, расположенные вентрально и дорсально, соответствовали кортикальной пластинке кости, вследствие чего среднее арифметическое радиоденситометрической плотности было обозначено как CBD (Cortical bone density). Напротив, две точки, расположенные кнутри от имплантата, соответствовали трабекулярной кости, вследствие чего среднее арифметическое радиоденситометрической плотности было обозначено как TBD (Trabecular bone density). Плотность самого материала была максимальной для аттестации в данном программном обеспечении и составила 3071 HU. Уже к 4-й нед. послеоперационного периода средние арифметические значения CBD (645 HU) и среднее значение TBD (438 HU) были сопоставимы с плотностью кортикальной и трабекулярной кости метадиафизарных зон интактной костной ткани. Из данного наблюдения было установлено, что соответствие показателей денситоме-трической плотности перифокальной кости интактным метадиафизарным зонам, объясняется полноценной интеграцией остеопластического материала в донорскую область.
Демонстрируются КТ-сканы в трех взаимоперпендикулярных плоскостях с выведением в фокус зоны аугментации пористого 3D образца импланта из никелида титана в области дистального метадиафиза бедренной кости морской свинки (рис. 5). Компактная и трабекулярная кость в данной зоне имеет нормальную структуру. Кортикальная пластинка не истончена. В перифокальной зоне отсутствуют очаги разрежения костной ткани, патологические костные полости, фокусы скопления патологического содержимого. Просвет костномозгового канала равномерный, без участков сужения и расширения. Изменений в мягких тканях и в области суставной щели не отмечается.
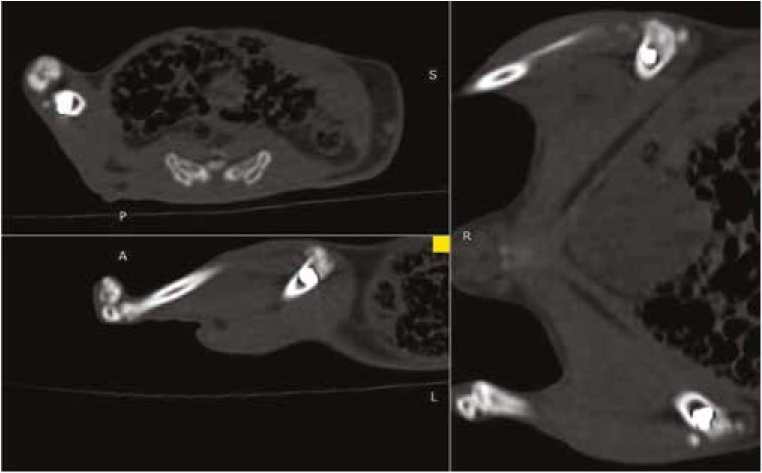
Рис. 5. КТ-сканы в трех взаимно перпендикулярных плоскостях с выведением в фокус зоны аугментации пористого 3D образца импланта из никели-да титана
Fig. 5. CT scans in three mutually perpendicular planes focusing the area of augmentation of a 3D titanium nickelide implant
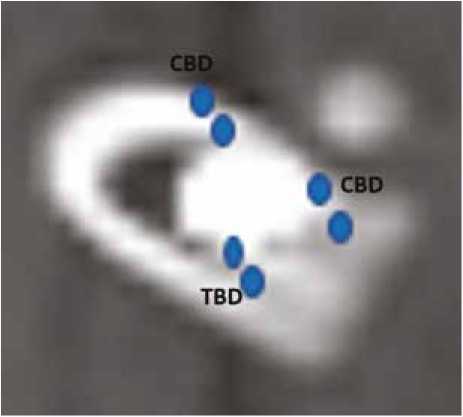
Рис. 4. Схема периимплантных критических зон
Fig. 4. Diagram of peri-implant critical zones
Представлена 3D-модель бедренной кости с аугментацией в зону дистального метадиафиза имплантата из никелида титана в различных вариантах костного режима сканирования (рис. 6). Видимых деформаций костной ткани, изменений направленности трабекул, патологических костных полостей, очагов разрежения костной ткани не выявлено. Форма и структура костной ткани не изменена. Конгруэнтность суставной щели коленного сустава не нарушена. Окружающие мягкотканные структуры не изменены.
Локальное кровоснабжение метаэпифизарных зон не нарушено. Визуализируется решетчатая структура аугмента, с плотным заполнением ячеистых пространств имплантата трабекулярной костью (рис. 7).
На основании положительных результатов in vivo исследований конусных пористых 3D образцов из ни- келида титана и выявления возможности изготовления индивидуального имплантата сложной геометрии была проведена пробная печать эндопротеза по данным муль-тиспиральной компьютерной томографии больного НИИ онкологии. Для этого с использованием средств твердотельного геометрического моделирования и подходов реверс-инжиниринга был получен цифровой двойник костного дефекта боковой поверхности ската носа слева. Накладка зеркально копировала геометрию правой не поврежденной части переносицы. Была создана stl-модель костного дефекта для 3D-печати. По созданной модели из порошка никелида титана с использованием технологии селективного лазерного плавления был получен образец индивидуального пористого 3D-импланта с заданной пористостью 65% (рис. 8). Пористость создавали путем варьирования мощности лазерного источника.
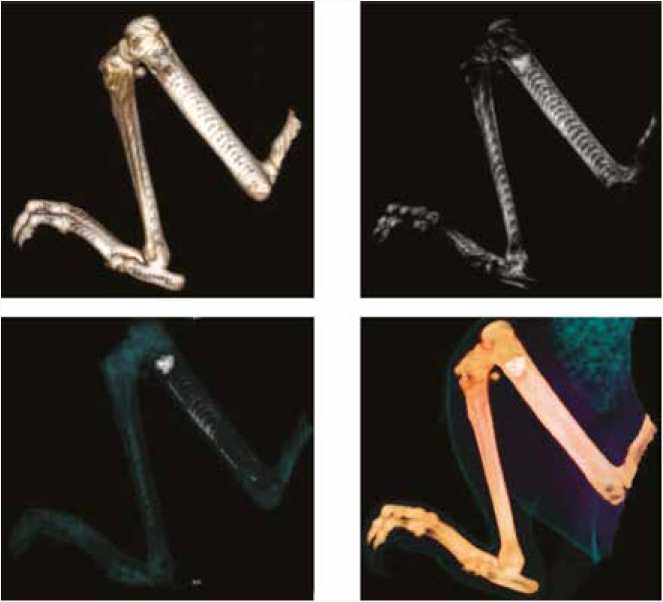
Рис. 6. 3D-модель бедренной кости с аугментацией в зону дистального метадиафиза импланта из никелида титана в различных вариантах костного режима сканирования
Fig. 6. 3D-model of the femoral bone with augmentation in the distal metadiaphysis zone of the implant made of nickel-titanium alloy in various bone scanning modes
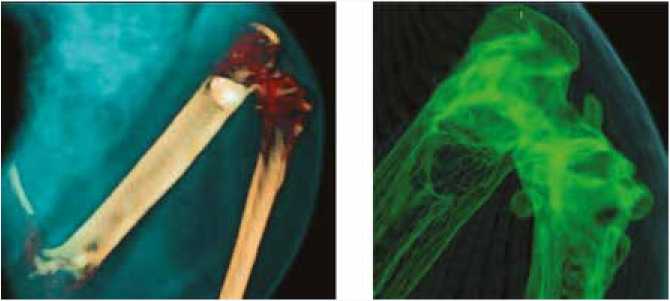
Рис. 7. 3D-модель бедренной кости с образованием в структуре напечатанного 3D-импланта из никелида титана трабекулярной костной ткани
Fig. 7. 3D-model of the femoral bone with trabecular bone tissue formation in the structure of the printed 3D implant made of nickel-titanium alloy
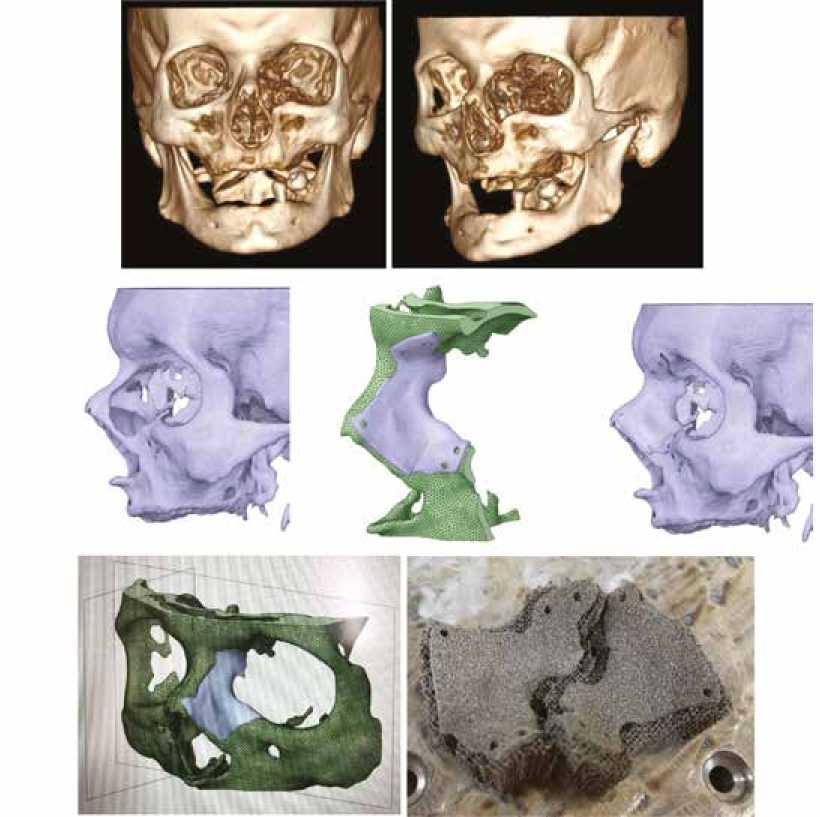
Рис. 8. Данные мультиспиральной компьютерной томографии больного. Модель черепа с дефектом переносицы. Твердотельная модель костного дефекта и напечатанный методом SLM образец индивидуального 3D-импланта из никелида титана
Fig. 1. MSCT data of the patient. Skull model with a nasal bridge defect. Solid model of the bone defect and an SLM printed sample of an individual 3D implant made of titanium nickelide
Согласно результатам растровой электронной микроскопии, установлено, что образец индивидуального пористого 3D-импланта является прочным. Визуальная оценка поровой структуры и криволинейных участков не выявила дефектов и не проплавленных зон в местах контактного плавления порошка.
Выводы
Использование 3D-TiNi имплантатов в медицине открывает большие перспективы в остеопластических операциях. В данной работе показана принципиальная возможность печати сложных геометрических дефектов костных тканей из порошка никелида титана с использованием методов компьютерного моделирования и технологии селективного лазерного плавления.
Установлено, что варьирование мощности лазерного источника и размеров ячейки сетки позволяет получать губчатые массивы из никелида титана с разной степенью пористости. Структурными методами исследования установлено, что пористые 3D образцы никелида титана со- держат фазы TiNi(B2), TiNi3 и Ti3Ni с примесью кислорода, что указывает на процесс окисления при лазерной печати. Наличие высокой объемной доли аустенитной фазы В2 в структуре 3D образцов с пористостью 65% свидетельствует о возможности сверхэластичного поведения, что наделяет имплантат уникальными биоэквивалентными свойствами. Присутствие кальция в структуре связано с получением исходного порошка методом гидридно-каль-циевого восстановления. Кислород и кальций обусловливают биохимическую совместимость поверхности 3D-TiNi имплантатов.
В экспериментальном исследовании продемонстрирована простота применения пористых 3D-TiNi имплантатов в процессе оперативного вмешательства без необходимости дополнительной фиксации, что доказывается отсутствием миграции импланта в течение 4 нед. и говорит о том, что он отлично самофиксируется в костной ткани. В результате проведения многофакторного рентгенологическго исследования лабораторных животных выявлены такие положительные эффекты, как аугментация костной ткани на границе с имплантом, по денситометрическим показателям сопоставимой с интактной костной тканью. Также определено отсутствие нарушения кровоснабжения в области установленно- го имплантата. Все вышеуказанные положительные эффекты указывают на перспективные возможности в использовании 3D-TiNi имплантатов в травматологии и костной онкологии.
Список литературы Исследование биосовместимости пористых 3D-TiNi имплантатов в условиях in vivo
- Zhu J., Zeng Q., Fu T. An updated review on TiNi alloy for biomedical applications. Corrosion Reviews. 2019;37(6):539-552. https://doi.org/10.1515/corrrev-2018-0104.
- Topolnitskiy E., Chekalkin T., Marchenko E., Yasenchuk Y., Kang S.-B., Kang J.-H. et al. Evaluation of clinical performance of tini-based implants used in chest wall repair after resection for malignant tumors. J. Funct. Biomater. 2021;12(4):60. https://doi.org/10.3390/jfb12040060.
- Shtin V., Novikov V., Chekalkin T., Gunther V., Marchenko E., Choynzonov E. et al. Repair of orbital post-traumatic wall defects by custom-made TiNi mesh endografts. J. Funct. Biomater. 2019;10(3):27. https://doi.org/10.3390/jfb10030027.
- Gunther V., Marchenko E., Chekalkin T., Baigonakova G., Kang J.-H., Kim J.-S. et al. Study of structural phase transitions in quinary TiNi(MoFeAg)-based alloys. Materials Research Express. 2017;4(10):105702. https://doi.org/10.1088/2053-1591/aa9087.
- Song D., Yu C., Zhang C., Kang G. Superelasticity degradation of NiTi shape memory alloy in wide ranges of temperature and loading level: Experimental observation and micromechanical constitutive model. International Journal of Plasticity. 2023;161:103487. https://doi.org/10.1016/j.ijplas.2022.103487.
- Zhang J., Wang S., Hu P., Zhang Y., Ding H., Huang Y. A novel strategy for fabricating phase transforming NiTi shape memory alloy via multiple processes of severe plastic deformation. Materials Letters. 2023;355:135439. https://doi.org/10.1016/j.matlet.2023.135439.
- Chang C., Huang J., Yan X., Li Q., Liu M., Deng S. et al. Microstructure and mechanical deformation behavior of selective laser melted Ti6Al4V ELI alloy porous structures. Materials Letters. 2020;277:128366. https://doi.org/10.1016/j.matlet.2020.128366.
- Farber E., Orlov A., Borisov E., Repnin A., Kuzin S., Golubkov N. et al. TiNi alloy lattice structures with negative poisson’s ratio: Computer simulation and experimental results. Metals. 2022;12(9):1476. https://doi.org/10.3390/met12091476.
- Lu H.Z., Ma H.W., Luo X., Wang Y., Wang J., Lupoi R. et al. Microstructure, shape memory properties, and in vitro biocompatibility of porous NiTi scaffolds fabricated via selective laser melting. Journal of Materials Research and Technology. 2021;15(10):6797-6812. https://doi.org/10.1016/j.jmrt.2021.11.112.
- Vignesh M., Ranjith Kumar G., Sathishkumar M., Manikandan M., Rajyalakshmi, G., Ramanujam R. et al. Development of biomedical implants through additive manufacturing: A review. Journal of Materials Engineering and Performance. 2021;30:4735-4744. https://doi.org/10.1007/s11665-021-05578-7.
- Fe-Perdomo I.L., Ramos-Grez J.A., Beruvides G., Mujica R.A. Selective laser melting: lessons from medical devices industry and other applications. Rapid Prototyping Journal. 2021;27(10):1801-1830. https://doi.org/10.1108/RPJ-07-2020-0151.


