Исследование биотехнологического потенциала микробного консорциума
Автор: Занданова Т.Н., Гоголева П.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технические науки
Статья в выпуске: 3 (66), 2017 года.
Бесплатный доступ
В статье приведены результаты исследования биотехнологической активности микробного консорциума, полученного путем автоселекции микрофлоры кефирной закваски и термофильных лактобактерий. Показано, что микробный консорциум обладает высокой ферментирующей активностью и формирует характерные для курунги и кумыса качественные показатели. Установлена высокая антагонистическая активность микробного консорциума, выявлена ее способность подавлять развитие E. coli I53, и S. sonnei 2848. На основании сравнительного анализа адгезии микрофлоры микробного консорциума, кефирной грибковой закваски и чистых культур L. bulgaricus и L. acidophilus установлено, что микробные сообщества обладают большей адгезивной активностью. Результаты исследований динамики синтеза экзополисахаридов (ЭПС) в процессе автоселекции показывают, что культивирование при экстремальных значениях активной кислотности среды повышает ЭПС потенциал микробного консорциума.
Курунга, кумыс, кефирная закваска, адгезивная активность, биосинтез экзополисахаридов, микробный консорциум
Короткий адрес: https://sciup.org/142143366
IDR: 142143366 | УДК: 602.3:579.8
Текст научной статьи Исследование биотехнологического потенциала микробного консорциума
Курунга и кумыс – национальные кисломолочные продукты гетероферментативного брожения, издавна используемые в сочетании с антибиотиками для предупреждения и лечения различных форм туберкулеза, желудочно-кишечных и сердечно-сосудистых заболеваний, при авитаминозе и нарушениях обмена веществ, при заболеваниях нервной системы и общем упадке сил. Лечебные свойства этих продуктов обусловлены их микробиологическим составом. Микрофлора этих напитков содержит термофильные и мезофильные лактобактерии, ацетобактерии, дрожжи, сбраживающие и не сбраживающие лактозу [9, 10, 11, 14].
Проблеме создания микробного консорциума курунги и кумыса посвящен ряд отечественных и зарубежных исследований. Обзор современных технологий гетероферментатив-ных кисломолочных продуктов показал, что для получения стартовых культур в основном используются чистые культуры лактобактерий и дрожжей [7, 12].
Известные современные технологии производства курунговых и кумысных заквасок на чистых культурах не нашли широкого промышленного внедрения. В таких заквасках при всей тщательности подбора штаммов дрожжей и лактобактерий не удается составить симбиоз, характерный для естественной популяции микроорганизмов этих продуктов. Поэтому применение заквасок на чистых культурах в промышленном производстве не гарантирует получение продукта со стабильными показателями.
Единственным кисломолочным продуктом гетероферментативного брожения, производимый в промышленном масштабе на естественной закваске, является кефир.
Известно, что микрофлора кефира представляет естественный симбиоз различных видов дрожжей, сбраживающих и не сбраживающих лактозу, термофильных и мезофильных лактобактерий, ацетобактерий, молочнокислых стрептококков, ароматобразующих бактерий, обладающих исключительной способностью к саморегулированию своего состава [13, 14].
Нами разработан способ получения микробного консорциума путем длительной автоселекции микрофлоры кефирной грибковой закваски в присутствии термофильных лактобактерий Lactobacillus bulgaricus и Lactobacillus acidophilus , идентичных по составу микрофлоре курунги и кумыса [4].
Целью данного исследования было изучение биотехнологического потенциала полученного микробного консорциума.
Объекты и методы исследования
В качестве объекта исследования использовали симбиотический микробный консорциум, полученный путем длительной автоселекции комбинированной закваски, состоящей из кефирной грибковой закваски и термофильных лактобактерии Lactobacillus acidophilus и Lactobacillus bulgaricus в соотношении 1:0,5:0,5 соответственно. Автоселекцию комбинированной закваски проводили при 30 ° С при рН 4 -3,5.
Для исследований использовали:
-
- обезжиренное пастеризованное при 95 ° С с выдержкой 15 мин коровье молоко, охлажденное до 30 ° С;
-
- кобылье молоко, пастеризованное при 60 ° С с выдержкой 10 мин, охлажденное до 30 ° С.
Кислотность определяли по ГОСТ 54669-2011
Массовую долю спирта – пикнометрическим методом по ГОСТ 3629-47.
Количество молочной кислоты определяли методом Пиккеринга и Клега [5].
Количественный учет микроорганизмов проводили методом предельных разведений по числу колониеобразующих единиц (КОЕ) при высевах на агаризованных лактозно-картофельном и глюкозно-картофельном средах для дрожжей, сбраживающих/несбраживающих лактозу соответственно, молочнокислых бактерий на среде ГМК по ТУ10-02-02-789-192-95.
Адгезивные свойства изучали на формалинизированных эритроцитах по развернутому методу В.И. Брилиса [1].
Антибиотическую активность определяли методом последовательных разведений по М.С. Полонскому. В исследованиях антибиотической активности использовали тест-культуры E. coli I53 and S. sonnei 2848 .
Результаты и их обсуждение
Развитие биохимических процессов и показатели качества кисломолочных продуктов зависят от состава и свойств микроорганизмов, а также от состава сквашиваемого молока. Ис- следовано влияние вида молока на биохимическую активность микробным консорциумом, полученного автоселекцией микрофлоры кефирной грибковой закваски в сочетании термофильных лактобактерий.
В подготовленное коровье и кобылье молоко вносили по 10% закваски на основе микробного консорциума. Сквашивание проводили при 30 ° С.
Результаты исследований представлены в таблице 1.
Таблица 1
Биохимическая активность микробного консорциума
|
Исследуемые свойства |
Характеристика показателей |
|
|
на коровьем молоке |
на кобыльем молоке |
|
|
Продолжительность сквашивания, ч |
14-15 |
8-10 |
|
Титруемая кислотность,0Т |
210-220 |
140-160 |
|
Активная кислотность, ед. |
3,6 + 0, 1 |
3,9 + 0, 1 |
|
Массовая доля спирта, % об. |
0,9 + 0,1 |
1,2 + 0,1 |
|
Массовая доля молочной кислоты, % |
1,4 + 0,2 |
1,2 + 0,2 |
|
ЭПС, мкг/мл |
15 +2 |
|
|
Количество жизнеспособных клеток, КОЕ/мл: термофильные лактобактерии мезофильные лактобактерии дрожжи, сбраживающие лактозу дрожжи, не сбраживающие лактозу уксуснокислые бактерии |
10 6 109 107 105 104 |
10 5 108 108 107 104 |
|
Органолептические свойства |
Вкус кисломолочный, с дрожжевым привкусом, консистенция жидкая, хлопьевидная, слегка газированная |
Вкус кисломолочный, с выраженным дрожжевым привкусом, консистенция жидкая, мелкодисперсная, хлопьевидная, газированная |
Данные, представленные в таблице 1, свидетельствуют о способности полученного микробного консорциума к саморегуляции состава микрофлоры в зависимости от состава питательного субстрата. При ферментации кобыльего молока наблюдается увеличение количества дрожжей и повышение спиртообразующей активности, связанное, вероятно, с повышенным содержанием лактозы в кобыльем молоке. Полученные результаты свидетельствуют о возможности использования полученного микробного консорциума для производства курунги и кумыса.
Полученный микробный консорциум формирует характерные для курунги и кумыса органолептические свойства, обладает необходимой энергией кислотообразования и спиртооб-разования.
Антагонистическая активность в отношении патогенной и условно-патогенной микрофлоры является важнейшей характеристикой микрофлоры курунги и кумыса. Поэтому была исследована антагонистическая активность созданного микробного консорциума в сравнении с кефирной закваской по отношению к тест-культурам E. coli I 53 и S. sonnei 2848. Результаты исследований представлены в таблице 2.
Таблица 2
Антибиотическая активность заквасок к E.coli I 53 и S. sonnei 2848
|
Вид закваски |
Рост бактерий в разведениях |
|||
|
E. coli I 53 |
S. sonnei 2848 |
|||
|
Отсутствие роста |
Торможение роста |
Отсутствие роста |
Торможение роста |
|
|
Кефирная закваска |
1:4 |
1:32 |
1:4 |
1:64 |
|
Микробный консорциум |
1:8 |
1:64 |
1:16 |
1:128 |
Как видно из данных таблицы 2, микрофлора микробного консорциума обладает наиболее выраженным по сравнению с кефирной закваской бактерицидным и бактериостатическим действием по отношению к E. coli I 53 и S. sonnei 2848.
Бактерицидное действие микробного консорциума по отношению к E. coli проявлялось в разведении 1:8, а к S. sonnei – 1:16, бактериостатическое действие в разведении 1:64 и 1:128 соответственно.
Адаптация к факторам внешней среды обеспечивается механизмами, гарантирующими стабильность микробного консорциума. К таким механизмам относятся межклеточная когезия и адгезия бактерий.
Адгезивные свойства микробного консорциума оценивали по среднему показателю адгезии (СПА), коэффициенту участия эритроцитов (КУЭ), об адгезивности культур и микробного консорциума судили по индексу адгезивности микроорганизмов (ИАМ) [1].
Ранее нами были проведены исследования адгезиной активности микробного консорциума и динамика прироста экзополисахараидов (ЭПС) в процессе автоселекции микрофлоры кефирной закваски и термофильных лактобактерий [6]. Результаты сравнительной оценки адгезивной активности полученного микробного консорциума, кефирной грибковой закваски и чистых культур L. acidophilus и L. bulgricus представлены в таблице 3.
Таблица 3
Адгезивность микробного консорциума и чистых культур лактобактерий
|
Наименование опыта |
СПА |
КУЭ |
ИАМ |
Адгезивные свойства |
|
L. acidophilus |
3,3 |
78 |
2,9 |
среднеадгезивные |
|
L. bulgаricus |
1,73 |
72 |
2,4 |
низкоадгезивным |
|
Кефирная грибковая закваска |
3,3 |
74 |
4,4 |
высокоадгезивные |
|
Микробный консорциум |
3,8 |
78 |
4,8 |
высокоадгезивные |
Из данных таблицы 3 следует, что лактобациллы по разному адгезируются к эритроцитам человека in vitro : индекс адгезивности был наиболее высоким у микробного консорциума – (4,8), кефирной закваски (4,4), средним у L. acidophilus (2,9), умеренным у L. bulgаricus (2,4).
Исследования биосинтеза ЭПС в процессе автоселекции микрофлоры кефирной грибковой закваски и термофильных лактобактерий для получения микробного консорциума представлены на рисунке.
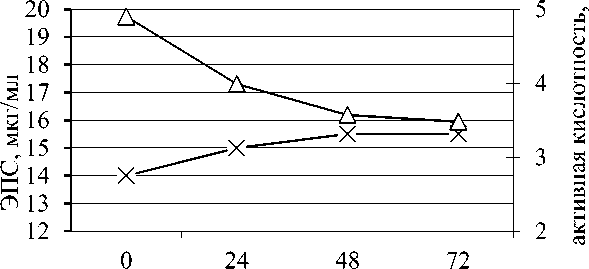
о
Время,
ч
ЭПС рН
Рисунок - Динамика ЭПС и рН в процессе автоселекции микрофлоры кефирной закваски и термофильных лактобактерий
Из данных, представленных на рисунке, видно, что синтез ЭПС начинается с первых часов автоселекции и максимально концентрируется в стационарной фазе. Установленная динамика зеркально отражает динамику рН: прирост ЭПС по времени совпадает с резким снижением рН до 3,5, дальнейшее ведение автоселекционного процесса полунепрерывным культивированием стабилизирует рН среды и синтез ЭПС.
На основании этих данных можно считать, что изменения в динамике ЭПС связаны с процессами саморегуляции микрофлоры.
В начале автоселекционного процесса наблюдается уменьшение количества неустойчивых к низкой кислотности среды мезофильных молочнокислых палочек и стрептококков. Несмотря на неблагоприятные условия окружающей среды, популяции этих микроорганизмов сохраняются в небольших количествах в создаваемом микробном консорциуме [4].
Прирост ЭПС в исследуемых образцах в течение автоселекции можно рассматривать как стрессовый ответ формируемого микробного консорциума на изменения рН и температуры среды.
Одна из точек зрения на причину формирования симбиотических микробных сообществ исходит из предположения, что эти сообщества являются способом защиты микроорганизмов от неблагоприятных условий. Действительно, микроорганизмы в сообществах более устойчивы к различным воздействиям: изменениям рН, температуры, лимитированию субстратами и др. В таких сообществах между видами конкуренции не существует [2, 3, 8, 13].
Значительную роль в приобретаемой устойчивости играют ЭПС. Микроорганизмы в зависимости от конкретных условий существования синтезируют ЭПС различного состава и свойств. Экзогенные углеводы выполняют функцию саморегулятора процессов роста и развития, осуществляют важную трофическую функцию в экосистемах [3].
Адаптация микроорганизмов в микробных сообществах к экстремальным условиям культивирования приводит к формированию устойчивых симбиозов. Наличие симбиотических взаимоотношений в полученном микробном консорциуме подтверждаются высокой плотностью микрофлоры и биохимической активностью, способностью синтезировать антибиотические субстанции, ЭПС и др.
Выводы
-
1. Полученный микробный консорциум формирует характерные для курунги и кумыса органолептические свойства, обладает необходимой энергией кислотообразования и спирто-образования.
-
2. Результаты исследований свидетельствуют о возможности получения микробного консорциума, идентичного по своему составу естественной популяции микроорганизмов ку-рунги и кумыса, обладающего высокой антибиотической активностью к патогенной микрофлоре.
-
3. Установлены высокая адгезивная активность микробного консорциума и экзополиса-харидный потенциал, способствующий стабильности его состава.
Полученные результаты открывают широкие перспективы для применения микробного консорциума в производстве биологически активных добавок и кисломолочных продуктов.
Список литературы Исследование биотехнологического потенциала микробного консорциума
- Брилис В.И., Брилене Т.А., Ленцнер Х.П. и др. Методика изучения адгезивного процесса микроорганизмов//Лабораторное дело. -1986. -№ 4. -С. 210-214.
- Голод Н.А., Лойко Н.Г., Мулюкин А.Л. и др. Адаптация молочнокислых бактерий к неблагоприятным для роста условиям//Микробиология. -2009. -Т. 78, № 3. -С. 317-335.
- Еникеев Р.Р. Влияние условий накопления бактериальных полисахаридов при производстве кефира//Известия вузов. Пищевая технология (Химия пищевых продуктов и материалов). -2010. -№ 5/6. -С. 15-19.
- Занданова Т.Н. Симбиотическая закваска для производства курунги//Пищевая промышленность. -2009. -№ 7. -С. 48-49.
- Инихов Г.С., Брио Н.П. Методы анализа молока и молочных продуктов. -М.: Пищевая промышленность, 2001. -318 с.
- Хамагаева И.С., Занданова Т.Н., Замбалова Н.А. Влияние условий автоселекции на синтез экзополисахаридов и адгезивную активность микробного консорциума//Вестник ВСГУТУ. -2013. -№ 2. -C. 57-63.
- Патент SU 651776 Способ производства кисломолочного напитка «Курунга»/Лев Г.Б., Паткуль Г.М. -Заявл. 12.05.1977; опубл. 15.03.1979.
- Николаев Ю.А. Внеклеточные факторы адаптации бактерий к неблагоприятным условиям среды//Прикладная биохимия и микробиология. -1997. -Т. 40, № 4. -С. 387-397.
- Решетник Л.А. Микробиологическая и клиническая характеристика//Сибирский медицинский журнал. -2007. -Т. 69 (2). -С. 88-91.
- Сорвачева О.А. Новый кисломолочный продукт - курунга // Переработка молока: технология, оборудование, продукция // Технология. - 2009. - № 5- С. 36-37.
- Цэнд-Аюуш Ч., Ганина В.И. Пробиотические свойства молочнокислых бактерий, выделенных из национальных молочных продуктов Монголии//Техника и технология пищевых производств. -2013. -№ 1. -С. 58-63.
- Чужова З.П. Курунга -лечебный и диетический напиток из коровьего молока//Вопросы питания. -1964. -Т. XXII, № 5.
- Фильчакова С.А., Королева Н.С. Влияние условий культивирования на состав и микрофлору кефирных грибков//Молочная промышленность. -М., 1997. -№ 5. -С. 37.
- Фильчакова С.А. Национальный кисломолочный напиток -кефир//Переработка молока. -2010. -№ 1. -С. 34-35.
- Burentegusi, Streptococcus microflora in traditional starter cultures for fermented milk, hurunge, from Inner Mongolia, China/Streptococcus Burentegusi, B. Yu, T. Miyamoto//Animal Science Journal. -2006. -Vol. 77 (2). -P. 235-241.


