Исследование бромциклизации S-аллильных производных 3-меркапто-1,2,4-триазолов
Автор: Ильиных Елена Сергеевна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.5, 2013 года.
Бесплатный доступ
По данным ЯМР 1Н установлено, что бромирование S-аллильных производных 3-меркапто-1,2,4-триазолов сопровождается образованием продуктов бромциклизации (бромиды [1,3]тиазоло[3,2-b][1,2,4]триазолия и [1,2,4]триазоло[3,4-b][1,3]тиазиния) и продуктов присоединения брома по двойной связи аллильного фрагмента.
3-аллилтио-4-метил-1, 4-триазол, 3-аллилтио-5-метил-1, 3-аллилтио-5-трифторметил-1, бромциклизация, бромоние-вый и тиираниевый ионы, спектроскопия ямр 1н, 1н nmr spectroscopy
Короткий адрес: https://sciup.org/147160269
IDR: 147160269 | УДК: 547.792.9
Текст научной статьи Исследование бромциклизации S-аллильных производных 3-меркапто-1,2,4-триазолов
Химия меркапто-1,2,4-триазолов и их конденсированных гетероциклических производных с мостиковым атомом азота является предметом устойчивого синтетического и биологического интереса. Данные объекты исследования дают широкую возможность для синтеза целого ряда новых гетерофункциональных гетероциклических соединений с различными полезными практическими свойствами. Так, для большого числа производных меркапто-1,2,4-триазолов зарегистрированы различные виды биологической активности (антибактериальная [1, 2], противовоспалительная [3, 4], противогрибковая [5, 6], противоопухолевая [7], другие виды активности). Кроме того, соединения данного ряда используются в качестве ингибиторов коррозии металлов и сплавов [8].
Вместе с тем, в литературе имеются единичные сведения об электрофильной гетероциклизации S-аллильных производных 4,5-дизамещенных меркапто-1,2,4-триазолов под действием брома [9, 10]. Ранее нами была исследована иодциклизация 3-аллилтио-4-метил-1,2,4-триазола ( 1 ) [11], 3-аллилтио-5-метил-1,2,4-триазола ( 2а ) [12] и 3-аллилтио-5-трифторметил-1,2,4-триазола ( 2b ) [13]. В настоящей работе нами с целью синтеза новых бромсодержащих представителей гетероциклических соединений на основе 3-меркапто-1,2,4-триазолов впервые изучено взаимодействие соединений 1 и 2a, b с бромом.
Обсуждение результатов
Нами исследовано бромирование 3-аллилтио-4-метил-1,2,4-триазола 1 в CH2Cl2 при комнатной температуре и соотношении триазол 1 :бром, равном 1:2 (метод А), и в системе HBr (40 %) (избыток) – H 2 O 2 (3 %) (метод B) (схема 1).
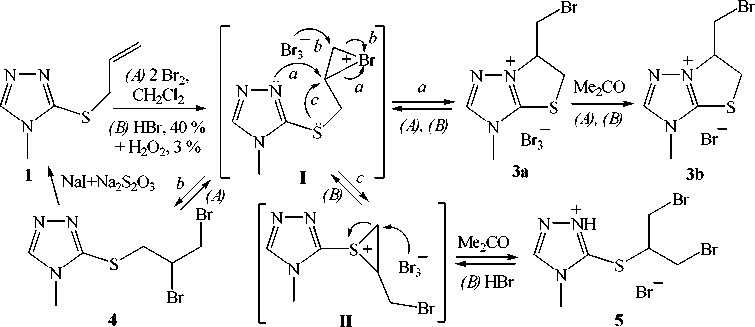
Схема 1. Бромирование 3-аллилтио-4-метил-1,2,4-триазола (1)
Установлено, что при проведении реакции по методу А образуется смесь двух соединений – продукта бромциклизации, трибромида 6-бромметил-3-метил-5,6-дигидро[1,3]тиазоло[3,2- b ]-[1,2,4]триазолия ( 3а ), и продукта присоединения брома по двойной связи аллильного фрагмента, 3-(2,3-дибромпропил)тио-4-метил-1,2,4-триазола ( 4 ).
При обработке смеси полученных соединений 3а и 4 ацетоном удается отделить продукт бромциклизации с выходом 37 % в виде бромида 3b , который не растворяется в ацетоне и представляет собой порошок белого цвета. В отличие от бромида 3b , продукт присоединения брома 4 хорошо растворяется в ацетоне, CHCl 3 и CH 2 Cl 2 , а при действии NaI и Na 2 S 2 O 3 легко разлагается до исходного аллилсульфида 1 (контроль методом ТСХ).
В спектре ЯМР 1Н бромида 3b , кроме синглетов протонов –NCH 3 (δ 3,66 м.д.) и Н-2 (δ 9,04 м.д.) триазольного кольца и мультиплета протона –+NC H Х – (δ 4,72 м.д.), имеется еще два набора сигналов, которые можно рассматривать как подспектры ab-типа спиновой ABMNX системы без проявления дальнего взаимодействия. Так, протоны каждой из групп –CHAHBBr и –SCHMHN– расщепляются в спектре на два дублета дублетов с характерным «эффектом крыши» при δ 4,03 м.д., δ 4,09 м.д. и δ 3,71 м.д., δ 3,78 м.д., соответственно.
Синтез бромида 3b осуществлен также окислительной бромциклизацией соединения 1 по методу B, который заключается в получении брома реакцией избытка HBr (40 %) с H2O2 (3 %) непосредственно в реакционном сосуде и является более безопасным. Минорным продуктом в данной реакции, по данным ЯМР 1Н, является образующийся в виде гидробромида продукт присоединения брома, отличный от соединения 4 – бромид 5-[2-бром-1-(бромметил)этил]тио-4-метил-1,2,4-триазолия ( 5 ). Соотношение бромидов 3b и 5 составляет 1.00:0.14.
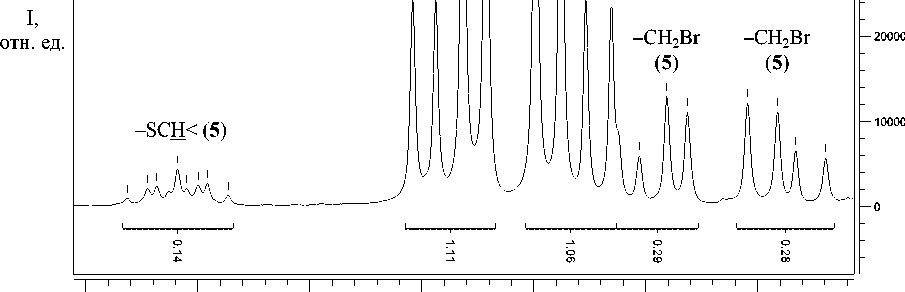
4.200 4.150 4.100 4.050 4.000 3.950 Химсдвиг м.д ppm (t1) ,
Сигналы протонов –SC H < и –CH 2 Br соединения 5 в спектре ЯМР 1Н
В спектре ЯМР 1Н (см. рисунок) мультиплет при δ 4,21 м.д. относится к протону –SC H < соединения 5 , а при δ 3,94 м.д. и δ 3,99 м.д. расположены дублеты дублетов с удвоенной интегральной интенсивностью (всего четыре протона), соответствующие четырем протонам двух групп –CH2Br. О существовании соединения 5 в солевой форме свидетельствует положение сигнала протона Н-3 в области слабого экранирования (δ 9,26 м.д.).
Образование соединений 3–5 можно объяснить протеканием реакции через промежуточное образование бромониевого иона ( I ). Атака нуклеофильного атома азота на β-атом углерода иона I (путь а ) сопровождается аннелированием пятичленного цикла и образованием бромида 3b . Однако бромониевый ион I , по-видимому, способен претерпевать рециклизацию при атаке трибро-мид-аниона на γ- атом углерода ( анти -присоединение) с образованием несимметричного продукта присоединения 4 (путь b ) либо внутримолекулярную перегруппировку в тиираниевый ион ( II ), который далее легко превращается в продукт присоединения симметричного строения 5 (путь с ). Внутримолекулярная перегруппировка бромониевого иона в тиираниевый ион впервые была исследована при бромировании метилаллилсульфида [14].
Бромирование соединения 1 исследовано нами также методом ЯМР 1Н-эксперимента: к его раствору в CDCl 3 был добавлен раствор полуторакратного избытка брома в CDCl 3 , и через 5 мин был зарегистрирован ЯМР 1Н спектр реакционной смеси. По-видимому, соединение 1 сразу
Органическая химия вступает в реакцию с бромом, о чем свидетельствует отсутствие в спектре характерных сигналов алкенильных протонов.
Неожиданные результаты получены нами при исследовании бромирования аллилсульфидов 2а (соотношение триазол 2а :бром, равное 1:1, АсОН, 0–5 °С) и 2b (соотношение триазол 2b :бром, равное 1:1.5, CHCl 3 , 0–5 °С) (схема 2). По данным ЯМР 1Н установлено, что соединения 2а и 2b реагируют с бромом в данных условиях с образованием смеси бромидов 6-бромметил-3-R-5,6-дигидро-1 H -[1,3]тиазоло[2,3- с ][1,2,4]триазолия ( 6a, b ) и 6-бром-3-R-1,5,6,7-тетрагидро[1,2,4]-триазоло[3,4- b ][1,3]тиазиния ( 7a, b ).
Соотношение бромидов 6а и 7а составляет 1,00:0,60. В смеси продуктов бромциклизации со-динения 2b преобладает триазолотиазин 7b (доля минорного бромида 6b составляет менее 10 %). Использование метода окислительной бромциклизации в системе HBr (40 %) – H2O2 (3 %) в реакции соединения 2b с бромом позволяет выделить в качестве главного продукта бромид 6b .
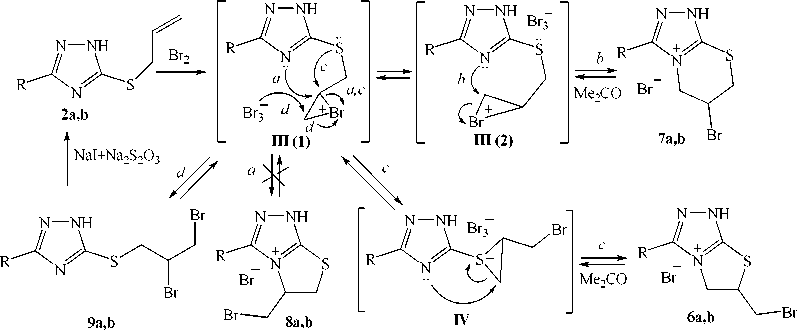
2,6-9 a R = Me, b R = CF3
Схема 2. Бромирование 3-аллилтио-5-R-1,2,4-триазолов (2a, b)
Промежуточной структурой в реакциях бромциклизации соединений 2а и 2b , на наш взгляд, является бромониевый ион ( III ), в зависимости от конформации которого возможны два направления для атаки нуклеофильного центра (атома азота): если атака осуществляется на β-атом углерода иона III (путь а , конформация III(1) ), то образуются пятичленные продукты бромциклиза-ции 8a,b , если же на γ-атом углерода (путь b , конформация III(2) ), то происходит аннелирование тиазинового цикла и образование соединений 7a,b .
Однако образование солей 8a, b в исследуемых реакциях не наблюдается, что связано с тем, что бромониевый ион III , вероятно, может претерпевать определенные структурные изменения, в результате чего образуется тиираниевый ион ( IV ) (путь с ), дальнейшая циклизация которого объясняет образование неожиданных продуктов 6a, b . О внутримолекулярной перегруппировке бро-мониевого иона в тиираниевый ион впервые упоминается в работе [15], в которой проводилось исследование бромирования метилаллилсульфида.
Продукты бромциклизации 6а и 7а были получены нами ранее в реакции 4-аллил-5-метил-1,2,4-триазол-3-тиона с бромом [16]. Их спектр ЯМР 1Н практически полностью идентичен спектру бромидов 6b и 7b (см. таблицу).
Экспериментальная часть
Спектры ЯМР 1Н растворов веществ в ДМСО- d6 записаны на спектрометре Bruker DRX-400 (400 МГц), внутренний стандарт ТМС.
Исходные 3-аллилтио-1,2,4-триазолы 1 и 2a,b синтезированы по методикам, описанным в работах [11–13].
Общая методика бромирования соединений 1 и 2а, b. Метод А. К раствору 1 ммоль ал-лилсульфида (1, 2a, b) в 3 мл растворителя (дихлорметан, ледяная уксусная кислота или хлороформ) добавляют по каплям при температуре 20–25 °С или 0–5 °С раствор 1 ммоль, 1,5 ммоль или 2 ммоль брома в 3 мл растворителя (дихлорметан, ледяная уксусная кислота или хлороформ). Через 1–5 суток отгоняют растворитель, остаток обрабатывают ацетоном, отфильтровывают об- разовавшийся осадок и промывают ацетоном. Выход 37 % (3b); 46 % (смесь 6а и 7а); 13 % (смесь 6b и 7b).
Метод B . К раствору 1 ммоль аллилсульфида ( 1 , 2b ) в 5 мл 40 %-го водного раствора HBr добавляют несколько капель (до помутнения) 3 %-го раствора H2O2. Через 1–5 суток отгоняют растворитель, остаток последовательно обрабатывают ацетоном и CH 2 Cl 2 , отфильтровывают образовавшийся осадок. Выход 0,170 г (смесь 3b и 5 ); 10 % (смесь 6b и 7b ).
Спектральные данные ЯМР 1Н синтезированных соединений приведены в таблице.
Спектральные данные ЯМР 1Н синтезированных соединений
|
Соединение |
Спектр ЯМР 1Н, δ, м.д. ( J , Гц) |
|
3b |
3,66 (3Н, с, 3-СН 3 ); 3,71 (1Н, д.д, 2 J MN = 14,15, 3 J MX = 6,94, –SC H M H N –); 3,78 (1Н, д.д, 2 J MN = 14,15, 3 J NX = 6,22, –SCH M H N –); 4,03 (1Н, д.д, 2 J AB = 11,21, 3 J AX = 5,69, –C H A H B Br); 4,09 (1Н, д.д, 2 J AB = 11,21, 3 J BX = 5,12, –CH A H B Br); 4,72 (1Н, м, –+NC H X –); 9,04 (1Н, с, Н-2) |
|
4 |
3,58 (3Н, с, 4-СН 3 ); 4,03 (2Н, д.д, 2 J = 10,99, 3 J = 4,89, –CH 2 Br); 3,84 (2Н, м, –SCH 2 –); 4,77 (1Н, м, –C H Br–); 8,56 (1Н, с, Н-5) |
|
5 |
3,71 (3Н, с, 4-СН 3 ); 3,94 (2Н, д.д, 2 J = 10,73, 3 J = 6,70, –CH 2 Br); 3,99 (2Н, д.д, 2 J = 10,71, 3 J = 4,57, –CH 2 Br); 4,21 (1Н, м, –SC H <); 9,26 (1Н, с, Н-3) |
|
6а |
2,61 (3Н, с, 3-СН 3 ); 3,98 (1Н, д.д, 2 J AB = 10,12, 3 J AX = 5,80, –C H A H B Br); 4,01 (1Н, д.д, 2 J AB = 10,12, 3 J BX = 8,00, –CH A H B Br); 4,46 (1Н, д.д, 2 J MN = 12,20, 3 J MX = 3,44, –NC H M H N –); 4,53 (1Н, д.д, 2 J MN = 12,20, 3 J NX = 7,35, –NCH M H N –); 5,08 (1Н, м, –SC H X –) |
|
6b |
3,99 (1Н, д.д, 2 J AB = 10,23, 3 J AX = 5,68, –C H A H B Br); 4,03 (1Н, д.д, 2 J AB = 10,23, 3 J BX = 7,13, – CH A H B Br); 4,32 (1Н, д.д, 2 J MN = 11,70, 3 J MX = 3,93, –NC H M H N –); 4,61 (1Н, д.д, 2 J MN = 11,70, 3 J NX = 7,84, –NCH M H N –); 5,11 (1Н, м, –SC H X –); 9,30 (1H, уш. с, NH) |
|
7a |
2,54 (3Н, с, 3-СН 3 ); 3,66 (1Н, д.д, 2 J АВ = 13,22, 3 J АX = 7,67, –SC H A H B –); 3,84 (1Н, д.д, 2 J АВ = 13,22, 3 J BX = 2,60, –SCH A H B –); 4,45 (1Н, д.д (в составе другого д.д), –NC H M H N –); 4,67 (1Н, д.д, 2 J MN = 13,62, 3 J NX = 3,94, –NCH M H N –); 5,18 (1Н, м, –C H X Br–) |
|
7b |
3,60 (1Н, д.д, 2 J АВ = 13,24, 3 J АX = 7,02, –SC H A H B –); 3,81 (1Н, д.д, 2 J АВ = 13,24, 3 J BX = 2,39, – SCH A H B –); 4,47 (1Н, д.д, 2 J MN = 13,47, 3 J MX = 5,70, –NC H M H N –); 4,73 (1Н, д.д, 2 J MN = 13,47, 3 J NX = 3,58, –NCH M H N –); 5,21 (1Н, м, –C H X Br–); 9,50 (1H, уш. с, NH) |
|
9a |
2,36 (3Н, с, 5-СН 3 ); 4,05 (2Н, д.д (в составе других д.д), –CH 2 Br); 3,65 (2Н, м, –SCH 2 –); 4,70 (1Н, м, –C H Br–) |
|
9b |
4,04 (2Н, д.д (в составе других сигналов), –CH 2 Br); 3,86 (2Н, м, –SCH 2 –); 4,73 (1Н, м, – C H Br–) |
Заключение
Установлено, что 3-аллилтио-4-метил-1,2,4-триазол взаимодействует с бромом с образованием продукта бромциклизации, бромида 6-бромметил-3-метил-5,6-дигидро[1,3]тиазоло[3,2- b ]-[1,2,4]триазолия, и продуктов присоединения брома по двойной связи аллильного фрагмента симметричного и несимметричного строения. Продуктами бромциклизации 3-аллилтио-5-метил-1,2,4-триазола и 3-аллилтио-5-трифторметил-1,2,4-триазола являются производные [1,3]тиазоло-[2,3- с ][1,2,4]триазолия, образование которых обусловлено механизмом реакции (изомеризацией бромониевого иона в тиираниевый ион), и [1,2,4]триазоло[3,4- b ][1,3]тиазиния. Предложен метод окислительной бромциклизации исследуемых S-аллильных производных в системе HBr–H2O2.
Список литературы Исследование бромциклизации S-аллильных производных 3-меркапто-1,2,4-триазолов
- Synthesis of novel sulfonamide-1,2,4-triazoles, 1,3,4-thiadiazoles and 1,3,4-oxadiazoles, as potential antibacterial and antifungal agents. Biological evaluation and conformational analysis studies/P. Zoumpoulakis, Ch. Camoutsis, G. Pairas et al.//Bioorg. Med. Chem. 2012. Vol. 20. No. 4. -P. 1569-1583.
- Studies on the synthesis and antibacterial activity of 3,6-disubstituted 1,2,4-triazolo[3,4-b]-1,3,4-thiadiazoles/T. Plech, M. Wujec, U. Kosikowska et al.//Eur. J. Med. Chem. 2013. Vol. 60. P. 128-134.
- Karthikeyan, M.S. Synthesis, analgesic, anti-inflammatory and antimicrobial studies of 2.4-dichloro-5-fluorophenyl containing thiazolotriazoles/M.S. Karthikeyan//Eur. J. Med. Chem. -2009. Vol. 44. No. 2. P. 827-833.
- Synthesis of Some New S-Alkylated 1,2,4-Triazoles, Their Mannich Bases and Their Biological Activities/M.M. Alam, S. Nazreen, S. Haider et al.//Arch. Pharm. Chem. Life Sci. 2012. -Vol. 345. No. 3. P. 203-214.
- Синтез производных 1H-1,2,4-триазола в условиях микроволнового облучения и их антигрибковая активность/B. Kahveci, M. Özil, E. Menteşe, O. Bekircan, K. Buruk//Ж. орган. химии. 2008. Т. 44. Вып. 12. С. 1843-1846.
- Synthesis, characterization and fungicidal activities of novel fluorinated 3,5-disubstituted-4H1.2.4-triazol-4-amines/M. Chen, X.-F. Wang, S.-S. Wang et al.//J. Fluorine Chem. 2012. Vol. 135. P. 323-329.
- Синтез и противоопухолевая активность некоторых бензофурилзамещенных 1,2,4-триазолов/М.А. Калдрикян, Л.А. Григорян, Р.Г. Мелик-Оганджанян, Ф.Г. Арсенян//Хим.-фарм. журнал. 2009. Vol. 43. No. 5. P. 11-13.
- Saji, V.S. A Review on Recent Patents in Corrosion Inhibitors/V.S. Saji//Recent Patents on Corrosion Science. 2010. No. 2. P. 6-12.
- Цицика, М.М. Броми иодциклизация некоторых аллил-1,2,4-триазолинтионов-3/М.М. Цицика, С.М. Хрипак, И.В. Смоланка//Укр. Хим. Журн. 1976. Т. 42. № 8. С. 841-842.
- Усенко, Р.Н. Электрофильная гетероциклизация 4,5-дизамещенных 3-аллилтио-4H-1,2,4-триазолов при действии галогенов/Р.Н. Усенко, М.В. Сливка, В.Г. Лендел//Химия гетероцикл. соединений. 2011. No. 8. C. 1248-1257.
- Ильиных, Е.С. Иодциклизация S-аллильных производных 3-меркапто-4-метил-1,2,4-триазола/Е.С. Ильиных, Д.Г. Ким//Химия гетероцикл. соединений. 2011. No. 5. P. 766-769.
- Ильиных, Е.С. Исследование иодциклизации S-аллильных производных 3-меркапто1.2.4-триазолов/Е.С. Ильиных, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». 2010. Вып. 4. -№ 31. С. 18-23.
- Synthesis of novel fluorineand iodine-containing [1,2,4]triazolo[3,4-b]-[1,3]thiazines based 3-(alkenylthio)-5-(trifluoromethyl)-4H-1,2,4-triazole-3-thiols/E.S. Il’inykh, D.G. Kim, M.I. Kodess et al.//J. Fluorine Chem. 2013. Vol. 149. P. 24-29.
- Химия органических соединений серы. Общие вопросы/под ред. Л.И. Беленького. М.: Химия, 1988. С. 227-229.
- Bland, J.M. An Intramolecular Bromonium to Thiiranium Ion Rearrangement/J.M. Bland, C.H. Stammer//J. Org. Chem. 1983. Vol. 48. No. 23. P. 4393-4394.
- Ким, Д.Г. Новый пример дигидротиазин-тиазолиновой перегруппировки при бромировании 4-аллил-5-метил-1,2,4-триазол-3-тиона/Д.Г. Ким, Е.С. Ильиных//Химия гетероцикл. соединений. 2011. No. 4. P. 631-632.


