Исследование церебропротективных эффектов ренальной денервации по данным магнитно-резонансной томографии у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
Автор: Фальковская А.Ю., Сухарева А.Е., Пекарский С.Е., Зюбанова И.В., Манукян М.А., Цой Е.И., Хунхинова С.А., Вторушина А.А., Мордовин В.Ф.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.37, 2022 года.
Бесплатный доступ
Цель исследования: оценить изменение субклинических МРТ-признаков повреждения головного мозга во взаимосвязи с динамикой артериального давления (АД), провоспалительных цитокинов и состояния эндотелиальной функции через один год после ренальной денервации (РДН) у больных резистентной артериальной гипертензией (РАГ) в сочетании с сахарным диабетом (СД) 2-го типа.Материал и методы. В проспективном интервенционном исследовании (рег. номера на сайте ClinicalTrial.gov NCT02667912 и NCT01499810) проанализированы данные 39 больных РАГ в сочетании с СД 2-го типа, имевших качественные МРТ-изображения головного мозга. Всем больным проводили суточное мониторирование АД, МРТ головного мозга (1,5 T), измерение в сыворотке крови уровня высокочувствительного С-реактивного белка (вчСРБ), пробу с реактивной гиперемией на плечевой артерии. Пациенты принимали в среднем 4,5 (3-6) антигипертензивных препаратов и были проинструктированы не менять режим терапии на протяжении исследования. Год наблюдения завершили 29 больных.Результаты. Через год после РДН отмечено существенное снижение средних значений среднесуточного АД (систолического/диастолического (САД-ДАД-24) (на 12 [95% ДИ от 4,1 до 19,8]/5,9 [95% ДИ от 0,4 до 11,3] мм рт. ст., p = 0,004/0,038), значимое возрастание степени эндотелий-зависимой вазодилатации (ЭЗВД) (p = 0,008) и снижение уровня вчСРБ (p = 0,04). Доля лиц со снижением САД-24 ≥ 10 мм рт. ст. составила 57%, целевой уровень АД достигнут у 38% больных. Значимых изменений показателей МРТ-признаков повреждения головного мозга (размеров ликворных пространств, степени повреждений белого вещества (ПБВ) в перивентрикулярной области (ПВО), интенсивности МР-сигнала в области базальных ядер и ПВО, частоты фокальных повреждений головного мозга и лакунарных инфарктов, общей выраженности церебральных повреждений) не выявлено, за исключением уменьшения степени ликвородинамических расстройств. Регресс или стабилизация степени ПБВ в ПВО отмечены у 24 человек (86%). Зависимости динамки ПБВ от изменения АД, ЭЗВД и вчСРБ не обнаружено.Заключение. РДН у больных РАГ в сочетании с СД 2-го типа позволяет в подавляющем большинстве случаев лимитировать повреждения белого вещества головного мозга и уменьшить выраженность ликвородинамических расстройств в течение одного года наблюдения. Церебропротективное действие процедуры не имеет прямой связи с динамикой АД, провоспалительных цитокинов и состояния эндотелиальной функции.
Резистентная артериальная гипертензия, сахарный диабет 2-го типа, магнитно-резонансная томография головного мозга, повреждения белого вещества головного мозга, субклинические церебральные изменения, ренальная денервация, церебропротекция
Короткий адрес: https://sciup.org/149140501
IDR: 149140501 | УДК: 616.136.7-072.1-089:[616.12-008.331.1:616.379-008.64]-073.86 | DOI: 10.29001/2073-8552-2022-37-2-74-83
Текст научной статьи Исследование церебропротективных эффектов ренальной денервации по данным магнитно-резонансной томографии у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
informed consent was obtained from all patients. The study was approved by the Ethics Committee of Cardiology Research Institute of Tomsk NRMC (protocol No. 139 from 18.11.2015). Falkovskaya A.Yu., Sukhareva A.E., Pekarskiy S.E., Zyubanova I.V., Manukyan M.A., Tsoi E.I., Khunkhinova S.A., Vtorushina A.A., Mordovin V.F. MRI study of cerebroprotective effects of renal denervation in patients with resistant hypertension and type 2 diabetes mellitus. The Siberian Journal of Clinical and Experimental Medicine. 2022;37(2):74–83. https://doi. org/10.29001/2073-8552-2022-37-2-74-83.
Острые нарушения мозгового кровообращения продолжают оставаться лидирующей причиной длительной нетрудоспособности взрослого населения и пятой причи- ной всех смертей, уступая лишь болезням сердца, раку, хроническим заболеваниям нижних дыхательных путей и несчастным случаям [1]. Наиболее значимая роль в развитии мозговых инсультов принадлежит артериальной гипертензии (АГ) [1]. Коморбидность АГ с сахарным диабетом (СД) почти в 2 раза увеличивает все кардиоваскулярные риски [2], а также риски мозговых катастроф [3], которые у этих больных протекают тяжелее, приводят к более выраженным неврологическим последствиям и характеризуются длительным периодом реабилитации. Возникновению церебральных инсультов предшествуют выявляемые при проведении нейровизуализирующих исследований субклинические структурные изменения, которые также ассоциируются и с когнитивными нарушениями [4], но при этом считаются потенциально обратимыми [5]. В связи с этим разработка эффективных стратегий церебропротекции относится к числу одних из наиболее актуальных направлений биомедицинских исследований, направленных на снижение риска церебральных осложнений и сохранение когнитивного здоровья. Контроль артериального давления (АД) уменьшает выраженность МРТ-признаков церебральных повреждений [5]. Однако следует признать, что фармакотерапия далеко не всегда позволяет достигнуть нормализации АД, и это в определенной степени обусловлено общей проблемой фармакотерапии в виде низкой приверженности пациентов к пожизненному приему препаратов [6, 7]. Вместе с тем распространенность истинных форм резистентной АГ (РАГ), по данным эпидемиологических исследований, составляет около 10%, а ее наличие ассоциируется с крайне неблагоприятным кардиоваскулярным прогнозом [8]. Одним из наиболее эффективных способов лечения РАГ признана ренальная денервация (РДН). Эта процедура доказала свою антигипертензивную эффективность [9, 10], а также протективное влияние в отношении сердца, почек [11] и сосудистой стенки [12]. Вместе с тем сведения о церебропротективных эффектах РДН весьма ограничены и практически отсутствуют для селективной группы больных РАГ в сочетании с СД 2-го типа. В настоящее время получены убедительные доказательства того, что существенное значение в патогенезе цереброваскулярных осложнений принадлежит повышенной активности симпатоадреналовой системы [13], хроническому низкоинтенсивному воспалению [14] и эндотелиальной дисфункции [14]. В связи с этим наличие у РДН дополнительных к симпатолитиче-скому действию плейотропных эффектов в виде подавления хронического низкоинтенсивного воспаления и улучшения функции сосудистого эндотелия [12] может усиливать благоприятное влияние данной процедуры на структурное состояние головного мозга. В соответствии с этой концепцией в основу исследования положена гипотеза о том, что РДН у больных РАГ в сочетании с СД 2-го типа сопровождается положительным влиянием на структуру головного мозга, позволяя уменьшить выраженность церебральных повреждений или ограничить их дальнейшее прогрессирование.
Цель исследования: оценить изменение субклинических МРТ-признаков повреждения головного мозга во взаимосвязи с динамикой АД, провоспалительных цитокинов и состояния эндотелиальной функции через один год после РДН у больных РАГ в сочетании с СД 2-го типа.
Материал и методы
Данное исследование является подисследованием проспективных интервенционных исследований (рег. номера на сайте ClinicalTrial.gov NCT02667912 и NCT01499810), в котором проанализированы данные 39 больных РАГ в сочетании с СД 2-го типа, имевших каче- ственные МРТ-изображения головного мозга. Исследование было одноцентровым одновыборочным проспективным интервенционным. Набор пациентов проходил в отделении артериальных гипертоний НИИ кардиологии Томского НИМЦ с марта 2010 г. по декабрь 2018 г. В исследование включали лиц обоего пола в возрасте от 18 до 80 лет, подписавших информированное согласие. Критериями исключения были: 1) псевдорезистентность; 2) вторичная АГ; 3) СД 1-го типа; 4) уровень гликированного гемоглобина HbA1с > 10%; 5) расчетная скорость клубочковой фильтрации (рСКФ) < 30 мл/мин/1,73м2; 6) беременность; 7) перенесенные менее года назад острые сосудистые осложнения; 8) нестабильная стенокардия; 9) хроническая сердечная недостаточность выше II функционального класса по классификации Нью-Йоркской ассоциации сердца (NYHA); 10) тяжелые сопутствующие заболевания; 11) диаметр почечной артерии менее 3 мм.
Клиническая характеристика обследованных пациентов отражена в таблице 1.
Таблица 1. Клиническая характеристика больных (( M ± SD ), n (%))
Table 1. Baseline clinical characteristics of patients ( M ± SD, n (%))
|
Показатели / Parameters |
n = 39 |
|
Возраст, лет Age, years |
60,2 ± 7 |
|
Мужской пол Male |
16 (41) |
|
Известная продолжительность АГ, лет Known duration of hypertension, years |
23 ± 10,5 |
|
Известная продолжительность СД, лет Known duration of diabetes mellitus, years |
10 ± 6,1 |
|
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
34,9 ± 6,1 |
|
Ишемическая болезнь сердца Coronary heart disease |
24 (62) |
|
Инсульт в анамнезе History of stroke |
7 (18) |
|
Гипертрофия левого желудочка Left ventricular hypertrophy |
37 (95) |
|
Абдоминальное ожирение Abdominal obesity |
31 (82) |
|
Атеросклероз сонных артерий Carotid atherosclerosis |
35 (92) |
|
Степень стенозирования сонных артерий, % The degree of carotid arteries stenosis, % |
22 ± 10 |
|
Гликемия натощак, ммоль/л Fasting glycemia, mmol/L |
8,9 ± 2,7 |
|
HbA1c, % |
7,4 ± 1,4 |
|
рСКФ (формула CKD-EPI), мл/мин/1,73 м2 eGFR (CKD-EPI formula), mL/min/1.73 m2 |
72,2 ± 21,8 |
|
АД-24, мм рт. ст. (систолическое/диастолическое) BP-24, mm Hg (systolic/diastolic) |
157 ± 16/ 80 ± 12 |
|
Количество антигипертензивных препаратов Number of antihypertensive drugs |
4,5 (36) |
Примечание: АГ – артериальная гипертензия, СД – сахарный диабет, HbA1c – гликозилированный гемоглобин, СКФ – скорость клубочковой фильтрации, АД-24 – среднесуточное артериальное давление. Количество антигипертензивных препаратов представлено в виде Me и крайних значений.
Note: HbA1c – glycosylated hemoglobin, eGFR – estimated glomerular filtration rate, BP-24 – 24-hour blood pressure, M ± SD – mean and standard deviation, n – the number of patients. The number of antihypertensive drugs is presented as Me and extreme values.
Антигипертензивная терапия в обследованной популяции включала диуретики ( n = 39, 100%), блокаторы ренин-ангиотензиновой системы ( n = 36, 92%), бета-блокаторы ( n = 30, 78%), антагонисты кальция ( n = 28, 72%), верошпирон ( n = 16, 41%), агонисты имидазолиновых рецепторов ( n = 11, 28%) и альфа-блокаторы ( n = 5, 13%). Для контроля гликемии диетотерапию использовали 3 человека (8%), препараты сульфонилмочевины принимали 9 больных (23%), метформин – 13 человек (33%), его комбинацию с инсулином – 12 пациентов (31%). Всем больным назначались статины.
Непосредственно до вмешательства и через год наблюдения проводили общеклинические исследования, МРТ головного мозга, измерение офисного АД, амбулаторное мониторирование АД (АМАД), а также рутинные лабораторные тесты (измерение уровня гликемии и гликированного гемоглобина (HbA1c)).
МРТ головного мозга выполняли на аппарате Titan Vantage (Toshiba Medical 1,5 Тесла), толщина срезов – 3–5 мм. Для срезов использовали три плоскости: аксиальную, сагиттальную и фронтальную. Применяли Т1 и Т2 режимы с импульсной последовательностью Spin-Echo. Параметры Т1-взвешенных изображений в аксиальной и сагиттальной плоскостях: TR = 450 мс, TE = 15 мс, угол a = 70°. Параметры Т2-изображений в аксиальной плоскости: TR = 6000 мс, TE = 117 мс. По результатам МРТ определяли признаки внутричерепной гипертензии, ликвородинамических нарушений и участки цереброваскулярной ишемии в виде фокальных повреждений белого вещества (ПБВ) и лакунарных инфарктов. Фокальными ПБВ головного мозга признавали очаги гиперинтенсивные в режиме Т2 и без снижения интенсивности МР-сигнала в Т1-изображениях (по типу локального отека как следствие увеличения проницаемости сосудистой стенки) размерами от 3 до 15 мм. За лакунарные инфаркты принимали очаговые изменения вещества головного мозга с гиперинтенсивностью МР-сигнала в Т2-режиме и гипоинтенсивностью в Т1 – признаками кистозной трансформации вещества мозга, размерами от 5 до 15 мм. При измерении интенсивности МР-сигнала в проекции базальных ядер (головка хвостатого ядра, таламус и скорлупа с двух сторон) лакунарные инфаркты при их наличии в зону измерения не включали. Признаками внутричерепной гипертензии считали ПБВ в перивентрикулярной области (ПВО) и расширения борозд больших полушарий головного мозга. Распространенность и выраженность ПБВ в ПВО оценивали по пятиступенчатой классификации [16]. При определении степени нарушений ликвородинамики учитывали наличие или отсутствие расширения желудочков и субарахноидальных пространств: 1-я степень соответствовала расширению боковых желудочков мозга (БЖ) или субарахноидальных пространств (САП); 2-ю степень документировали при сочетанном расширении БЖ и САП. За пороговые значения нормальных размеров принимали ширину боковых желудочков не более 1,5 см, а поперечного размера субарахноидальных пространств не более 0,25 см. Поперечные размеры тел, передних и задних рогов БЖ, тела третьего желудочка и САП измеряли во фронтальных, париетальных и окципитальных областях в аксиальной плоскости в Т2- режиме. Выраженность МРТ-изменений головного мозга оценивали в баллах: наличие признака соответствовало 1 баллу, его отсутствие – 0. Степень нарушений ликвородинамики определяли суммой баллов расширения желудочков и субарахноидальных пространств. Выраженность внутричерепной гипертензии суммировали из результатов визуальной оценки наличия ПБВ в ПВО и расширения борозд. Суммарный показатель выраженности МРТ-признаков повреждения головного мозга складывался из суммы баллов, полученных при качественной оценке степени нарушения ликвородинамики, внутричерепной гипертензии и очагов ишемии. Сумма баллов от 1–3 соответствовала минимальным проявлениям, 4–5 баллов – умеренным, а 6–8 баллов – выраженным изменениям.
АД (систолическое/диастолическое – САД/ДАД) во время врачебного приема измеряли по стандартной методике, АМАД проводили с использованием компьютерных систем ABPM-04 («Meditech», Венгрия) и ВрLab (ООО «Петр Телегин», Россия). Методом оценки приверженности пациента к лечению служил опрос. Больным рекомендовали не менять режим антигипертензивной и сахароснижающей терапии в течение всего исследования.
Эндотелиальную функцию оценивали по пробе с реактивной гиперемией на плечевой артерии, предложенной D. Celermajer и соавт., широкополосными датчиками (1,7–3,4 или 2–4 МГц) по стандартной методике на ультразвуковой диагностической системе экспертного класса (Philips EnVisor, Нидерланды).
Концентрацию в сыворотке крови высокочувствительного С-реактивного белка (вчСРБ) определяли наборами Biomerica (Германия).
Ренальную денервацию проводили четырьмя видами аблационных катетеров: 1) Symplicity Fleх4F с генератором Symplicity TM G2 (Medtronic, США, n = 21); 2) MarinR 5F с генератором ATAKR-II (Medtronic, США, n = 12, температура концевого электрода от 50 до 60 °C); 3) Vessix Reduce (Boston Scientific Corporation, n = 4); 3) Symplicity Spyral (Medtronic, США, n = 4).
Через год потери наблюдения составили 10 человек (3 отзыва согласия, 1 несердечно-сосудистая смерть, у 2 пациентов срок наблюдения составил менее 1 года, 2 человека не смогли приехать в центр, у 2 больных отсутствовали качественные изображения МРТ головного мозга).
Исследование соответствовало положениям Хельсинкской декларации и было одобрено комитетом по биомедицинской этике НИИ кардиологии Томского НИМЦ (выписка из протокола № 139 от 18.11.2015 г.).
Для статистического анализа полученных данных использовали пакет программ STATISTICA 10.0 for Windows. Проверку согласия с нормальным законом распределения признаков проводили с помощью критерия Шапиро – Уилка. Нормально распределенные количественные показатели представлены средними значениями и стандартными отклонениями ( M ± SD ), при отсутствии нормального распределения – медианами ( Me ) и межквартильными интервалами ( Q1; Q3 ). Категориальные показатели описаны абсолютными и относительными (в %) частотами встречаемости. При нормальном распределении показателей проводили сравнительный анализ количественных показателей до и год спустя после РНД с помощью критерия Стьюдента для связанных выборок, при отсутствии нормальности – с помощью критерия Уил-коксона. В случае применения критерия Стьюдента «размер эффекта» вмешательства определяли как модуль разности средних значений показателей. При сравнении дихотомических показателей до и через год после РНД выполняли анализ таблиц сопряженности по критерию
Мак-Нимара. За критический уровень значимости p принимали 0,05. Анализ проведен в зависимости от назначенного лечения («intention to treat»). Дополнительный анализ для реконструкции данных пациентов, не завершивших исследование, не выполняли.
Результаты
Через год после РДН имел место значимый и стабильный антигипертензивный ответ. Офисное АД (САД/ДАД) снизилось на 27,6 мм рт. ст. [95% ДИ от 19 до 36,1] /13,5 мм рт. ст. [95 % ДИ от 7 до 20 мм рт. ст.], p = 0,001/0,001. Степень снижения среднесуточного АД (АД-24) составила 12 мм рт.ст. [95% ДИ от 4,1 до 19,8 мм рт. ст.] / 5,9 мм рт. ст. [95% ДИ от 0,44 до 11,3 мм рт. ст.], p = 0,004/0,038. У 57% САД-24 снизилось на 10 и более мм рт. ст., целевой уровень АД достигнут у 38% больных. Случаев симптом- ной гипотонии, потребовавшей уменьшения количества антигипертензивных препаратов, не было отмечено ни в одном случае. Дополнительно было документировано повышение степени эндотелий-зависимой вазодилатации (ЭЗВД) (от 2,7 ± 5,3 до 7,4 ± 4,7%; p = 0,008) и снижение уровня вчСРБ (от 4,5(1,0;8,0) до 2,6 (0,8;3,0) мг/л, p = 0,04). Изменения со стороны показателей углеводного обмена (HbA1c, базальная и постпрандиальная гликемия) отсутствовали (p > 0,05). Прогрессирования степени каротидного атеросклероза выявлено не было (p > 0,05)
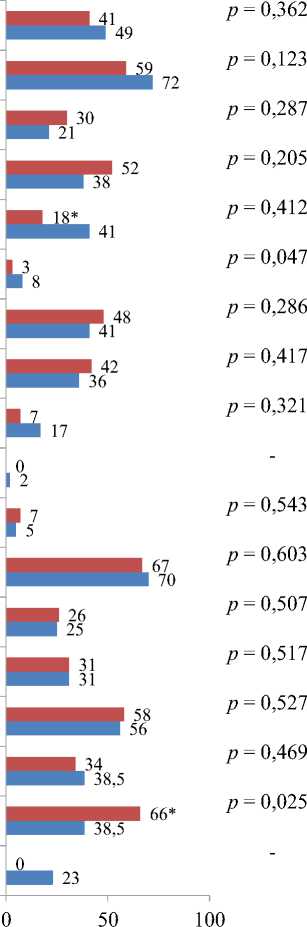
По данным МРТ головного мозга изменений частоты расширения желудочков и субарахноидальных пространств не произошло, однако доля пациентов со 2-й степенью нарушений ликвородинамики уменьшилась почти в 2 раза (рис. 1).
Расширение желудочков Expansion of the ventricles
Расширение САП Expansion of subarachnoidal spaces
Отсутствие НЛД No LD
1-я степень НЛД 1th degree of LD
2-я степень НЛД degree of LD Отсутствие ПБВ в ПВО No PWMLs
1-я степень ПБВ в ПВО 1th degree of PWMLs
2-я степень ПБВ в ПВО 2nd degree of PWMLs
3-я степень ПБВ в ПВО 3rd degree of PWMLs
4-я степень ПБВ в ПВО
4th degree of PWMLs
Отсутствие ВЧГ No intracranial hypertension
1-я степень ВЧГ
1th degree of intracranial hypertension
2-я степень ВЧГ
2nd degree of intracranial hypertension Лакунарные инфаркты Lacunar infarcts
Фокальные ПБВ Focal WMLs
Лёгкая степень МРТ-изменений Mild MRI-score of brain damage
Умеренная степень МРТ-изменений Moderate MRI-score of brain damage
Выраженная степень МРТ-изменений Severe MRI-score of brain damage
- после
- after
- до
- before
Рис. 1. Сравнение частоты МРТ-при-знаков церебральных изменений исходно и после ренальной денервации (%)
Примечание: МРТ – магнитно-резонансная томография, САП – субарахноидальные пространства, НЛД нарушения ликвородинамики, ПБВ – в ПВО – повреждения белого вещества в перивентрикулярной области, ВЧГ – внутричерепная гипертензия.
Fig. 1. Comparative frequency of MRI signs of cerebral damage at baseline and after renal denervation (%)
Note: LD – liquorodynamic disorders, MRI – magnetic resonance imaging, PWMLs – periventricular white matter lesions, WMLs – white matter lesions.
Частота встречаемости разных степеней ПБВ в ПВО в течение всего исследования существенно не изменилась. Увеличения количества лакунарных инфарктов и фокальных повреждений белого вещества также выявлено не было. Доля лиц с умеренной выраженностью церебральных повреждений значимо возросла, что было обусловлено переходом в данную группу большинства пациентов из группы с выраженной степенью повреждения, которой через год наблюдения не было ни у одного больного. Вместе с тем общая выраженность церебральных повреждений не изменилась (исходно 3,2 ± 1,4; через год 2,9 ± 1,6 балла, p = 0,31). Значимых изменений размеров ликворных пространств и интенсивности МР-сигнала в области базальных ядер также не обнаружено (табл. 2, 3).
Таблица 2. Показатели ликвородинамики и интенсивности МР-сигнала в области базальных ядер исходно и после ренальной денервации ( M ± SD )
Table 2. Parameters of liquorodynamics and intensity of magnetic resonance signal in the area of basal ganglia before and after renal denervation ( M ± SD )
|
Показатели Parameters |
Исход Baseline |
12 мес. 12 months |
p |
|
Желудочки мозга Brain ventricles |
|||
|
Тело БЖ, см* / Corpus of LV, cm* |
0,76 ± 0,34 |
0,81 ± 0,31 |
0,85 |
|
Передний рог БЖ, см* Anterior horn of LV, cm* |
0,60 ± 0,41 |
0,58 ± 0,3 |
0,84 |
|
Задний рог БЖ, см* Posterior horn of LV, cm* |
1,1 ± 0,3 |
1,2 ± 0,36 |
0,95 |
|
III жел. длина × ширина, см Third ventricle, length × width, cm |
2,6 ± 0,6 × 0,7 ± 0,4 |
2,7 ± 0,4×0,7 ± 0,4 |
0,28/0,91 |
|
IV жел., длина × ширина, см Forth ventricle, length × width, cm |
2,4 ± 0,7 × 0,9 ± 0,2 |
2,3 ± 0,7 × 0,9 ± 0,3 |
0,68/0,81 |
|
ХЦ, длина × ширина, см CC, length × width, cm |
1,3 ± 1,3 × 0,7 ± 0,3 |
1,1 ± 0,9 × 0,6 ± 0,3 |
0,72/0,43 |
|
ПМЦ, длина × ширина, см PBC, length × width, cm |
3,7 ± 3,1 × 0,6 ± 0,2 |
3,0 ± 0,5 × 0,6 ± 0,2 |
0,36/0,87 |
|
КГЦ, длина × ширина, см QGC, length × width, cm |
1,8 ± 0,4 × 0,7 ± 0,3 |
1,7 ± 0,2 × 0,8 ± 0,3 |
0,41/0,73 |
|
Субарахноидальные пространства Subarachnoidal spaces |
|||
|
Париетальная область, см* Parietal area, cm* |
0,35 ± 0,21 |
0,29 ± 0,15 |
0,313 |
|
Затылочная область, с* Occipital area, cm* |
0,18 ± 0,12 |
0,16 ± 0,08 |
0,402 |
Примечание: БЖ – боковой желудочек, жел. желудочек, ХЦ – хиазмальная цистерна, ПМЦ – предмостовая цистерна, КГЦ – квадригеминальная цистерна, * указаны средние значения для правой и левой сторон головного мозга.
Note: LV – lateral ventricle, CC – chiasmal cistern, PBC – pre-bridge cistern, QGC – quadrigeminal cistern, * – average values for the right and the left side of the brain.
Таблица 3. Показатели интенсивности средней интенсивности Т2-сигнала в области базальных ядер по данным магнитно-резонансной томографии исходно и после ренальной денервации ( M е ( Q1; Q3 ))
Table 3. Values of average T2 signal intensity in the region of basal ganglia according to MRI at baseline and after renal denervation
( Me ( Q1; Q3 ))
|
Показатели Parameters |
Исход Baseline |
12 мес. 12 months |
p |
|
Головка хвост. ядра Head of caudate nucleus |
567,1 (503,2; 1777,1) |
453,4 (506; 598,3) |
0,831 |
|
Скорлупа / Shell |
653,8 (492,4; 1528,3) |
534,5 (462,8; 1067,1) |
0,522 |
|
Таламус/Thalamus |
382,6 (444,8; 1778,9) |
490,8 (450,6; 715,3) |
0,286 |
Примечание: хв. – хвостатое; представлены усредненные данные для обеих сторон.
Note: average values for the right and left sides of the brain.
Индивидуальный анализ степени ПБВ в ПВО показал, что у подавляющего большинства больных она осталась прежней (n = 15, 55%), у 9 человек (31%) степень ПБВ уменьшилась, и у 4 больных (14%) было отмечено дальнейшее прогрессирование ПБВ. Прямой зависимости изменения степени ПБВ от выраженности снижения АД, повышения ЭЗВД или снижения уровня вчСРБ после РДН не отмечено. Кроме того, зависимости динамики ПБВ в ПВО от тяжести СД, спектра и интенсивности сахароснижающей терапии также не обнаружено. Небольшое количество больных с прогрессированием ПБВ (n = 4) не позволило провести корректный сравнительный анализ этой группы с пациентами без прогрессирования и обратным развитием ПБВ.
Обсуждение
Поскольку головной мозг относится к органам-мишеням при АГ, возможность ограничивать или даже вызывать обратное развитие структурных церебральных изменений относится к несомненным благоприятным эффектам лечения. В настоящее время МРТ стала доступным инструментом не только выявления ранних структурных изменений и прогнозирования церебральных осложнений [17], но способом мониторирования эффективности терапии. Согласно накопленным данным, полнота реализации церебропротективных эффектов антигипертензивного лечения в значительной степени определяется не только степенью снижения АД, но и исходной выраженностью АГ. Так, фармакологическая супрессия симпатического тонуса бета-блокаторами у больных контролируемой АГ позволяет значимо уменьшить размеры ликворных пространств пропорционально степени снижения АД, а также выраженность ПБВ [5]. Наша работа стала одной из первых, оценивших влияние РДН на структуру головного мозга по данным МРТ у больных СД 2-го типа с тяжелыми формами АГ, устойчивыми к медикаментозной терапии. В соответствии с нашими результатами через год после вмешательства, несмотря на выраженное снижение АД, уменьшение степени хронического низкоинтенсивного воспаления и улучшение сосудодвигательной функции эндотелия периферических артерий, уменьшения выраженности ПБВ в ПВО отмечено не было. Это может отражать малую обратимость сформировавшихся церебральных повреждений у данной категории больных. Тем не менее, отсутствие у большинства пациентов дальнейшего прогрессирования ПБВ, которое рассматривается в качестве паттерна мозговой атрофии, предиктора мозгового инсульта и когнитивных нарушений [4], может служить косвенным подтверждением церебропротективного потенциала РДН. Гистологической основой повреждений белого вещества считают очаги ишемии и глиоза, немых инфарктов, а также накопление жидкости в экстрацеллюлярном пространстве, а их патогенез у больных с АГ и СД достаточно сложен и включает повреждающее влияние как гемодинамических, так и метаболических факторов, ускоряющих процессы нейронального повреждения [3]. В данном контексте сохранение негативного воздействия гипергликемии могло ограничивать протективное влияние РДН в отношении тканей головного мозга. Более того, формирование под влиянием длительно существующей гипергликемии «метаболической памяти» может запускать эффект «домино» в виде прогрессирующего сосудистого повреждения и периваскулярного фиброза [18]. Именно этим феноменом во многом объясняют сохранение высокого риска сердечно-сосудистых осложнений даже при достижении удовлетворительного гликемического контроля. В данном патофизиологическом контексте стабилизация сформировавшихся структурных нарушений вполне обоснованно может рассматриваться как протективный эффект лечения.
Отсутствие повышения интенсивности МР-сигнала от области базальных ядер также в определенной мере исключает нарастание церебральной ишемии, которая наряду с пропитыванием перивазальных пространств жидкостью при нестабильности гемодинамики считается наиболее частой причиной усиления МР-сигнала в этой зоне.
Что касается литературных данных о влиянии РДН на структуру головного мозга, то они весьма немногочисленны и ограничены преимущественно больными РАГ без сопутствующих нарушений углеводного обмена [19]. Вместе с тем коморбидность АГ с СД значимо изменяет патофизиологию повреждения мозговой ткани [3], поэтому сравнивать наши результаты с ранее выполненными работами не представляется корректным.
Другим, не менее важным аспектом, имеющим клиническую значимость, являются вопросы безопасности лечения, поскольку быстрое и выраженное снижение АД в условиях нарушенной ауторегуляции, ремоделирования сосудистого русла, а также ограниченности анастомозов и коллатералей, питающих кортикальные и перивентри-кулярные области, способно уменьшить мозговую перфузию и привести к ишемическим повреждениям. Отсутствие прогрессирования церебральных повреждений после РДН подтверждает безопасность вмешательства для данной категории больных.
Таким образом, РДН у больных резистентной АГ в сочетании с СД 2-го типа позволяет в подавляющем большинстве случаев лимитировать повреждения белого вещества головного мозга и уменьшить выраженность ликвородинамических расстройств в течение одного года наблюдения. Церебропротективное действие процедуры не имеет прямой связи с динамикой АД, провоспали-тельных цитокинов и состояния эндотелиальной функции. Важно отметить, что эти благоприятные эффекты могут значительно расширить возможности использования РДН.
Среди ограничений исследования следует выделить небольшой размер выборки, отсутствие группы контроля, относительно короткий срок наблюдения и оценку приверженности к лечению по данным опроса.
Предметом дальнейших исследований может служить оценка церебропротективных эффектов РДН на большем количестве больных в течение более длительного периода наблюдения, в сравнении с больными РАГ без СД, а также изучение взаимосвязи изменения церебральных повреждений с динамикой цереброваскулярной реактивности. Следует также отметить перспективность исследования церебропротективных возможностей анатомически оптимизированной денервации дистальных ветвей почечных артерий, которая продемонстрировала более значимое в сравнении со стандартным вмешательством антигипертензивное влияние [20]. Кроме того, областью актуальных исследовательских задач по-прежнему остается выявление предикторов реализации церебропротек-тивной эффективности процедуры.
Список литературы Исследование церебропротективных эффектов ренальной денервации по данным магнитно-резонансной томографии у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2-го типа
- Virani S.S., Alonso A., Aparicio H.J., Benjamin E.J., Bittencourt M.S., Callaway C.W. et al. Heart Disease and Stroke Statistics-2021 Update: A Report From the American Heart Association. Circulation. 2021;143(8):e254-e743. https://doi.org/10.1161/CIR.0000000000000950.
- Васильцева О.Я., Ворожцова И.Н., Крестинин А.В., Cтефанова Е.В., Карпов Р.С. Влияние основной нозологической патологии и выбранной врачебной стратегии на исход тромбоэмболии легочной артерии. Кардиология. 2017;1:37-41. https://doi.org/10.18565/cardio.2017.1.37-41.
- Alloubani A., Saleh A., Abdelhafiz I. Hypertension and diabetes mellitus as a predictive risk factors for stroke. Diabetes Metab. Syndr. 2018;12(4):577-584. https://doi.org/10.1016/j.dsx.2018.03.009.
- Debette S., Schilling S., Duperron M.G., Larsson S.C., Markus H.S. Clinical significance of magnetic resonance imaging markers of vascular brain injury: A systematic review and meta-analysis. JAMA Neurol. 2019;76(1):81-94. https://doi.org/10.1001/jamaneurol.2018.3122.
- Мордовин В.Ф., Белокопытова Н.В., Фальковская А.Ю., Ефимова И.Ю. Гипотензивная эффективность и церебропротективные свойства карведилола у больных артериальной гипертонией, ассоциированной с сахарным диабетом 2-го типа. Кардиология. 2007;47(10):31-36.
- Burnier M., Egan B.M. Adherence in hypertension. Circ. Res. 2019;124(7):1124-1140. https://doi.org/10.1161/CIRCRESAHA.118.313220.
- Серебрякова В.Н., Головина Е.А., Кавешников А.В., Кавешников В.С. Частота назначения и приверженность лечению статинами у амбулаторных больных с сахарным диабетом 2 типа и коморбидной сердечно-сосудистой патологией. Сахарный диабет. 2020;23(5):434-441. https://doi.org/10.14341/DM12563.
- Kasiakogias A., Tsioufis C., Dimitriadis K., Konstantinidis D., Koumelli A., Leontsinis I. et al. Cardiovascular morbidity of severe resistant hypertension among treated uncontrolled hypertensives: A 4-year follow-up study. J. Hum. Hypertens. 2018;32(7):487-493. https://doi.org/10.1038/s41371-018-0065-y.
- Kandzari D.E., Böhm M., Mahfoud F., Townsend R.R., Weber M.A., Pocock S. et al. Effect of renal denervation on blood pressure in the presence of antihypertensive drugs: 6-month efficacy and safety results from the SPYRAL HTN-ON MED proof-of-concept randomised trial. Lancet. 2018;391(10137):2346-2355. https://doi.org/10.1016/S0140-6736(18)30951-6.
- Ионов М.В., Емельянов И.В., Юдина Ю.С., Панарина С.А., Зверев Д.А., Авдонина Н.Г. и др. Результаты длительного проспективного наблюдения пациентов с резистентной артериальной гипертензией, прошедших процедуру радиочастотной аблации симпатических почечных нервов. Артериальная гипертензия. 2021;27(3):318-332. https://doi.org/10.18705/1607-419X-2021-27-3-318-332.
- Гапон Л.И., Микова Е.В., Криночкин Д.В., Савельева Н.Ю., Жержова А.Ю., Александрович Е.Л. Ренальная денервация почечных артерий при резистентной артериальной гипертензии: клинический и органопротективный эффект. Системные гипертензии. 2021;18(3):153-160. https://doi.org/10.26442/2075082X.2021.3.201090.
- Щелкова Г.В., Заирова А.Р., Данилов Н.М. Рогоза А.Н., Чазова И.Е. Локальная артериальная жесткость и вазомоторная функция эндотелия у больных с рефрактерной артериальной гипертонией и влияние на них радиочастотной денервации почечных артерий. Кардиологический вестник. 2017;12(2):10-17.
- Brassard P., Tymko M.M., Ainslie P.N. Sympathetic control of the brain circulation: Appreciating the complexities to better understand the controversy. Auton. Neurosci. 2017;207:37-47. https://doi.org/10.1016/j.autneu.2017.05.003.
- Evans L.E., Taylor J.L., Smith C.J., Pritchard H.A., Greenstein A.S., Allan S.M. Cardiovascular comorbidities, inflammation, and cerebral small vessel disease. Cardiovasc. Res. 2021;117(13):2575-2588. https://doi.org/10.1093/cvr/cvab284.
- Воробьева О.В. Хроническая ишемия головного мозга: от патогенеза к терапии (рекомендации неврологу амбулаторного звена). РМЖ. Медицинское обозрение. 2018;(5):26-31.
- Fukuda H., Kitani М. Differences between treated and untreated hypertensive subjects in extent of periventricular hyperintensities observed on brain MRI. Stroke. 1995;9(26):1593-1597. https://doi.org/10.1161/01.STR.26.9.1593.
- Усов В.Ю., Ярошевский С.П., Тлюняева А.М., Максимова А.С., Алексеева Л.Н., Сухарева А.Е. Сочетанное применение количественной обработки Т2-взвешенных изображений и МРТ-кортикометрии у пациентов с атеросклерозом сонных артерий для прогнозирования церебральных осложнений инвазивных и хирургических вмешательств. Лучевая диагностика и терапия. 2019;(4):48-56. https://doi.org/10.22328/2079-5343-2018-4-48-56.
- Yao Y., Song Q., Hu C., Da X., Yu Y., He Z. et al. Endothelial cell metabolic memory causes cardiovascular dysfunction in diabetes. Cardiovasc. Res. 2022;118(1):196-211. https://doi.org/10.1093/cvr/cvab013.
- Афанасьева Н.Л., Пекарский С.Е., Мордовин В.Ф., Семке Г.В., Рипп Т.М., Личикаки В.А. и др. Влияние транскатетерной денервации почечных артерий на уровень артериального давления и структурные изменения головного мозга у пациентов c резистентной артериальной гипертензией. Артериальная гипертензия. 2013;19(3):256-262. https://doi.org/10.18705/1607-419X-2013-19-3-256-262.
- Pekarsky S., Baev A., Mordovin V., Sitkova E., Semke G., Ripp T. et al. Failure of renal denervation in Symplicity HTN-3 is a predictable result of anatomically inadequate operative technique and not the true limitations of the technology. J. Hypertens. 2015;33(1):е108. https://doi.org/10.1097/01. hjh.0000467641.39623.fb.


