Исследование диэлектрических свойств водного раствора иодида лития с учетом обобщенной потенциальной энергии взаимодействия
Автор: Махмадбегов Рашидджон Саидвалибегович
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Физика и астрономия
Статья в выпуске: 1 т.26, 2023 года.
Бесплатный доступ
На основе аналитических выражений для динамических коэффициентов диэлектрической проницаемости 𝜖1(ν) и диэлектрических потерь 𝜖2(ν), полученных ранее методом кинетических уравнений для растворов электролитов, с учетом вкладов обобщенного потенциала взаимодействия ионно-молекулярных систем, исследована частотная дисперсия этих коэффициентов и проведены численные расчеты в зависимости от температуры 𝑇, плотности ρ и концентрации для растворов иодида лития. Полученные результаты численных расчетов находятся в удовлетворительном согласии с экспериментальными данными для водных растворов электролитов иодида лития.
Коэффициенты диэлектрической проницаемости и диэлектрических потерь, коэффициенты трения, времена релаксации, потенциальная энергия взаимодействия, радиальная функция распределения
Короткий адрес: https://sciup.org/149142933
IDR: 149142933 | УДК: 537.266 | DOI: 10.15688/mpcm.jvolsu.2023.1.6
Текст научной статьи Исследование диэлектрических свойств водного раствора иодида лития с учетом обобщенной потенциальной энергии взаимодействия
DOI:
Известно, что структура воды и водных растворов электролитов с физико-химической точки зрения определяются пространственно-временным распределением структурных единиц раствора и их взаимодействия. На структуру растворителя влияют специфические особенности распределения и взаимодействия ионов растворяемого вещества, что приводит к изменению физико-химических параметров растворов [2; 7; 17; 20; 21]. Следовательно, свойства и структура водно-электролитных систем определяются пространственным расположением их структурных единиц, что важно для предварительного знания механических, тепловых, электрических, диэлектрических и магнитных свойств. Например, в первой области концентраций структура воды является матрицей, на которой развиваются взаимодействия в растворах [5; 6]. В этом случае в единой структуре наблюдаются геометрические и объемные соответствия конфигураций ионов и растворенных молекул. В области высоких концентраций фрагменты гидратных сфер, ионные и водные кластеры комплементарно связаны между собой, что со структурных позиций создает условия повышенной смесимости компонентов. При этих концентрациях установлены и реализуются структурные переходы для большого числа модельных растворов. Они подтверждаются макроскопическими физико-химическими и микроскопическими методами, а также моделированием, методом молекулярной динамики (МД) и методом интегральных уравнений (ИУ) для модельных растворов, что наблюдается специфика концентрационного перехода водно-электролитных систем [23–25]. В этих работах установлены отличия диэлектрической проницаемости, время релаксации и активности воды растворов электролитов в разных концентрационных зонах. В рамках общей схемы рассмотрены закономерности, определяющие влияние структурно-кинетических изменений воды в разных концентрационных зонах растворов, а также на их термодинамические и диэлектрические свойства.
В работах [3; 4; 19] исследованы изменения комплексной диэлектрической проницаемости и релаксации водных растворов иодидов лития, калия и цезия в широком интервале изменений концентрации и температуры в области частотной дисперсии диэлектрической проницаемости воды. Изучены динамические коэффициенты диэлектрической проницаемости и потери этих растворов при изменении температуры от 288 до 323 К в интервале частот от 7 до 25 ГГц. Измерены их низкочастотная электропроводность и рассчитаны ионные потери на высоких частотах. В растворах наблюдается одна область релаксации, описываемая уравнениями Дебая или Коула — Коула. Также в работе [19] изучены зависимость времени диэлектрической релаксации τи статической диэлектрической проницаемости e s водного раствора электролита литий иодида от температуры и концентрации. Здесь отмечается, что время и энтальпия активации процесса диэлектрической релаксации уменьшаются при переходе от воды к растворам, что соответствует нарушению исходной структуры воды и повышенной подвижности молекул воды в гидратных оболочках ионов [19]. В начальной области концентраций наблюдается линейная зависимость активности воды от 1/e s . При высоких концентрациях статическая диэлектрическая проницаемость e s растет с увеличением температуры. В связи с широким применением этих растворов в медицине и производстве фотореактивов, представляют большой интерес также теоретические исследования этих свойств водных растворов электролитов.
В работах [10; 13–16] методом кинетических уравнений получены аналитические выражения для коэффициентов диэлектрической проницаемости е1(ш) и диэлектриче- ских потерь е1(ш), где в подынтегральных выражениях для потенциальных частей содержатся энергия взаимодействия Фа0(г) и радиальная функция распределения дОлИ. На основе полуфеноменологической асимптотической модели раствора [20], которая описывается в приближении теории Мак-Миллана — Майера, где растворитель предполагается сплошной средой и в нем имеет место тепловое движение ионной подсистемы, проведены численные расчеты коэффициентов трения ионов ва, во, трансляционных та, то и конфигурационному таЬ временам релаксации, а также коэффициентов е1(ш) и е2(ш) водных растворов LiCl, NaCl, KCl, CsCl и KF. Здесь вклад растворителя в значение коэффициентов диэлектрической проницаемости е1(ш) и диэлектрических потерь е2(ш) водных растворов электролитов учитывается посредством статического значения коэффициентов диэлектрической проницаемости растворителя ess, а также коэффициентами трения ва и вь ионов сорта а и b [10; 13-16]. Однако согласно [1; 9; 11; 12; 20] энергия взаимодействия между структурными единицами ионно-молекулярных систем состоит из суммы межионных, ионно-дипольных и диполь-дипольных потенциалов взаимодействия, которая учитывает их вклад в коэффициенты диэлектрической проницаемости и электропроводности растворов электролитов, что является важным.
Целью работы является проведение численных расчетов и изучение частотной дисперсии коэффициентов е 1 (v) и e 1 (v) с учетом вклада обобщенной энергии взаимодействия для водного раствора электролита иодида лития, в зависимости от температуры Т , плотности р и концентрации С и частоты v.
Основные выражения и выбор модели раствора
В работе [12] на основе обобщенного потенциала взаимодействия ионно-молекулярных систем, учитывающих в некоторых приближениях вклад ион-ионных, ион-молекулярных и межмолекулярных взаимодействий, исследованы частотная зависимость коэффициентов диэлектрической проницаемости е 1 (v) и диэлектрических потерь e 2 (v) водного раствора калия иодида. Получены аналитические выражения коэффициентов диэлектрической проницаемости e 1 (v) и диэлектрических потерь e 2 (v) с учетом обобщенного потенциала для ионно-молекулярных систем и проведены численные расчеты этих коэффициентов в зависимости от температуры Т , плотности р, концентрации С и частоты ν для растворов иодида калия, а также построены диаграммы Коула — Коула.
В качестве исходного принимаем аналитические выражения коэффициентов диэлектрической проницаемости е 1 (ш) и диэлектрических потерь е 2 (ш) с учетом обобщенного потенциала ионно-молекулярных систем, когда потоки затухают по экспоненциальному закону, которые получены в [12] и имеют следующий вид:
, _ л-0т_ (1 — :.,, 2)
'^ -'■+— ео (1 ■'■ 11 + — 1 + .2 й )2Лаь(0)|'
V (шТ^О^Т а 5 (1 + ^ )
'' V . . (ШТ„)2)11 + V 1 + .= ' ^)2Л“<0)1’( )
а о где
Л„0(0) - 2п х пй„о■“52^ — 9-2^ци^'^1^д^Г’(3)
m a m b
T a = D O , T b = о О , T ab =
2 P a 2 в Ь
dlb вавь кТ (ва + вь) ’
глубина потенциальной ямы энергии межчастичного взаимодействия; R ab =
X* = Xabdab — приведенный обратный дебаевский радиус экранировки, в котором согласно [22] x определяется в виде х2 = Z2a е Хкт, а Uab(r, 0, ф) — потенциальной энергией взаимодействия диполей; U*b(r) = МХ^+^М-)), UiS(r) = ^(Za+Jib)e^-2 — потенциальная £s®aab энергия ион-дипольного взаимодействия; Uss(r) = ^X X — потенциальная энергия essdab - диполь-дипольного взаимодействия; L(Uab(r)) = [cth Uab(r) — ^*1(-) ] — функции Ланже- вена, sh(Ua*b(r)) и cthU*b(r) — гиперболические функции; ess — коэффициент диэлектрической проницаемости растворителя; dab = (daa±dbb), f = ^Л—; е0 — электрическая постоянная; ц — электрический момент молекулы-диполя и ц2 = p.s^s; У,Ь(г) — ради-ф*Ь Л)
альная функция распределения, которая согласно [20] ^ab(r) = У(r, Р*)е н ; У^ Р*) — бинарная функция распределения двух полостей, где ограничимся ее контактным зна- чением ^(r, р*) ^ ^(р*) на расстоянии r = 1 (rab = dab), полученная Карнаханом —
(2 - р * ) n nd3, np d3, No
Старлингом в виде ^(р*) = 2(1—Р*)3, Р* = —g = —6м— — приведенная плотность; р — плотность раствора; N0 — число Авогадро; М — молярная масса; ст, = "“Х0,, п* = n^bdab, Qab = П (ХХ+м), ma, mb — массы; ea, eb — заряды; ^a, пь — числовые плотности; da, db — диаметры; во,, вь — коэффициенты трения ионов сорта а и Ь; е — элементарный заряд; za, zb — валентность ионов; Ta, Tb и Tab — времена релаксации в импульсном и конфигурационном пространстве; rab = qb — qa — взаимное расстояние; r = d^ — приведенное расстояния между ионами сорта а и Ь; е0 — электрическая постоянная; к — постоянная Больцмана; Т — абсолютная температура; ш = 2nv — циклическая частота; v — частота процесса; е^ — значение коэффициента диэлектрической проницаемости при ш ^ то.
В дальнейшем возникает необходимость учета малых параметров, то есть когда U ab (r) = Хт) << 1 и это всегда имеет место. Если обсудим даже по классической теории электропроводности, то исходя из представлений о свободных частицах (ионах) электролитов предполагается, что ионы проводимости в электролитах ведут себя подобно молекулам идеального газа. В промежутках между соударениями они движутся совершенно свободно и эти столкновения приводят к установлению теплового равновесия системы (полуфеноменологическая осмотическая модель раствора, которая согласно [1; 3–7; 9–16; 18–25; 25] описывается в приближении теории Мак-Миллана — Майера). Отсюда, для упрощения этих выражений учитываем условия малых параметров, разлагая в подынтегральных выражениях функции Ланжевена L(U ab (r)) и гиперболические функции sh(U< * b (r)) и cthU< * b (r) в ряд и ограничиваясь линейными членами. Тогда выражение (3) принимает следующий вид:
Л о» (0) - 2п х п*,. /“[2 2 1 * 12 ) — аад U^]g>)r 2 dr. (5)
Таким образом, формулы (1) и (2) в контексте (5) позволяют исследовать частотную дисперсию коэффициентов диэлектрической проницаемости e i (v) и диэлектрических потерь e 2 (v) с учетом обобщенного потенциала ионно-молекулярных систем в зависимости от термодинамических параметров состояния. Как и в работах [1; 9; 11; 12], в этих выражениях потенциальные члены определяются обобщенным потенциалом энергии взаимодействия, который состоит из суммы межионных, ион-молекулярных и межмолекулярных потенциалов взаимодействия, а также радиальной функции распределения 9 a, (r), и при определенном выборе модели раствора эти равновесные структурные параметры известны в литературе. В дополнение к сказанному вклад растворителя в коэффициенты диэлектрических параметров учитывается посредством статического коэффициента диэлектрической проницаемости растворителя e ss , коэффициентами трения в а , в , ионов сорта а и Ь.
Для проведения численных расчетов коэффициентов диэлектрической проницаемости е 1 (ш) и диэлектрических потерь е 2 (ш) водного раствора электролита иодида лития с учетом обобщенного потенциала взаимодействия наряду с известными молекулярными параметрами m i , e i , п^ d i (г = а, Ь) еще понадобится определение коэффициентов трения в а , в , трансляционных т а , т ь и конфигурационному т аЬ временам релаксации.
Далее аналогично коэффициентам диэлектрической проницаемости е 1 (ш) и диэлектрических потерь е 2 (ш) при вышеприведенных условиях в [12] для выражения коэффициентов трения в а , в , частиц сорта а и Ь получены следующие выражения:
в а = Е 4^ Е da, /“ I ^Ц^ - l^) а Ь 0
9 2 и» 2 эи ;ь (г) 2 U „> ) 7/г(и»)
х 1 -д72_ + 7”а7 72“11 ц» 911(7)7 dr, в2 = Е Eda, / “I 2 -ЬЮ a2ua,(r) 2 эи;„(т) ж,» <»
х 1 .. + 7^7 •• 11 ua,(r) 9a,(r)r dr’ которые также полностью учитывают вклады взаимодействия структурных единиц, то есть межионные, ионно-молекулярные и межмолекулярные взаимодействия.
Следует отметить, что для проведения численных расчетов полученные выражения коэффициентов трения в а , в , в виде (5) являются сложными. Поэтому, как выше, разлагая в подынтегральных выражениях функции Ланжевена L(U ab (r)) и гиперболические функции s^(U a, (r)) и cthU a, (r) в ряд и ограничиваясь линейными членами, получим аналитическое выражение коэффициентов трения в а , в , в следующем виде [12]:
„2 v-4 n Г ,д 2 Ф 7 0 (г)
ва = 52 "3" Р а ^т 52 d ab Уо[ а72
-
+ 2 а Ф а ; (r) - u gt <7) х r dr 3
д 2 и :, (г) 2 au :, (r) 2 u :, (r)
х 1 дг 2 + 7^7 72”U9 ab( r ) r dr,
2 v-4 n Г Э 2 Ф^ (г)
в — 52 уръ^Т 52 ^ аь уо [ дт 2
+ 2 Э ф*0 (г) — * х т Эт 3
—
х | ' + 2■ — 2^
Эт 2 т Эт т 2
Следует отметить, что в выражениях (3), (5)–(9) расстояния между структурными единицами раствора характеризуются через приведенное расстояние т — У, где dab таЪ — дъ — да — межчастичное расстояние, а dab — (daa+dbb) — расстояния между центрами двух ионов раствора, когда столкновения считаются упругими (т — 1 (таЪ — d^)) и при взаимодействии структурных единиц раствора центры двух частиц сближаются на этом приведенном расстоянии т. А если соударение между ними неупругое, то молекулы немного деформируются и это соответствует примерно 0, 9т. Отсюда предел интегрирования при расчетах дается примерно от 0, 85т-0, 95т (нижний предел) до 10т (верхний предел), что соответствует тому, что расстояние между взаимодействующими частицами раствора 10daЪ.
Численные расчеты и обсуждение результатов
На основе формул (8) и (9) произведен численный расчет коэффициентов трения в а , в Ъ , а также согласно определению времен релаксации т а , т ъ и т аЪ ионов в зависимости от термодинамических параметров состояния. А потом с учетом численных расчетов этих коэффициентов трения и времен релаксации и на основе формул (1)–(2) и (5) рассчитаны частотные дисперсии коэффициентов e 1 (v) и e 2 (v) для водного раствора электролита иодида лития в зависимости от плотности р, концентрации С , температуры Т и частоты v. Численные расчеты проведены программным пакетом «Mathematica 8». Полученные результаты приведены в виде таблиц и рисунков.
В таблице 1 отражены численные значения коэффициентов трения в а , в ъ > времен релаксации т а , т ъ и т аЪ , а в таблицах 2-4 — коэффициентов диэлектрической проницаемости e 1 (v) и e 2 (v) диэлектрических потерь водного раствора электролита иодида лития при температурах 283-353 К, в интервале изменения концентрации 1 < С < 7 моль/кг, плотности 1107 < р < 1517 кг/м 3 и диапазоне частот 7, 5 < v < 10 4 ГГц. Проведены сравнения полученных теоретических результатов с экспериментальными данными работы [19]. Ход концентрационной, плотностной и частотной зависимости e 1 (v) и e 2 (v) соответствует экспериментальным результатам.
Известно, что диэлектрические свойства растворов электролитов характеризуются коэффициентами диэлектрической проницаемости и диэлектрических потерь, которые связаны релаксационными процессами в растворах. При оценке этих коэффициентов разные авторы используют разные выражения времени релаксации. Например, наши численные расчеты отличаются от других теоретических и экспериментальных данных тем, что при выборе модели раствора у нас имеются два времени релаксации (выражения 4), то есть трансляционное время релаксации ионов т а , т ъ и конфигурационное (то есть «структурное») время релаксации т аЪ , численные значения которых приведены в таблице 1 для температуры 298 К при разных концентрации и плотности.
Таблица 1
Численные расчеты коэффициентов трения ( β 1 , β 2 ) и времен релаксации ( τ 1 , τ 2 , τ 11 , τ 12 , т 22 ) водного раствора LiI в зависимости от плотности р и концентрации С при Т = 298 К
|
С, моль/кг |
р , кг/м 3 |
в 1 , 10 - 14 кг/с |
в 2 , 10 - 14 кг/с |
Т [19] , 10 - 12 с |
Т 1 , 10 - 12 с |
Т 2 , 10 - 12 с |
Т 11 , 10 - 12 с |
Т 12 , 10 - 12 с |
т 22 , 10 - 12 с |
|
1 |
1 107 |
1,187 |
6,138 |
7,1 |
0.,490 |
1,718 |
0,122 |
0,331 |
1,505 |
|
2 |
1 208 |
1,705 |
9,063 |
6,2 |
0,341 |
1,164 |
0,176 |
0,478 |
2,221 |
|
3 |
1 273 |
1,998 |
10,755 |
5,7 |
0,291 |
0,981 |
0,206 |
0,561 |
2,636 |
|
4 |
1 342 |
2,291 |
12,467 |
5,3 |
0,254 |
0,846 |
0,236 |
0,644 |
3,056 |
|
5,5 |
1 439 |
2,691 |
14,824 |
5,0 |
0,216 |
0,712 |
0,277 |
0,758 |
3,634 |
|
7 |
1 517 |
3,005 |
16,685 |
5,1 |
0,193 |
0,632 |
0,309 |
0,848 |
4,090 |
Как видно из таблицы 1 и рисунка 1, коэффициенты трения и времен релаксации в конфигурационном пространстве ионов сорта а и b зависят от концентрации, и изотермически при увеличении концентрации возрастают. Однако зависимость трансляционная (т 1 , т 2 ) и диэлектрическая (т 2 ) времена релаксации ионов, согласно численным расчетам и экспериментальным данным [19], по возрастанию концентрации и температуры уменьшается (см. рис. 2), что соответствует ранее полученными данными для других водных растворов [1; 9–16].
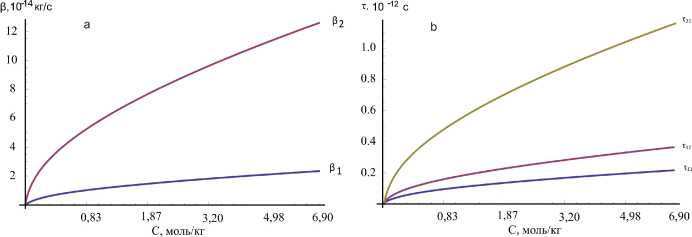
Рис. 1. Зависимость коэффициентов трения (а) и времени релаксации (Ь) ионов в конфигурационном пространстве от концентрации при температуре 298 К
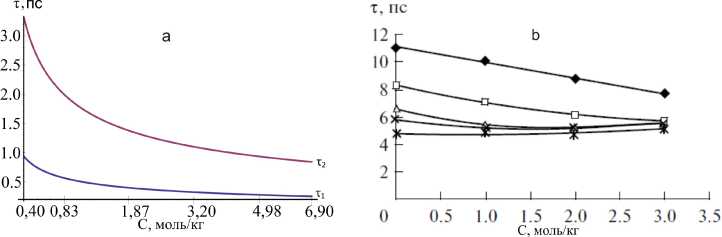
Рис. 2. Зависимость времени релаксации ионов водных растворов электролитов иодида лития от концентрации: а) трансляционных времен ( т 1 , т 2 ) релаксации при температуре 298 К по численным расчетам; b) время ( т 2 ) диэлектрической релаксации при температурах ^ 288, D 298, △ 308, х 313, * 323 К по данным [19]
Таблица 2
Зависимость статического коэффициента диэлектрической проницаемости 6 S водного раствора иодида лития от концентрации и температуры
|
т,к |
288 |
288 |
298 |
298 |
303 |
303 |
313 |
313 |
323 |
323 |
|
С ,моль/кг |
[19] |
Расч. |
[19] |
Расч. |
[19] |
Расч. |
[19] |
Расч. |
[19] |
Расч. |
|
Вода |
82,1 |
78,4 |
74,9 |
73,2 |
69,9 |
|||||
|
1 |
67,8 |
62,95 |
63,0 |
60,58 |
61,0 |
59,44 |
59,5 |
57,25 |
57,5 |
55,18 |
|
2 |
55,1 |
55,25 |
52,4 |
53,19 |
51,6 |
52,21 |
50,5 |
50,32 |
49,8 |
48,54 |
|
3 |
45,8 |
50,22 |
44,7 |
48,37 |
45,2 |
47,48 |
45,6 |
45,77 |
44,7 |
44,17 |
|
4 |
38,6 |
44,83 |
38,5 |
43,18 |
40,2 |
42,40 |
41,4 |
40,91 |
40,1 |
39,49 |
|
5,5 |
30,9 |
37,08 |
32,7 |
35,74 |
35,3 |
35,10 |
35,4 |
33,90 |
35,8 |
32,77 |
|
7 |
27,0 |
30,80 |
28,9 |
29,69 |
31,8 |
29,17 |
31,9 |
28,23 |
33,5 |
27,31 |
8i(v), 82(v) 8i(v),82(v)
10 100 1000 10000 1 10 100 1000 10000
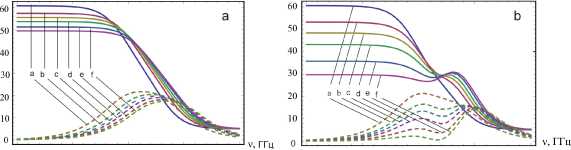
Рис. 3. Частотная зависимость коэффициентов диэлектрической проницаемости 6 1 ( v )
( сплошная линия ) и диэлектрических потерь 6 2 ( v ) ( штриховая линия ) водного раствора LiI при температуре 298 К и разных концентрациях:
а — 1; b — 2; с —3; d — 4; е — 5,5 и J — 7 моль/кг;
a ) без потенциальной части формулы (1)–(2); b ) с учетом потенциальной части формулы (1)–(2)
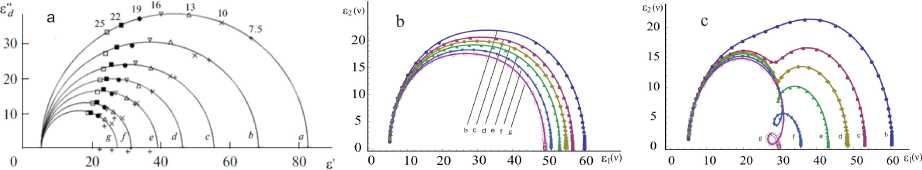
Рис. 4. Диаграмма Коула — Коула для водного раствора LiI при температуре 298 К и концентрации (моль/кг): а — 0 (вода); b — 1; с — 2; d — 3; е — 4; f — 5,5; д — 7. а ) по данным [19]; b ) расчетные данные без потенциальной части формулы (1)–(2);
c ) расчетные данные с учетом потенциальной части формулы (1)–(2)
На рисунке 3 приведены частотная дисперсия коэффициентов диэлектрической проницаемости 6 1 (v) и диэлектрических потерь 6 2 (v) водного раствора LiI при Т = 298 К и разных концентрациях, без учета потенциальной части (а) в выражениях (1) и (2), которые соответствуют трансляционному движению ионов сорта а и Ь, также с учетом потенциальной части (b), обусловленное взаимодействием ионов и диполей. Как видно из рисунка 3а, для 6 1 (v) и 6 2 (v) имеется одна область частотной дисперсии, приблизительно равной 10 2 Гц, а на рисунке 3b — две области дисперсии, обусловленные ионами и диполями. Аналогичное явление имеется на диаграмме Коула — Коула, где на рисунке 4b — одна область частотной дисперсии, а на рисунке 4c — две области, когда первая область относится к диполям, а вторая — к ионам.
Таблица 3
Зависимость изотермических коэффициентов диэлектрической проницаемости 6 1 ( v ) и диэлектрических потерь 6 2 ( v ) водного раствора LiI от р , С и v при = 298 К
|
О |
ш |
у о СО CU |
CD CD |
oq ^ |
о ID |
ОО СО^ ID |
о ID |
CD CD ^" |
|
ш |
У о СО CU |
ОО D ОО |
СО СО^ со |
ID |
oq ^ |
ОО О)" |
^ CO^ oq |
|
|
о |
ш |
У о СО CU |
ОО оо~ ОО |
СО СО^ cd" |
со оо~ CD |
о" |
CD ш" |
GO oo" |
|
ш |
У о СО CU |
CD О) 5 |
о § |
ОО СО |
о in СО |
oq со |
^p oq |
|
|
S |
ш |
У о СО CU |
ОО ио CD" |
о |
Ш СО Оо" |
^ |
oq ^ |
§ |
|
ш |
У о СО CU |
^ оо" d |
oq lO GO ^ |
оо ’ф |
оо оо^ со" СО |
co GO OO |
||
|
d ОО |
ш |
У о СО CU |
CD оо" |
СО LO CD |
CD lO |
^ ОО^ со" |
Ш СО оо" |
|
|
ш |
У о СО CU |
ш СС ш |
ОО CD Ш |
GO СО ^ |
^ оо" ^ |
CD оо^ ш" СО |
oo ^ oo" oo |
|
|
О? |
LQ |
СО ОО |
оО cd" оо |
ОО^ ^ oq |
со" оо |
oo^ oo |
||
|
CD |
ш |
у о СО CU |
1D CD |
ОО ОО ^ |
СО со" |
LO оо" |
^ LD |
CO |
|
ш |
У о СО CU |
^ 1D оо" |
ю CD оо" ш |
CD О) ^ |
ОО оо" |
^ 1D m" CO |
CD 1D oo oo |
|
|
О? |
^ ОО ^ |
оо^ О©" СО |
ID СО |
СО |
o^ oq |
CD ^ OO |
||
|
1D |
ш |
у о СО CU |
ОО со |
СО оо" |
oq оо^ |
co |
m CO^ |
|
|
ш |
У о СО CU |
Ш ОО S |
СО" ш |
GO оо^ СО |
oq со" ^ |
OO CD iD CO |
CD O^ OO |
|
|
о? |
оо^ CD" lQ |
CD cd" |
5 |
СО |
^ |
CD^ oq |
||
|
ю |
о. |
О |
ОО оо |
СО оо |
oq ^ СО |
OO CO ^ |
uO |
|
|
и |
ьО ^ О 5 |
’—1 |
оо |
СО |
^ |
in in |
b- |
|
О |
Ш |
о CO CU |
CD oo" |
OO oo^ |
CO °4 |
CD CD^ |
^ |
CD |
CD |
CD oo~ |
CD OO^ Oo" |
|
Ш |
T о CO CU |
m CD^ oo" |
CO CD^ oo" |
CD^ Oo" |
OO D OO |
^ D^ Oo" |
^ Oo" |
CD ^t Oo" |
D D OO |
CO Oo" |
|
|
о |
Ш |
T о CO CU |
CD CD^ oo" oo |
oo" oo |
OO CD^ oq |
OO oo~ oq |
oq D S |
OO °4 oo" |
О Oo" |
CO ^ |
^ cd" |
|
Ш |
T о CO CU |
CD oo" |
oo" |
LO |
CD OO^ 9 |
CO CD^ Oo" CO |
CD oo~ oo" CD |
OO cd" CO |
oq cd" cd |
^ d" CD |
|
|
s |
Ш |
T о CO CU |
CD °1 |
oo |
о |
OO D CD" |
D d" |
CD D d" |
s |
CO oo~ co" |
OO oo" |
|
Ш |
T о CO CU |
CD m" m |
CD oo~ ^ m |
LO co" D |
^ oo" D |
D D |
CO OO^ oo" |
CO D cd" |
oo D d" |
oo °4 co" |
|
|
m oo |
Ш |
T о CO CU |
о |
oo OO^ |
О |
CD Oo" |
CD OO^ oo" |
oo" |
CO D^ cd" |
CD D |
CD oo~ |
|
Ш |
T о CO CU |
^ CD |
CO OO^ s |
CO oo~ oo" D |
D cd" D |
CD D |
D |
CD CO D |
CD Oo" |
oo °4 |
|
|
oT |
in co" oo |
D D |
oo^ CD CO |
°4 CO |
°4 |
||||||
|
CD |
Ш |
t о CO CU |
oq |
oo^ CD |
CD |
D CD |
CD |
oo d" |
D D d" |
о d" |
oo ^ |
|
Ш |
T о CO CU |
О co" CD |
°4 CD |
CD CD^ S |
^h D Oo" D |
CO D |
CO D cd" D |
oq ^ D |
oo ^ D |
^h °4 cd" |
|
|
oT |
^t cd" CO |
^t co" |
D GO |
Oo" |
D^ D |
||||||
|
UO |
Ш |
t о CO CU |
^ CO |
OO^ CO~ |
oo^ CO~ |
oq CO~ |
^ OO^ oo' |
CD °4 oo" |
oo" |
OO ^ oo" |
oo oo~ oo" |
|
Ш |
T о CO CU |
^h co" CD |
oo" CD |
D CD |
1D D S |
GO D |
о D |
OO oo^ ^ D |
CD D |
oo D Oo" |
|
|
o? |
co" Ю |
OO^ cd" D |
D |
CD^ D |
D |
||||||
|
^f |
Cl |
^ |
о |
о |
О |
О |
О |
О |
§ |
CD О |
oo о |
|
ti |
CO CD OO |
CD CD OO |
CO OO OO |
CD OO OO |
CD CO |
CO CO |
CO OO CO |
CD ^h CD |
CD D CD |
Как видно из таблицы 1 численных значений, время релаксации водного раствора иодида лития по данным [19], который по ходу изменения концентрации и плотности соответствует нашему трансляционному времени релаксации, приблизительно на 1 порядок больше. Например, у эксперимента равно т = 7,1 пс (одну область дисперсии), а наша модель раствора т 1 = 0,49 пс, т 1 = 1, 718 пс (за счет чего и появляется две области дисперсии) (см. рис. 3 и 4). Поэтому при выполнение условия шт = 2nvT = 1, которое называется условием максимума диэлектрических потерь или характерным временем релаксации, численные значения диэлектрической проницаемости и диэлектрических потерь на одну декаду опаздывают по частотам (см. табл. 3 и 4), то есть все расхождения связаны с выбранной нами моделью раствора с молекулярно-кинетической точки зрения. Видимо, если бы выбор нами модели раствора, то есть выражения времена релаксации совпадал с работой [19], то это расхождение было бы не очень существенным.
Заключение
Следовательно, результаты численных расчетов при выбранной нами модели раствора, потенциал межмолекулярного взаимодействия Ф аь (т, 0, ф) и радиальная функция распределения д „ь (т, 0, ф) дали относительно удовлетворительное согласие теоретических и экспериментальных значений и для водного раствора LiI в широком интервале изменения параметров состояния. Частотная дисперсия и в широком диапазоне частот обусловлена наличием диэлектрической релаксации в водном растворе LiI, что является следствием вкладов молекулярных релаксационных процессов. В общем случае область частотной дисперсии коэффициентов e 1 (v) и e 2 (v) в зависимости от термодинамических параметров состояния составляет 10 2 Гц, что совпадает с результатами общей релаксационной теории и экспериментальными данными [8].
Список литературы Исследование диэлектрических свойств водного раствора иодида лития с учетом обобщенной потенциальной энергии взаимодействия
- Акдодов, Д. М. Исследование области частотной дисперсии коэффициентов вязкостей растворов электролитов с учетом обобщенного потенциала взаимодействия / Д. М. Акдодов // Вестник Таджикского национального университета. Серия естественных наук. — 2017. — № 1-1. — С. 111-115.
- Вопросы физической химии растворов электролитов / под ред. Г. И. Микулина. — Л.: Химия, 1968. — 420 с.
- Кобелев, А. В. Диэлектрическая проницаемость и релаксация водных растворов иодида цезия / А. В. Кобелев, А. С. Лилеев, А. К. Лященко // Журн. неорган. химии. — 2011. — Т. 56, № 10. — С. 1746-1749.
- Кобелев, А. В. Температурная зависимость СВЧ-диэлектрических свойств водных растворов иодида калия / А. В. Кобелев, А. С. Лилеев, А. К. Лященко // Журн. неорган. химии. — 2011. — Т. 56, № 4. — С. 697-704.
- Лященко, А. К. Активность воды и диэлектрическая константа водных растворов электролитов / А. К. Лященко, И. М. Каратаева // Журн. физ. химии. — 2010. — Т. 84, № 2. — С. 376-384.
- Лященко, А. К. Пространственная структура воды во всей области ближнего порядка / А. К. Лященко, Л. В. Дуняшев, В. С. Дуняшев // Журн. структур. химии. — 2006. — Т. 47, № 7. — С. Б36-853.
- Лященко, А. К. Структурные и молекулярно-кинетические свойства концентрированных растворов и фазовые равновесия водно-солевых систем / А. К. Лященко // Концентрированные и насыщенные растворы. — М.: Наука, 2002. — C. 93-118.
- Михайлов, И. Г. Основы молекулярной акустики / И. Г. Михайлов, В. А. Соловьев, И. Г. Сырников. — М.: Наука, 1964. — 514 с.
- Одинаев, C. Исследование частотной дисперсии динамических модулей упругости растворов электролитов на основе обобщенного потенциала ионно-молекулярных систем / C. Одинаев, Д. М. Акдодов, Н. Шарипов // Вестник Таджикского национального университета. Серия естественных наук. — 2020. — № 1. — C. 118-130.
- Одинаев, C. Исследование частотной дисперсии коэффициента диэлектрической проницаемости растворов электролитов / C. Одинаев, Р. С. Махмадбегов // Журн. физ. химии. — 2016. — Т. 90, № 1. — C. 52-58.
- Одинаев, C. Исследование частотной дисперсии коэффициента удельной электропроводности водных растворов электролитов / C. Одинаев, Д. М. Акдодов, Х. И. Идибегзода // Журн. структур. химии. — 2019. — Т. 60, № 3. — C. 452-460.
- Одинаев, C. Исследование частотной дисперсии коэффициентов диэлектрической проницаемости и диэлектрических потерь водных растворов иодидов калия / C. Одинаев, Д. М. Акдодов, Р. С. Махмадбегов // Журн. структур. химии. — 2022. — Т. 63, № 6. — C. 826-837.
- Одинаев, C. Исследование частотной дисперсии коэффициентов диэлектрической проницаемости и диэлектрических потерь водного раствора иодида цезия / C. Одинаев, Р. С. Махмадбегов // Известия Национальной академии наук Таджикистана. Отделение физико-математических, химических, геологических и технических наук. — 2021. — Т. 182, № 1. — C. 39-49.
- Одинаев, C. Расчет частотных спектров коэффициентов диэлектрической проницаемости и диэлектрических потерь водных растворов электролитов / C. Одинаев, Р. С. Махмадбегов // Журн. физ. химии. — 2018. — Т. 92, № 1. — C. 107-114.
- Одинаев, C. Частотная дисперсия диэлектрической проницаемости и диэлектрических потерь водных растворов KCl и CsCl в зависимости от параметров состояния / C. Одинаев, Р. С. Махмадбегов // Укр. физ. журн. — 2015. — Т. 60, № 12. — C. 1212-1219.
- Одинаев, C. Численный расчет коэффициентов диэлектрической проницаемости и диэлектрических потерь водного раствора KF от параметров состояния / C. Одинаев, Р. С. Махмадбегов // Журн. структур. химии. — 2018. — Т. 59, № 3. — C. 621-628.
- Самойлов, О. Я. Структура водных растворов электролитов и гидратация ионов / О. Я. Самойлов. — М.: АН СССР, 1957. — 182 с.
- Смирнова, Н. А. Молекулярные теории растворов / Н. А. Смирнова. — Л.: Химия, 1987. — 336 с.
- Температурные изменения диэлектрической проницаемости и релаксации водных растворов иодида лития / А. К. Лященко, А. В. Кобелев, И. М. Каратаева, А. С. Лилеев // Журн. неорган. химии. — 2014. — Т. 59, № 7. — C. 971-980.
- Юхновский, И. Р. Статистическая теория классических равновесных систем / И. Р. Юхновский, М. Ф. Головко. — Киев: Наукова думка, 1980. — 372 с.
- Barthel, J. M. G. Physical Chemistry of Electrolyte Solution. Modern Aspects / J. M. G. Barthel, H. Krienke, W. Kunz. — Steinkopff; Darmstadt; New York: Springer, 1998. — 401 p.
- Krienke, H. Alkali metal halide solution in 1,4-dioxide — water mixtures. A Monte Carlo simulation study / H. Krienke, G. Krienke, J. M. G. Barthel // J. Molecular Liquids. — 2004. — Vol. 109. — P. 115-124.
- Lyashchenko, A. K. Dielectric Relaxation of Water in Hydration Shells of Ions / A. K. Lyashchenko, A. S. Lileev // J. Chem. Eng. Data. — 2010. — Vol. 55. — P. 2008-2016.
- Computer simulation study of rotational diffusion in polar liquids of different types / А. Y. Zasetsky, S. V. Petelina, A. K. Lyashchenko, A. S. Lileev // J. Chem. Phys. — 2010. — Vol. 133. — Article ID: 134502.
- Zasetsky, А. Ion-Ion and Ion-Water Aggregations and Dielectric Response of Aqueous Solutions of Li2SO4: Molecular Dynamic Simulations Study / А. Zasetsky, А. Lyashchenko, A. Lileev // J. Molecular Physics. — 2011. — Vol. 109, № 6. — P. 813-822.


