Исследование донорно-акцепторных комплексов 2, 6-замещенных парабензохинонов с алифатическими аминами. Изучение процессов их фотохимического взаимодействия с помощью эффекта химической поляризации ядер (ХПЯ)
Автор: Порхун В.И., Перминов В.Н.
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Химическая физика
Статья в выпуске: 9, 2005 года.
Бесплатный доступ
С помощью эффектов химической поляризации ядер и спектроскопии ядерного магнитного резонанса установлены комплексы переносов заряда при фотохимических реакциях хинонов с аминами и получены их термодинамические характеристики. Исследован механизм фотореакции и элементарный акт переноса электрона с образованием ион-радикальных пар.
Короткий адрес: https://sciup.org/14968558
IDR: 14968558 | УДК: 547.567415:
Текст научной статьи Исследование донорно-акцепторных комплексов 2, 6-замещенных парабензохинонов с алифатическими аминами. Изучение процессов их фотохимического взаимодействия с помощью эффекта химической поляризации ядер (ХПЯ)
С помощью эффектов химической поляризации ядер и спектроскопии ядерного магнитного резонанса установлены комплексы переносов заряда при фотохимических реакциях хинонов с аминами и получены их термодинамические характеристики. Исследован механизм фотореакции и элементарный акт переноса электрона с образованием ион-ради-кальных пар.
В настоящее время строгое доказательство участия комплексов с переносом заряда в реакциях получено лишь в некоторых случаях, несмотря на то, что такие комплексы часто постулируются как промежуточные состояния.
-
1. Важную роль КПЗ могут играть в реакциях следующих типов: 1) реакции переноса электронов (фотохимические и термические); 2) реакции, протекающие через переходные состояния, в которых донорная или акцепторная активность выше, чем в начальном состоянии; 3) реакции, приводящие к таким конечным продуктам, для объяснения строения которых необходимо предположить образование специфических промежуточных соединений.
-
2. В настоящей работе приведены результаты исследования КПЗ в основном состоянии 2,6-дифенил-1,4-бензохинона (Q) с алифатическими аминами. Целью ставилось получение термодинамических характеристик —■ энтальпии и свободной энергии, а также спектральных характеристик комплекса.
Самостоятельный интерес представляет изучение поведения молекулярных комплексов в возбужденных электронных состояниях с точки зрения выяснения механизмов фотохимических реакций, а также и с механизмами любых химических реакций, поскольку одним из самых важных элементарных процессов в химических реакциях является изменение электронного распределения, сопровождаемое изменением ядерных конфигураций в ходе реакции, и фотовозбуждение комплексов вызывает такие изменения.
Таким образом, КПЗ в возбужденном состоянии может рассматриваться как типичная модельная система для изучения элементарных процессов в химических реакциях. Аналогичная ситуация имеет место в случае молекулярных взаимодействий при молекулярных столкновениях в возбужденных состояниях, а также в КПЗ, существующем до освещения и затем возбужденного светом (эксиплексы). "
Термодинамические характеристики характеризуют различные свойства комплекса. Энтальпия — энергия донорно-акцепторных связей, свободная энергия — способность к диссоциации на компоненты в растворах. Необходимым параметром для нахождения вышеуказанных характеристик в условиях эксперимента является константа равновесия реакции комплексообразования К. Константу можно выразить через концентрацию донора, акцептора и комплекса. Если коэффициенты активности равны единице, то Нравно:
№>Г
Баланс системы выражается следующими формулами:
С^ = Сд + Ск,
С D„ = С D + С к, где С^ И CDo — исходные концентрации акцептора и донора.
Тогда, подставляя (2) и (3) в (1), имеем: .
обратная величина:
—-^^-(с, +CD)+CK(
КГ Z-1 'А) Ц) / Л ,
^С^К
в нашем случае комплексы хорошо диссоциируют, тогда последним членом в (5) можно пренебречь, что дает:
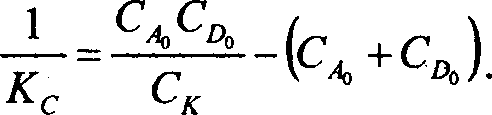
Свяжем последнее уравнение с параметрами, получаемыми методом ЯМР, а именно с химическим сдвигом комплексообразования, представляющим разность химического сдвига компонентов, связанных в комплекс с химическим сдвигом для изолированного донора или акцептора
^к -^к ~8сю6.
Вид спектра будет зависеть от скорости обмена между комплексом и свободными компонентами, находящимися в равновесии. В этом случае наблюдается усредненный сигнал, химический сдвиг которого является средневесовым от сдвигов всех резонирующих форм:
где 8^ — химический сдвиг наблюдаемого сигнала;
5, — химический сдвиг Z-го ядра;
И< — доля /-го ядра в смеси двух резонирующих форм.
В нашем случае уравнение (8) имеет вид:
5^
если резонирующее ядро входит в состав донорной молекулы, и
8 наб -
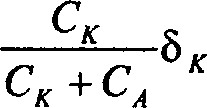
+---—8.
СК^СА А’
если ядро входит в состав акцепторной молекулы.
Воспользовавшись уравнением материального баланса (2), (3), можно предыдущие формулы записать следующим образом:
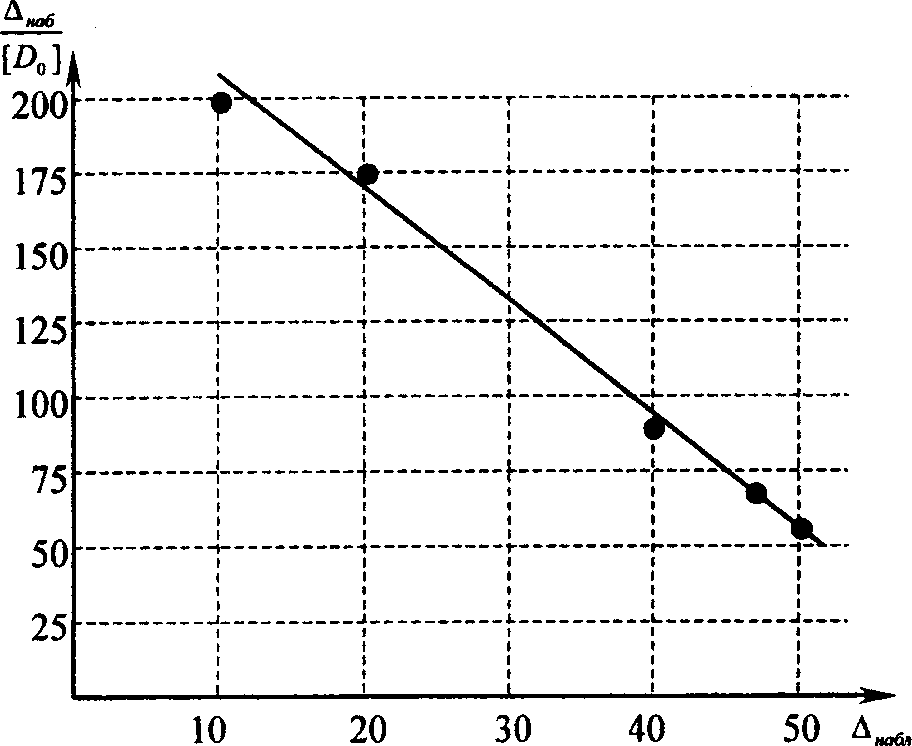
Концентрация донора, моль/л [Do] | Сдвиг частоты Аш6 | К | |
0,05 | 9,9 | 198 | 3,75 |
0,125 | 20,7 | 162 | |
0,4 | 37,9 | 95 | |
0,65 | 46 | 70 | |
1 | 50 | 50 |
Таким образом, практически все изучаемые доноры электронов образуют комплексы различной силы с указанным хиноном в ряду
N — N
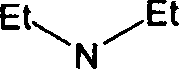
Et / H-N \
N(CH2)2N
Et
(табл. 2).
Таблица 2
Термодинамические характеристики комплексов различных доноров электронов с хиноном [Q]
Донор электрона | -ДЯ, ккал/моль | - AS, э.е. | - AG, ккал/моль | К |
1 1 N—N ।________________1 | 6,66 | 13,4 | 2,58 | 3,75 |
Ek /Et N Et | 7,4 | 13,6 | 3,35 | 8 |
Et / H-N XEt | 12,2 | 23,5 | 5,2 | 10,2 |
H\ /H N(CH2)2N | 38 | 9,3 | 10,1 | 15,5 |
При освещении данных растворов светом в образующемся эксиплексе происходят различные фотофизические и фотохимические процессы, зависящие от вида хинона, донора электрона, растворителя, температуры и т. д. Но все эти условия непосредственным образом влияют на степень комплексообразования реагентов. То есть параметры комплексообразования могут служить количественной оценкой глубины фотохимической реакции восстановления хинона.
Интересно отметить, что в случае замены 2,6-дифенил-1,4-парабензохинона на 2,6-дит-ретбутил-1,4-парабензохинон вышеперечисленные эффекты не имеют места. Видимо, большие стерические препятствия, а также наличие сильных электронно-донорных третбутильных групп не позволяют создавать комплексы с переносом заряда.
Таким образом, отсутствие возбужденного КПЗ (эксиплекса) оказывает решающее влияние на течение фотореакции.
Таблица 3
Данные In X в зависимости от температуры для нахождения термодинамических характеристик комплекса хинон — ДАБЦО
т,с | Т.К | Т | К | In К |
27 | 300 | 3,3-10'3 | 3,75 | 1,32 |
37 | 310 | 3,2-10'3 | 1,91 | 0,65 |
47 | 320 | 3,12 10“э | 1 | 0 |
57 | 330 | 3,103 | 0,54 | -0,62 |
67 | 340 | 2,94-10'3 | 0,39 | -0,94 |
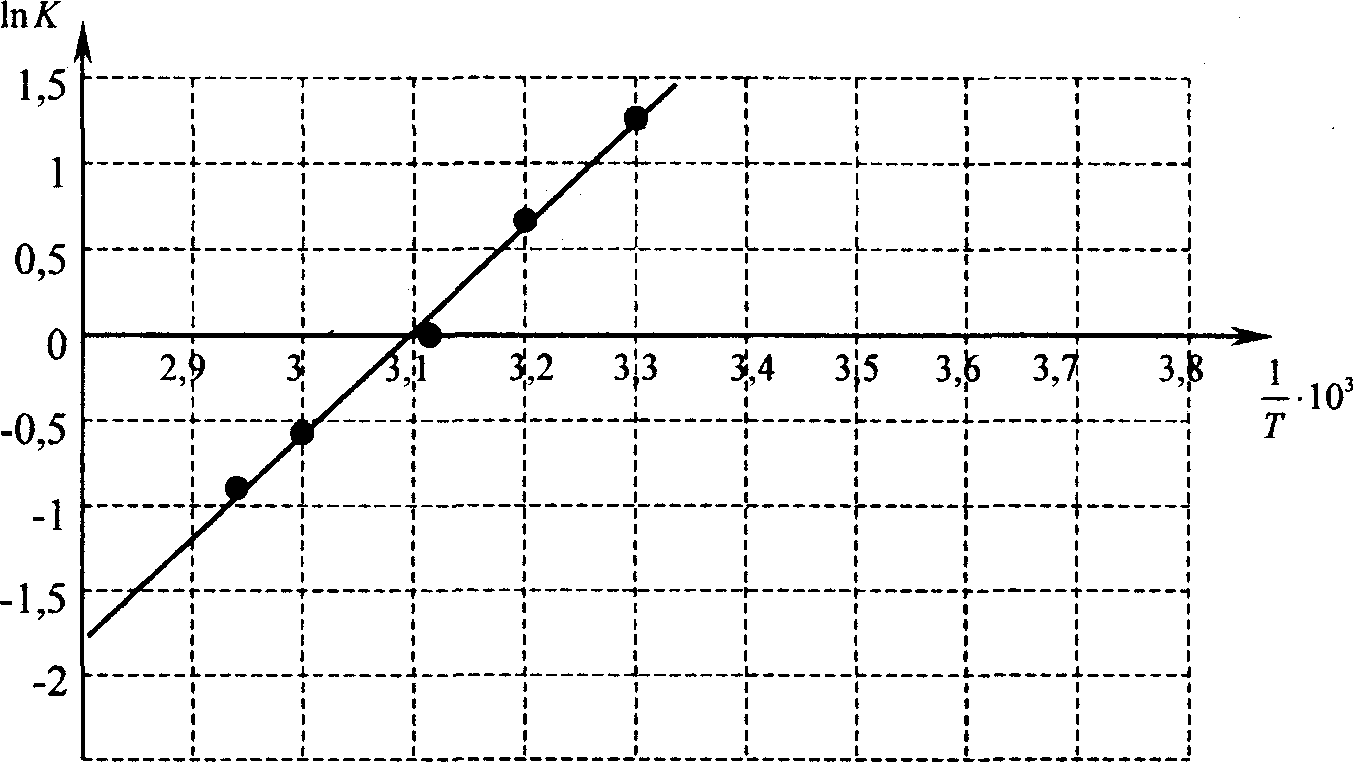
Рис. 2. График в координатах 1пК -— для нахождения термодинамических характеристик
ДО, ДЯ, Д5 комплекса хинон — ДАБЦО, данные в таблице 2
Выбор с помощью ХПЯ между механизмом с промежуточным переносом электронов и участием ион-радикальных пар или же с одностадийным переносом атомов водорода и образованием нейтральных радикалов основан на том, что электроны переносятся от атома азота амина к карбонильной группе с образованием аминиевых катион радикалов, а отщепление атомов водорода происходит от а-углерода амина и ведет к нейтральным аминоалкильным радикалам. У этих радикалов g-факторы и константы сверхтонкого взаимодействия а. могут существенно отличаться, что должно приводить к различным поляризационным эффектам (регистрируемых ЯМР-спектрометром) в системах с участием катион-радикалов или нейтральных радикалов.
Таким образом, можно достоверно определить элементарный акт реакции.
Нами были исследованы фотопревращения 2,6-диметил-1,4-бензохинона (I), 2,6-дитретбу-тил-1,4-бензохинона (И) и 2,6-дифенил-1,4-бензохинона (III) в смеси с триэтидамином. При облучении хинона (I) с триэтидамином непосредственно в датчике прибора ЯМР в растворе C6F6, СС14 протоны получаемого диэтилвиниламина (химический сдвиг в спектре ПМР 3,98 м. д.) поляризованы положительно. Величина сигнала ПМР, соответствующая а-протонам, позволяет говорить об отсутствии на них поляризации. В полярном растворителе CD3CN наблюдали положительную поляризацию, как на а -, так и на [3-протонах, хотя интенсивность сигнала поляризации значительно ниже. Данные поляризации получают объяснение, если допустить внеклеточное образование диэтилвиниламина, причем вклад в его поляризацию вносят ион-радикаль-ные пары, а также пары нейтральных радикалов.
Первоначально триплет хинона образует эксиплекс с амином, после переноса электрона образуется ион-радикальная пара РПр которая после протонизации превращается в пару нейтральных радикалов РП2. Вклад в поляризацию дают обе пары. Поляризация на (3-протонах диэтилвиниламина наблюдается лишь в парах нейтральных радикалов, причем константа СТВ на (3-протонах в ион-радикальной паре близка нулю. СТВ на а-протонах в ион-радикальных парах и парах нейтральных радикалов противоположны по знаку. Поэтому их суммарный вклад в поляризацию незначителен и не наблюдается сигнала, соответствующего а-протонам винильной группы. С увеличением полярности среды происходит стабилизация ион-радикаль-ных пар, что ведет к преимущественному образованию диэтилвиниламина из ион-радикаль-ных пар с положительной поляризацией винильных протонов
РПХ —^РП2 -► СЯ2 = CHN(C2H5)2 + QH •
В случае фотолиза хинона (II) с триэтидамином получается совершенно иная картина. Соответствующий гидрохинон образуется в следовых количествах. Метапротоны (6,51 м. д.) исходного хинона поляризованы положительно. Слабая положительная поляризация наблюдалась на а-протонах исходного амина, а p-протоны последнего поляризованы отрицательно. Если допустить, что химическая поляризация ядер формируется внутриклеточно в паре нейтральных радикалов, причем g-фактор семихинонного радикала больше аминоалкильного, то знаки ХПЯ получают полное объяснение. Найденные по правилу Каптейна Г = pe^ga теоретические знаки поляризации совпадают с экспериментальными:
для метапротонов Г^ =++++> о, для а-протонов Г„ =++—> 0, для (3-протонов Г, =++-+< о.
ХПЯ наблюдаются на исходных реагентах в результате реакции диспропорционирования внутри клетки пары нейтральных радикалов. Большие стерические препятствия, а также наличие электронодонорных групп не позволяют создать комплексы с переносом заряда.
В процессе фотолиза хинона (III) и триэтиламина наблюдали очень сильную отрицательную поляризацию (3-протонов исходного хинона, на его а-протонах поляризация отсутствовала. В диэтилвиниламине на а- и (3-протонах наблюдали положительную поляризацию. Метапротоны исходного хинона (6,85 м. д.) также поляризованы положительно. Эта картина аналогична фотолизу хинона (I) с триэтидамином, но с большим коэффициентом усиления ХПЯ. Главное отличие в картине фотолиза хинона (III) от хинона (I) является сохранение знака ХПЯ в полярных и неполярных растворителях. Видимо, финильные заместители сильно повышают окислительный потенциал хинона, достаточно увеличивая устойчивость ион-радикальной пары РП( для прохождения эффективной синглет-триплетной конверсии.
Представляло интерес исследовать механизм фотореакции амина с соединениями другого класса, содержащими карбонильную группу. В качестве акцептора был выбран п, и -диметилбензофенон.
Его фотовосстановление 1,4-диазобицикло-2,2,2-октаном (ДАБЦО) может протекать с промежуточным переносом электрона или с одностадийным переносом атома водорода.
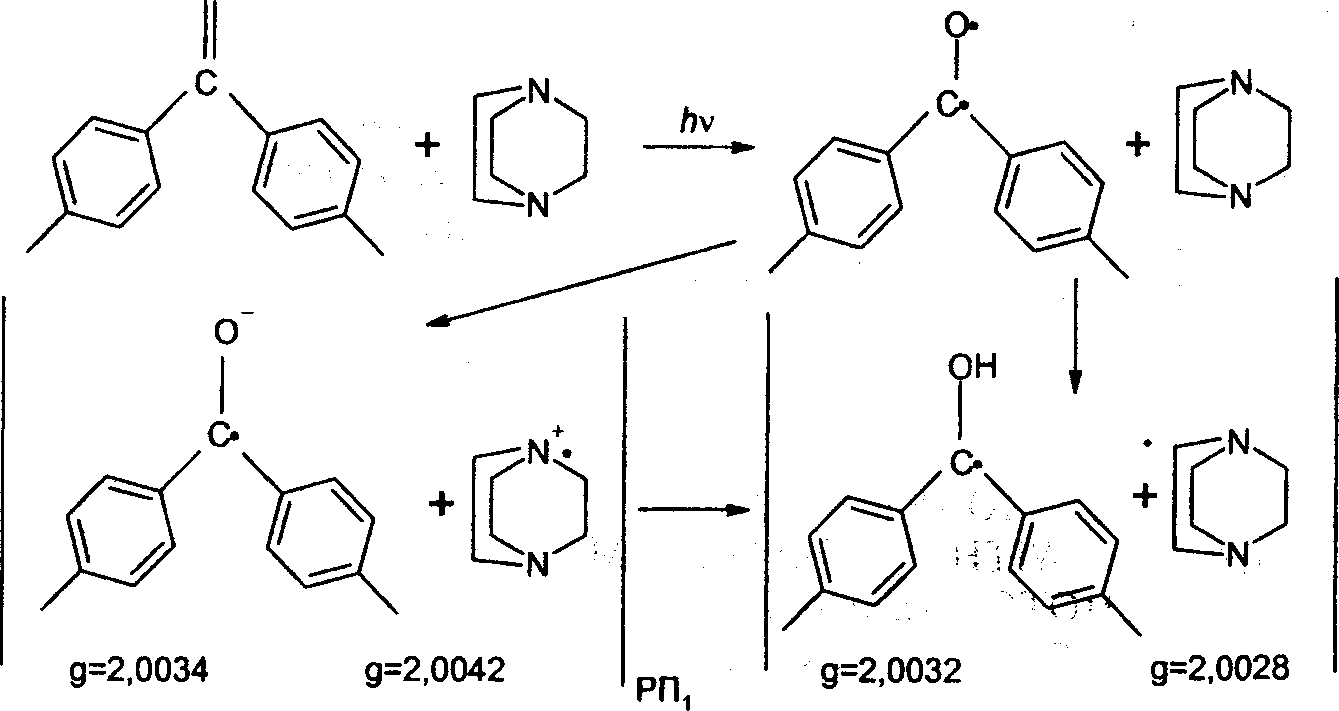
На приведенной схеме показаны величины g-факторов образующихся ион-радикалов и нейтральных радикалов. Важно подчеркнуть, что величины Ag-факторов (то есть разности g-факторов) в парах нейтральных радикалов и ион-радикалов имеют противоположные знаки. Следовательно, продукты, ими порождаемые, будут иметь противоположные сигналы в спектрах ХПЯ.
Известно, что при низкой концентрации амина фотовосстановление происходит с участием триплетного состояния кетонов и что константы СТВ протонов финильных колец радикалов и анион-радикалов, отвечающих кетонам, альтернируют (аорто < 0 < амста), поскольку эти частицы являются л-радикалами. Очевидно, что регенерация исходного хинона происходит внутри клетки.
Согласно нашим экспериментальным данным, ортопротоны исходного п, п '-диметилбензофенона в процессе фотовосстановления поляризуются положительно, а метапротоны отрицательно, как и протоны метильных групп. По правилу Каптейна имеем:
для метапротонов Гм = ++-+< 0, для ортопротонов ГОР =++—> 0.
Эти знаки отвечают возникновению ХПЯ в парах с Ag <0, то есть в парах с участием ион-радикалов, образовавшихся в результате переноса электрона от амина к бензохинону. Полученные данные свидетельствуют о двухстадийном механизме перемещения атома водорода. Таким образом, параметры эффекта ХПЯ позволяют достоверно определить фундаментальное понятие — элементарный акт фотореакции.
Экспериментальная часть
Спектры ПМР снимали на спектрометрах Bruker-90 и Tesla-567А. Эффекты ХПЯ наблюдали на этих спектрометрах, подавая свет от ртутной лампы ДРШ-500 через оптическую систему, ИК-фильтр и кварцевый световод непосредственно в датчик спектрометра. 1,4-диазобицикло-2,2,2-октан фирмы Ferak. Хиноны перекристаллизовывали из хлороформа, их константы соответствовали литературным.
Выводы
1) Установлено наличие КПЗ, различной силы 2,6-дифенил-1,4-парабензохинона с алифатическими аминами, получены их термодинамические и кинетические характеристики.
2) При фотолизе системы 2,6-дитретбутил-1,4-парабензохинон-триэтиламин в полярных и неполярных растворителях ХПЯ формируются в паре нейтральных радикалов внутри клетки растворителя, хинон не восстанавливается.
3) Фотолиз 2,6-дифенил-1,4-парабензохинона и 2,6-диметил-1,4-парабензохинона в смеси с триэтиламином ведет к эффективному фотовосстановлению хинонов. ХПЯ формируется, как в ион-радикальных парах, так и в парах нейтральных радикалов в результате кооперативного эффекта. Перенос атома водорода происходит в 2 этапа: перенос электрона, затем протона.
4) В системе п, л’-диметилбензофенон-ДАБЦО ХПЯ формируется в ион-радикальных парах, что свидетельствует о двухстадийном перемещении атома водорода.
Список литературы Исследование донорно-акцепторных комплексов 2, 6-замещенных парабензохинонов с алифатическими аминами. Изучение процессов их фотохимического взаимодействия с помощью эффекта химической поляризации ядер (ХПЯ)
- Roth H.D., Manion M.L. Photoreactions of ketones with amines // Journal American Chemical Society// 1975. Vol. 97. № 23. P. 6886-6888.
- Hendriks B.M.P., Walter R.J., Fisher H. CIDNF studies of the photoreduction of atomic ketones by aromatic amines//Journal American Chemical Society. 1979. Vol. 101. P. 2378-2383.
- Механизм реакции взаимодействия 2,6-дифенил-1,4-бензохинона с алифатическими аминами/Б.Д. Свиридов, М.В. Сердобов, Р.В. Попонова, В.И. Порхун//Изв. АН СССР. Сер. хим. 1983. Т. 1. С. 105-112.
- Порхун В.И., Свиридов Б.Д., Рыгалов Л.Н. Механизм фотолиза 2,6-дифенил-1,4-бензохинона в ароматических углеводородах//Журн. общ. химии. 1988. Т. 58. С. 410-412.
- Порхун В.И., Никифоров Г.А., Рыков С.В. Изучение фотохимических реакций замещенных бензохинонов//Применение ЯМР в химии и нефтехимии: Тез. докл Волгоград, 1991. С. 25-30.