Исследование физико-химических и биологических свойств, пептидного состава пепсинового гидролизата молозива коров
Автор: Тихонов Сергей Леонидович, Тихонова Наталья Валерьевна, Данилова Ирина Георгиевна, Тихонова Мария Сергеевна, Поповских Анжелика Денисовна
Рубрика: Пищевые ингредиенты, сырье и материалы
Статья в выпуске: 3 т.10, 2022 года.
Бесплатный доступ
Пептиды относятся к биологически активным веществам различного спектра действия. Проведены исследования физико-химических свойств пепсинового гидролизата молозива коров. Ферментативный гидролизат молозива коров отличается высоким содержанием белка 9,16 % и низким содержанием жира 0,25 %. Получен осадок гидролизата с помощью центрифугирования при 3900 об/мин в течение 10 минут. Из осадка из пепсинового гидролизата молозива коров на МАЛДИ-ТОФ масс-спектрометре выделено две фракции R (1) и R (2). Установлено, что пептидная цепь R (1) состоит из 6 аминокислотных остатков в разной последовательности и образует полипептид из 11 аминокислот. Пептид R (2) относится к полипептидам, так как в его цепь входят 7 повторяющихся аминокислотных остатков. Молекулярная масса пептида R (1) составляет 1,7 кДа, пептида R (2) - 7 кДа. Согласно научной базе данных NCBI пептид R (1) относится к малоизученному пептиду «Nuclear receptor 2C2-associated protein, Bos taurus», пептид R (2) относится к пептидам «14 kDa phosphohistidine phosphatase, Pongo abelii», биологические функции которого не исследованы. При изучении цитотоксичности выделенных пептидов в составе гидролизата молозива коров на клетках линии HEG 293 методом Neutral Red Assay при 24 часовой инкубации установлено, что цитотоксичность исследуемого гидролизата в концентрациях от 0,1 до 0,5 мг/мл составляет от 0,9 до - 6,30, что свидетельствует об ее отсутствии. Доказана антимикробная и противомикробная активность гидролизата молозива коров по отношению к E. Coli, B. Subtilis и C. Albicans.
Молозиво коров, ферментативный гидролизат, пептиды, антимикробная активность, цитотоксичность, молекулярная масса
Короткий адрес: https://sciup.org/147238511
IDR: 147238511 | УДК: 615.35 | DOI: 10.14529/food220303
Текст научной статьи Исследование физико-химических и биологических свойств, пептидного состава пепсинового гидролизата молозива коров
Молозиво крупного рогатого скота является источником иммуноглобулинов G (IgG), А (IgA), факторов роста, α-лактальбумина (α-ЛА) и β-лактоглобулина (β-ЛГ), лизоцима, лактопероксидазы, лактоферрина (ЛФ), нуклеозидов, цитокинов, витаминов, пептидов и олигосахаридов, нормализует кишечную микрофлору, обладает антимикробными и иммуностимулирующими свойствами [1–3].
Особое внимание наряду с другими биологически активными веществами, присутст- вующими в молозиве коров, заслуживают пептиды.
В результате исследований российских ученых путем высокотемпературного гидролиза говяжьего сырья в сочетании с энзимо-лизом протеолитическими ферментными препаратами Alcalase 2,5 L, Protamex, Protosub-tilin G3x, получены пептидные гидролизаты. На основе пептидных гидролизатов выработаны белковые нутрицевтики, рекомендованные для использования в качестве источника аминокислот и активных пептидов [4].
Учитывая постоянно возникающую устойчивость различных патогенов к существующей противомикробной терапии, антимикробные пептиды (Aps) в последнее время вызывают большой интерес в качестве потенциальных терапевтических агентов. Антимикробные являются незаменимым компонентом защитных сил организма. Они состоят преимущественно из коротких катионных пептидов с широким разнообразием структур [5].
Антимикробные пептиды – это тип низкомолекулярных пептидов, которые широко распространены в природе и являются компонентами врожденного иммунитета почти всех живых существ. Они играют важную роль в сопротивлении чужеродным вторгающимся микроорганизмам. Антимикробные пептиды обладают широким спектром активности в отношении бактерий, грибков, вирусов и других микроорганизмов, активны в отношении традиционных штаммов, устойчивых к антибиотикам, и с трудом вызывают развитие лекарственной устойчивости [6].
Антимикробные пептиды могут действовать внутриклеточно, например, на биосинтез белка или репликацию ДНК. На сегодняшний день прогресс в разработке новых подходов на основе выделения и исследования пептидов делает их многообещающим инструментом для противодействия возникающим инфекциям [7].
Но вместе с тем у некоторых пептидов, полученных естественным путем AMPs, имеются некоторые недостатки. Во-первых, короткий период полураспада из-за восприимчивости к деградации протеаз. Во-вторых, неактивность при физиологических концентрациях солей. В-третьих, цитотоксичность для клеток-хозяев. Наконец, отсутствие соответствующих стратегий для устойчивой и целенаправленной доставки AMPs.
Одним из эффективных методов выделения пептидов является ферментативный гидролиз сырья, содержащего белок. Для гидролиза часто используют фермент пепсин [8].
Цель исследования – определение физико-химических свойств пепсинового гидролизата молозива коров с последующем выделением, характеристикой и оценкой некоторых биологических свойств пептидов на примере цитотоксичности, антимикробной и противогрибковой активности.
Объекты и методы исследований
При изучении физико-химических свойств пепсинового гидролизата молозива коров определяли такие показатели как массовая доля сухих веществ, массовая доля белка, лактозы, жира, золя, титриметрическая кислотность и плотность.
Массовую долю сухих веществ определяли методом, описанном в ГОСТ Р 5227382007. Содержание белка оценивали методом Кьельдаля по ГОСТ 25179-2014. Содержание лактозы – по ГОСТ 34304-2017. Массовую долю жира – по ГОСТ 5867-90, массовую долю золы – по ГОСТ 51463-99. Плотность гидролизата определяли ареометрическим методом по ГОСТ Р 54758-2011. Кислотность гидролизата – титриметрическим методом по ГОСТ 3624-92 с применением тетраметра АКВИЛОН (Россия).
В работе представлены данные по изучению осадка гидролизата, для получения которого гидролизат центрифугировали при 3900 об/мин в течение 10 минут.
Осадок гидролизата растворяли в 10 % растворе щелочи методом препаративной хроматографии на силикагеле, элюэнт PBS и EtOH в изократическом соотношении 9:1 соответственно, выделенные фракции R(1), R(2) исследовали на МАЛДИ-ТОФ масс-спектрометре, расшифровку проводили с помощью базы данных Mascot, опция Peptide Fingerprint («Matrix Science», США) с использованием базы данных Protein NCBI.
Для изучения общей цитотоксичности клетки HEK293 выращивали на среде, содержащей DMEM, 10 % FBS, 1 % PS и высевали в 96-ти луночный планшет в концентрации 5x104 клеток/мл. К клеткам добавляли исследуемые гидролизаты в концентрациях от 0,1 до 0,5 мкг/мл, и инкубировали при температуре 37 °С в течение 24 ч. Далее культуральную среду удаляли, и лунки промывали промывочным раствором. Далее в лунки добавляли 150 мкл однократного красителя Neutral Red и инкубировали в течение 2-х часов. По истечении времени инкубации окрашивающий раствор удаляли, клетки промывали промывочным раствором. После чего в каждую лунку добавляли 150 мкл раствора Neutral Red Staining и инкубировали еще 2 часа. Далее клетки снова промывали промывочным раствором и добавляли 150 мкл солюбилизи- рующего раствора с последующей инкубацией при RT в течение 20 минут. Далее измеряли оптическую плотность при длине волны 540 нм.
Цитотоксичность вычислялась по формуле: ([OD отрицательный контроль] – [OD исследуемый образец]) / [OD отрицательный контроль] × 100 %.
Диско-диффузионным методом изучали антимикробные свойства осадка гидролизата против грамположительных и грамотрица-тельных бактерий и грибов. В качестве тест-штаммов выбраны E. coli – условно-патогенная бактерия, вызывающая гастроэнтерит у животных и человека, и грамположительная бактерия B. Subtilis и C. Albicans – грибок, входит в состав микробиоты желудочнокишечного тракта человека, но при определенных условиях может вызвать кандиоз.
Культивирование штаммов проводили на плотной питательной среде LB (агар – 1,5 %, триптон – 1 %, дрожжевой экстракт – 0,5 %, NaCl – 1 %) и жидкой питательной среде LB (триптон – 1 %, дрожжевой экстракт – 0,5 %, NaCl – 1 %) при температуре 37 °C.
Диффузионный метод определения антимикробной активности гидролизатов заключался в следующем. Тест-штамм высевали на агаризованную питательную среду газоном, и одновременно на газон помещали гидролизат. В качестве контроля использовался бумажный диск с питательной средой, в качестве препарата сравнения – диск с антибиотиком (из стандартного набора). Чашки Петри инкубировали при температуре, соответствующей оптимальной температуре роста каждого тест-штамма микроорганизма, в течение (24 ±
0,5) ч. Результаты учитывались по наличию и размеру (в мм) прозрачной зоны отсутствия роста микроорганизмов вокруг диска.
Результаты и их обсуждение
Результаты исследования физикохимических свойств гидролизата представлены в табл. 1. Установлено, что ферментативный гидролизат молозива коров отличается высоким содержанием белка – 9,16 % и низким содержанием жира – 0,25 %, по сравнению с исходным молозивом, что согласуется с данными химического состава молозива, представленными в работах авторов [16].
Следует отметить, что химический состав молозива коров зависит от времени, прошедшего после отела, с увеличением которого снижается массовая доля белка [9].
Состав полученного гидролизата также может отличаться в зависимости от технологических параметров: состав буферного раствора, соотношение фермент : субстрат, температура и время гидролиза, что отмечено в исследованиях [10].
Таблица 1
Физико-химические показатели пепсинового гидролизата молозива коров (n = 5)
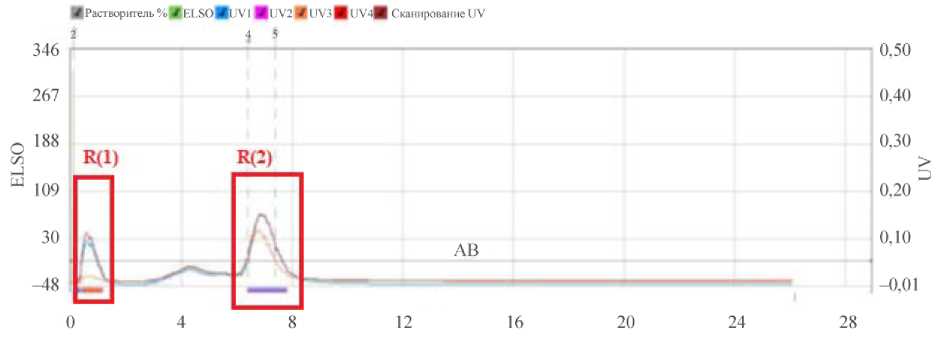
Рис. 1. Фракционный состав осадка ферментативного гидролизата молозива коров
|
Показатель |
Количество |
|
Массовая доля белка, % |
9,16 ± 0,06 |
|
Массовая доля жира, % |
0,25 ± 0,01 |
|
Массовая доля золы, % |
7,00 ± 0,21 |
|
Массовая доля сухих веществ, % |
17,57 ± 0,46 |
|
Плотность, г/см3 |
1,04 ± 0,03 |
|
Кислотность, оТ |
4,77 ± 0,12 |
Незначительное количество жира в гидролизате связано с его удалением при подготовке молозива для гидролиза. На рис. 1 представлен фракционный состав осадка ферментативного гидролизата молозива коров.
В осадке ферментативного гидролизата молозива коров выделено две фракции R (1) и R (2). Масс-спектр образцов выделенных фракций представлен на рис. 2 и 3.
Установлено, что пептидная цепь R (1) включает 6 аминокислотных остатков (P, A, F, S, I, K) в разной последовательности, образуя полипептид из 11 аминокислот. Аналогично пептид R (2) относится к полипептидам, так как в его цепь входят 7 аминокислотных остатков (IRHGCVS), некоторые из которых повторяются и образуют следующую аминокислотную последовательность IRHGRCVSCSR. Молекулярная масса выделенных пептидов отличается и составляет для пептида R (1) – 1,7 кДа, для пептида R (2) – 7 кДа. При сопоставлении полученных характеристик пептидов с базой данных Protein NCBI установлено, что пептид R (1) относится к малоизученному пептиду «Nuclear receptor 2C2-associated protein, Bos taurus», из доказанных функций которого является снижение жизнеспособности раковых клеток за счет подавления опосредованной NR2C2 трансактивации, и путем связывания между NR2C2/TR4, о чем свидетельствуют результаты исследований [11].
В табл. 2 представлены аминокислотные последовательности, молекулярная масса пептидных фракций, выделенных из осадка гидролизата.
Другие функции выделенного пептида R(1) не изучены. Пептид R (2) относится к пептидам «14 kDa phosphohistidine phosphatase, Pongo abelii», биологические функции которого не исследованы. На основании отсутствия данных по цитотоксичности выделенных пептидов нами проведено исследование общей цитотоксичности на клетках линии HEG 293 методом Neutral Red Assay при 24 часовой инкубации. Обоснованием выбора клеточной линии HEG 293 для исследований является то, что она широко используется в биотехнологических и биофармацевтиче-ских исследованиях при оценке общей цитотоксичности и производстве белков, пептидов, вирусов, а также при определении эффективности новых препаратов для генной терапии.
Результаты исследований представлены в табл. 3.
Цитотоксичность во всех трех измерениях при исследуемых концентрациях гидролизата от 0,1 до 0,5 мг/мл составляет от 0,9 до – 6,30, что свидетельствует об ее отсутствии, что согласуется с данными исследователей, утверждающих о низкой цитотоксичности пептидов [12].
Таким образом, токсический эффект гидролизата в концентрациях 0,1–0,5 мг/мл на клеточные линии HEK293 при экспозиции 24 часа не установлен.
Проведены исследования антимикробной активности осадка гидролизата молозива коров, результаты которых представлены в табл. 4.
Анализ результатов свидетельствует о том, что исследуемые образцы осадка гидролизата молозива коров проявляют антимикробную активность по отношению к грамот-рицательной бактерии E. Coli и грамположи-тельной B. Subtilis, но в меньшей степени, чем антибиотик «Канамицин». Так, зона лизиса E. Coli и B. Subtilis под действием осадка ферментативного гидролизата молозива коров составляет 11 и 12 мм, под влиянием антибиотика 25 и 26 мм. Установлена антимикробная активность гидролизата (зона лизиса C. Albicans 14 мм) при противомикробном препарате «Флуконазол» – 27 мм. Полученные данные о противомикробной активности пептидов молозива согласуются с исследованиями авторов, согласно которым пептиды животного происхождения проявляют широкий спектр антибактериальной активности, и большинство противомикробных пептидов содержат не более 50 аминокислот; около 50 % из них являются гидрофобными аминокислотами и часто образуют амфипатические трехмерные структуры [13].
В исследованиях [14] доказана противо-микробная активность пептидов, выделенных из тканей крупного рогатого скота, в отношении кишечной и синегнойной палочки, сальмонеллеза и золотистого стафилококка.
Полученные данные также подтверждаются исследованиями, согласно которым лабораторные крысы, инфицированные Escherichia coli, быстро излечивались и последствия заболевания полностью ликвидировались при регулярном употреблении коровьего молозива [15].
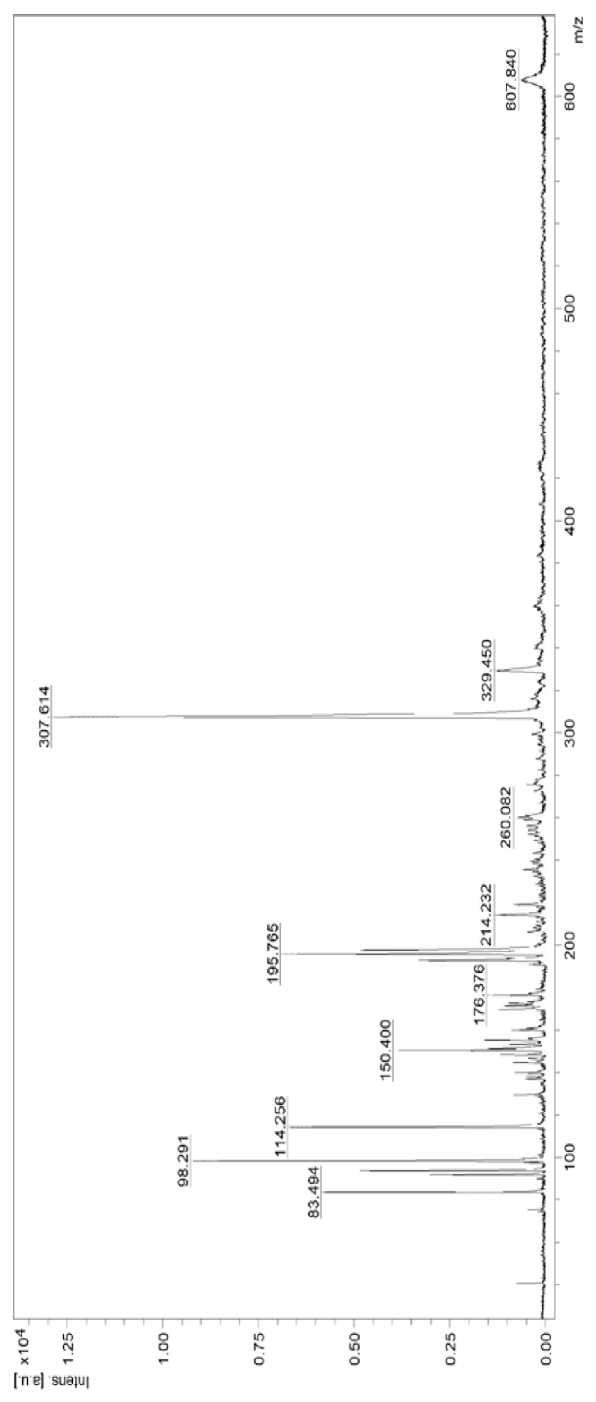
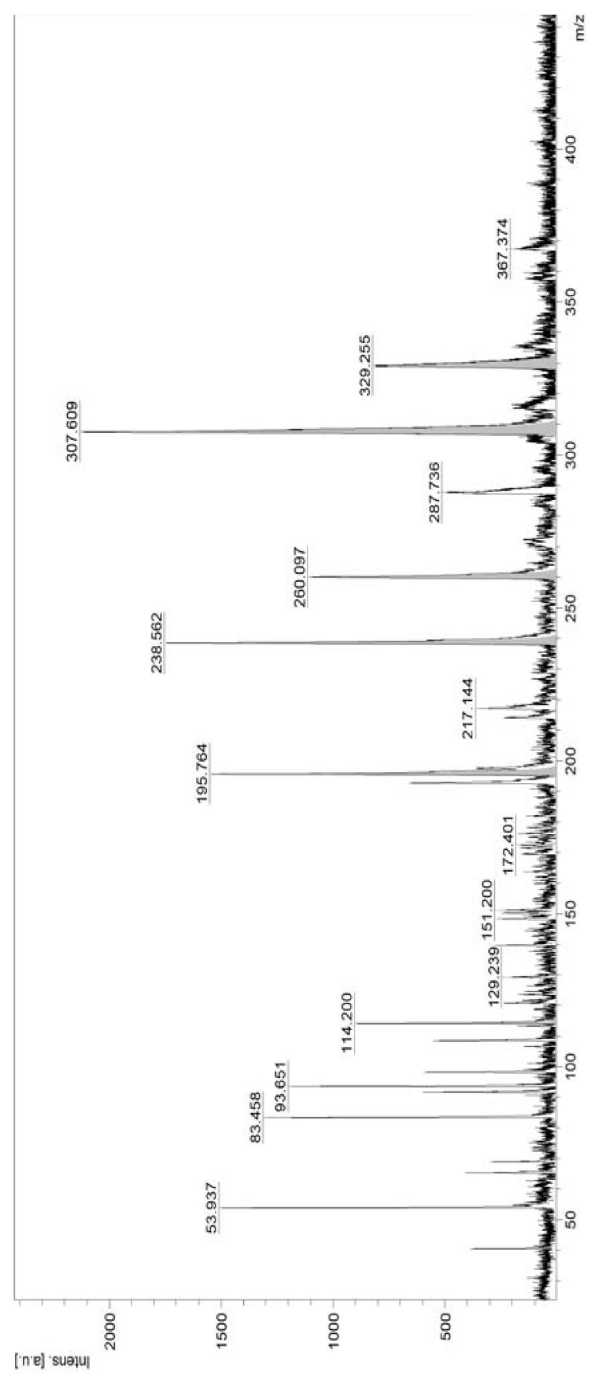
Таблица 2
Аминокислотная последовательность, молекулярная масса и идентификация и функция пептидных фракций, выделенных из осадка гидролизата
|
№ |
Аминокислотная последовательность |
Молекулярная масса, кДа |
Идентификация, функция (база NCBI) |
|
|
подобный пептид |
функции |
|||
|
R (1) |
P AFA AS SS I KA |
1,7 |
Nuclear receptor 2C2-associated protein, Bos taurus |
Подавление NR2C2 трансактивации, связывания между NR2C2/TR4 |
|
R(2) |
IRHGRCVS C S R |
7 |
14 kDa phosphohistidine phosphatase, Pongo abelii |
Биологическая функция остается неясной |
Примечание: А – аланин, G – глицин, V – валин, I – изолейцин, S – серин, С – цистеин, R – аргинин, К – лизин, Н – гистидин, Р– пролин, F – фенилаланин
Таблица 3
Результаты оценки цитотоксичности выделенных пептидов методом Neutral Red Assay при 24 часовой инкубации
|
Показатель |
Контроль |
Гидролизат R с концентрацией, мг/мл |
||
|
0,1 |
0,3 |
0,5 |
||
|
Измерение 1 |
89436 |
90531 |
89743 |
88645 |
|
Измерение 2 |
85682 |
86730 |
89216 |
87621 |
|
Измерение 3 |
90034 |
92746 |
95673 |
91843 |
|
Цитотоксичность 1 |
–1,30 |
–0,40 |
0,90 |
|
|
Цитотоксичность 2 |
–1,30 |
–4,20 |
–2,30 |
|
|
Цитотоксичность 3 |
–3,10 |
–6,30 |
–2,00 |
|
Таблица 4
Антимикробная активность осадка ферментативного гидролизата молозива коров
Таким образом, осадок ферментативного гидролизата молозива коров, возможно, благодаря наличию пептидов, обладает противогрибковой и противомикробной активностью к грампо-ложительным и грамотрицательным бактериям.
Выводы
На основании проведенных исследований из осадка пепсинового гидролизата молозива коров выделены два биологически активных полипептида, состоящие из 11 аминокислот с разной последовательностью и молекулярной массой. При идентификации по базе данных Protein NCBI установлено, что один относится
к пептиду «14 kDa phosphohistidine phosphatase, Pongo abelii», биологическая функция которого пока остается невыясненной, а второй пептид относится к «Nuclear receptor 2C2-associated protein, Bos taurus», который характеризуется противоопухолевой активностью. Доказано, что выделенные нами пептиды не являются цитотоксичными и относятся к биологически активным пептидам так как подавляют рост бактерий и грибков. Следует отметить, что исследования по оценки биологической активности пептидов в разных направлениях необходимо продолжить для выяснения возможного их использования в составе лекарственных препаратов и продуктов питания специализированного назначения для профилактики и лечения азличных заболеваний
Список литературы Исследование физико-химических и биологических свойств, пептидного состава пепсинового гидролизата молозива коров
- Sacerdote P., Mussano F., Franchi S., Panerai A. E., Bussolati G., Carossa S. & Bussolati B. (2013). Biological components in a standardized derivative of bovine colostrum. Journal of Dairy Science, 96(3), 1745-1754.
- Bagwe S., Tharappel L.J., Kaur G., & Buttar H.S. (2015). Bovine colostrum: an emerging nutraceutical. Journal of Complementary and Integrative Medicine, 12(3), 175-185.
- McGrath B.A., Fox P.F., McSweeney P.L., & Kelly A.L. (2016). Composition and properties of bovine colostrum: a review. Dairy Science & Technology, 96(2), 133-158.
- Mezenova N.Y., Agafonova S.V., Mezenova O.Y., Baidalinova L.S., & Grimm T. (2021). Obtaining and estimating the potential of protein nutraceuticals from highly mineralized collagen-containing beef raw materials. Theory and practice of meat processing, 6(1), 10-22.
- Bin Hafeez A., Jiang X., Bergen P.J., & Zhu Y. (2021). Antimicrobial peptides: An update on classifications and databases. International Journal of Molecular Sciences, 22(21), 11691.
- Li X., Zuo S., Wang B., Zhang K., & Wang Y. (2022). Antimicrobial Mechanisms and Clinical Application Prospects of Antimicrobial Peptides. Molecules, 27(9), 2675.
- Vanzolini T., Bruschi M., Rinaldi A.C., Magnani M., & Fraternale A. (2022). Multitalented synthetic antimicrobial peptides and their antibacterial, antifungal and antiviral mechanisms. International Journal of Molecular Sciences, 23(1), 545.
- Tripoteau L., Bedoux G., Gagnon J., & Bourgougnon N. (2015). In vitro antiviral activities of enzymatic hydrolysates extracted from byproducts of the Atlantic holothurian Cucumaria frondosa. Process Biochemistry, 50(5), 867-875.
- Леонтьева С.А., Тихонов С.Л., Тихонова Н.В., & Лазарев В.А. (2021). Молозиво коров -перспективное сырье для производства пищевых продуктов [Leontieva S.A., Tikhonov S.L., Tikhonova N.V., Lazarev V.A. (2021). Colostrum as a Promising Raw Material for the Food Production]. Food industry, 6(2), 23-33.
- Alvarez J.C., Lasne L., Etting I., Cheron G., Abadie V., Fabresse N., & Larabi I.A. (2018). Hair analysis does not allow discriminating between acute and chronic administrations of a drug in young children. International journal of legal medicine, 132(1), 165-172.
- Saleembhasha A., & Mishra S. Long non-coding RNAs as pan-cancer master gene regulators of associated protein-coding genes.
- Gomara M.J., Perez Y., Martinez J.P., Barnadas-Rodriguez R., Schultz A., von Briesen H., & Haro I. (2019). Peptide assembly on the membrane determines the HIV-1 inhibitory activity of dualtargeting fusion inhibitor peptides. Scientific reports, 9(1), 1-13.
- Furukawa N., & Popel A.S. (2021). Peptides that immunoactivate the tumor microenvironment. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer, 1875(1), 188486.
- Shteinfer-Kuzmine, A., Amsalem, Z., Arif, T., Zooravlov, A., & Shoshan-Barmatz, V. (2018). Selective induction of cancer cell death by VDAC 1 -based peptides and their potential use in cancer therapy. Molecular oncology, 12(7), 1077-1103.
- Mehra R., Singh R., Nayan V., Buttar H.S., Kumar N., Kumar S., & Kumar H. (2021). Nutritional attributes of bovine colostrum components in human health and disease: a comprehensive review. Food Bioscience, 40, 100907.
- Meng Q., Wu Y., Sui X., Meng J., Wang T., Lin Y., & Gao Y. (2020). POTN: human leukocyte antigen-A2 immunogenic peptides screening model and its applications in tumor antigens prediction. Frontiers in immunology, 11, 02193.
- Vanzolini T., Bruschi M., Rinaldi A.C., Magnani M., & Fraternale A. (2022). Multitalented synthetic antimicrobial peptides and their antibacterial, antifungal and antiviral mechanisms. International Journal of Molecular Sciences, 23(1), 545.


