Исследование галогенциклизации 8-бром-3-аллилтио-5H-[1,2,4]триазино[5,6-b]индола
Автор: Рыбакова Анастасия Владимировна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Краткие сообщения
Статья в выпуске: 36 (295), 2012 года.
Бесплатный доступ
Осуществлен синтез 8-бром-3-аллилтио-5H-[1,2,4]триазино[5,6- b]индола и установлено, что он реагирует с галогенами по схеме реакции галогенциклизации с образованием галогенидов 8-бром-3-галогенметил-2,3-дигидро-10H-[1,3]тиазоло[2',3':3,4][1,2,4]триазино[5,6-b]индолия.
8-бром-3-аллилтио-5н-[1, 4]триазино[5, 6-b]индол, галогенциклизация, галогениды 8-бром-3-галогенметил-2, 3-дигидро-, 3]тиазоло[2'', 6-b]индолия
Короткий адрес: https://sciup.org/147160252
IDR: 147160252 | УДК: 547.873
Текст краткого сообщения Исследование галогенциклизации 8-бром-3-аллилтио-5H-[1,2,4]триазино[5,6-b]индола
В литературе [1] описан синтез 3-тиосемикарбазона 5-бромизатина ( 1 ) конденсацией 5-бро-мизатина с тиосемикарбазидом. Циклизация соединения 1 в щелочной среде приводит к образованию 8-бром-3-меркапто-5 Н -[1,2,4]триазино[5,6- b ]индола ( 2 ), который обладает высокой биологической активностью [2], поэтому изучение его свойств и синтез его новых производных представляет большой интерес для исследователей.
Целью данной работы является синтез 8-бром-3-аллилтио-5 Н -[1,2,4]триазино[5,6- b ]индола ( 3 ) из соединения 2 и изучение его взаимодействия с галогенами.
Обсуждение результатов
Нами впервые осуществлено аллилирование соединения 2 бромистым аллилом в среде NaOH–ДМСО–H2O при комнатной температуре. Найдено, что в результате реакции с выходом 40 % образуется соединение 3 . В свою очередь соединение 2 получено при кипячении соединения 1 в 1 н растворе NaOH, а соединение 1 - конденсацией гидрохлорида тиосемикарбазида с 5-бромизатином, который получен бромированием изатина в уксусной кислоте (схема 1). Попытки осуществить синтез соединения 3 в спиртах в присутствии алкоксидов и гидроксидов щелоч-
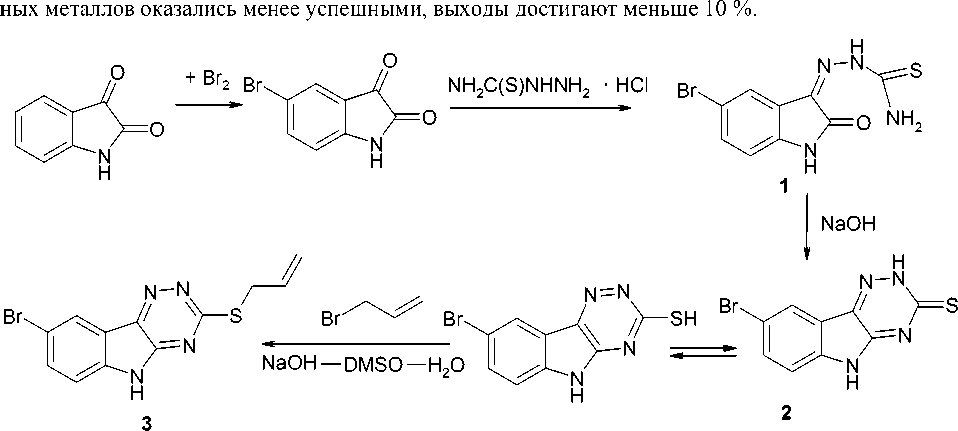
Схема 1. Схема синтеза 8-бром-3-аллилтио-5 Н -[1,2,4]триазино[5,6- b ]индола из изатина
В работе [3] нами приведены данные ЯМР 1Н соединения 3 в сравнении с 3-аллилтио-5Н-[1,2,4]триазино[5,6-b]индолом (4). Отмечено, что наличие электроноакцепторного атома брома вызывает смещение сигналов ароматических протонов в слабое поле, а сигналы протонов аллильной группы практически остаются без изменений.
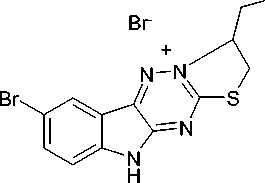
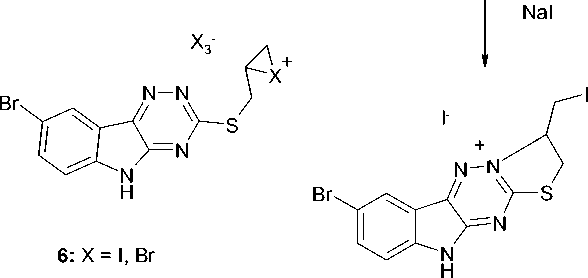
Ранее [4] показано, что соединение 4 реагирует с галогенами по схеме реакции галогенцик-лизации с участием атома N-2. В настоящей работе нами впервые исследована реакция соединения 3 с бромом и иодом в хлороформе. Выбор растворителя обусловлен тем, что соединение 3 не растворяется в диэтиловом эфире, CCl 4 и растворяется в хлороформе. В результате проведенных исследований установлено, что, реакция протекает так же, как с соединением 4 по атому азота N-2 с образованием иодида 8-бром-3-иодметил-2,3-дигидро-10 H -[1,3]тиазоло[21,2,4][3,4: ׀ 3, ׀ ]триазино [5,6- b ]индолия ( 5a ) и бромида 8-бром-3-бромметил-2,3-дигидро-10 H -[1,3]тиазоло[21,2,4][3,4: ׀ 3, ׀ ] триазино[5,6- b ]индолия ( 5b ). Галогенциклизация как правило протекает по электрофильному механизму [5] через галогенониевый ион ( 6 ). Следует отметить, что при галогенциклизации образуются полигалогениды, которые в случае трииодида разрушаются иодидом натрия, а в случае трибромида – ацетоном до соответствующих моногалогенидов 5а и 5b (схема 2.).
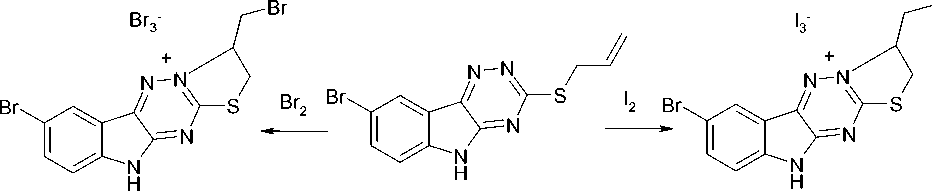
CH3C(O)CH3
5b
5a
Схема 2. Схема синтеза галогенидов 8-бром-3-иодметил-2,3-дигидро-10 H -[1,3]тиазоло[2|,3|:3,4][1,2,4]триазино[5,6- b ]индолия (5a)
В спектре ЯМР 1Н продуктов галогенциклизации 5а (5b)1 наблюдаются сигналы протонов СH 2 Hal-группы при 3,90 м.д. (3,93 м.д.), двух протонов SCH 2 -группы при 4,11 м.д. и 3,65 м.д. (4,13 м.д. и 4,06 м.д) и протона 3-Н при 5,36 м.д. (4,83 м.д). Данные сигналы незначительно смещены в сильное поле по сравнению с продуктами галогенциклизации соединения 4 [4].
Экспериментальная часть
Спектры ЯМР 1Н растворов веществ в ДМСО-d6 получены на спектрометре Bruker DRX-400 (400 МГц), внутренний стандарт ТМС.
5-Бромизатин . К постоянно перемешиваемому и охлаждаемому раствору 2,205 г (15 ммоль) изатина в уксусной кислоте по каплям добавляют раствор 0,7 мл (15 ммоль) брома в уксусной кислоте. Образующийся оранжевый осадок отфильтровывают и сушат. Выход 2,60 г (77 %). Т. пл. 232 °С (из этилового спирта). Лит. 255–256 °С [6].
3-Тиосемикарбазон 5-бромизатина (1) . К кипящему раствору 2,26 г (0,01 моль) 5-бромизатина в 400 мл воды добавляют кипящий раствор 1,36 г (0,01 моль) гидрохлорида тио-
Краткие сообщения
семикарбазида в воде и нагревают при постоянном перемешивании в течение 1 ч. Выпавший желтый хлопьевидный осадок отфильтровывают горячим и сушат. Выход 2,530 г (85 %). Т. пл. > 230 °С .
8-Бром-3-меркапто-5 Н -[1,2,4]триазино[5,6- b ]индолом (2) . Раствор 2 г (6 ммоль) соединения 1 в 30 мл 1 н раствора NaOH кипятят в течении 5 ч. Полученный раствор отфильтровывают и подкисляют уксусной кислотой до нейтральной среды. Образующийся желто-оранжевый осадок отфильтровывают и сушат. Выход 1,45 г (77 %). Т. пл. > 230 °С .
8-Бром-3-аллилтио-5 Н -[1,2,4]триазино[5,6- b ]индол (3). К раствору 0,334 г (1 ммоль) соединения 2 в 10 мл ДМСО добавляют 0,04 г (1 ммоль) NaOH в 3 мл воды, 0,121 г (1 ммоль) бромистого аллила и перемешивают 2 ч. Желтый осадок отфильтровывают, промывают водой и сушат. Выход 0,120 г (40 %). Т. пл. > 200 °С (из ДМФА-вода). Спектр ЯМР 1Н, δ, м.д. (J, Гц): 3,98 (2Н, д, J=6,81; SCH 2 ); 5,17 (1Н, д.д.; J=10,02; J=1,00, =СН 2 ); 5,42 (1Н, д.д., J=1,00; J=17,00; =CН 2 ); 6,05 (1Н, м, СН=); 7,55; 7,81; 8,46 (4Н, бензольное кольцо).
Иодид 8-бром-3-иодметил-2,3-дигидро-10 H -[1,3]тиазоло[2|,3|:3,4][1,2,4]триазино[5,6- b ]индо-лия (5a). Раствор 0,1 г (0.4 ммоль) соединения 4 в 5 мл хлороформа приливают к раствору 0,2 г (1 ммоль) иода в 5 мл хлороформа. Через 48 ч отгоняют хлороформ и остаток растворяют в ацетоне, добавляют 50 мг NaI. Спустя 24 ч желтый осадок отфильтровывают, сушат. Выход 0,076 г (40 %). Т. пл. 214 °С . Спектр ЯМР 1Н, δ, м.д.: 3,65 (1Н, м., SCH); 3,90 (2Н, м., СН 2 I); 4,11 (1Н, м., SCH); 5,36 (1Н, м, Н–3); 7,67; 7,94; 8,42 (4Н, бензольное кольцо).
Бромид 8-бром-3-бромметил-2,3-дигидро-10 H -[1,3]тиазоло[2|,3|:3,4][1,2,4]триазино[5,6- b ]ин-долия (5b). К раствору 0,1 г (0,4 ммоль) соединения 4 в 10 мл хлороформа при охлаждении добавляют раствор 0,02 мл (0,4 ммоль) брома в 10 мл хлороформа. Через 48 ч отфильтровывают желтый осадок. Выход 0,05 г (33 %). Т. пл. > 200 °С . Спектр ЯМР 1Н, δ, м.д.: 4,08 (1Н, м, SCH); 3,93 (2Н, м., СН 2 Br); 4,13 (1Н, м, SCH); 4,83 (1Н, м, Н-3); 7,57; 7,83; 8,47 (4Н, бензольное кольцо).
Список литературы Исследование галогенциклизации 8-бром-3-аллилтио-5H-[1,2,4]триазино[5,6-b]индола
- Томчин А.Б. Семикарбазоны и тиосемикарбазоны гетероциклического ряда. LIV. Производные 1,2,4-триазина, 1,2,4-триазола и 1,3,4-тиадиазола из 1-ацетил-5-бромизатина и тиосемикарбазида/А.Б. Томчин//Журнал органической химии. -1990. -Вып. 4. -№ 26. -С. 860-873.
- Томчин А.Б. Производные тиомочевины и тиосемикарбазида. Строение, превращения и фармакологическая активность. Антигипоксическое и актопротекторное действие производных имидазо[4,5-b]индола/А.Б. Томчин, В.С. Вележева, Е.Б. Шустов//Химико-фармацевтический журнал. -1998. -№ 2. -С. 7-10.
- Журавлёва А.В. Исследование производных 3-меркапто-5Н-1,2,4-триазино[5,6-b]индола методом ЯМР1Н/А.В. Журавлёва, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 3. -№ 11 (187). -С. 16-19.
- Ким Д.Г. Галогенциклизация 3-аллилтио-5Н-[1,2,4]триазино[5,6-b]индола/Д.Г. Ким, А.В. Журавлёва//Химия гетероциклических соединений. -2010. -№ 7. -С. 1107-1109.
- Ильиных Е.С. Исследование иодциклизации S-аллильных производных 3-меркапто-1,2,4-триазолов/Е.С. Ильиных, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 4. -№ 31 (207). -С. 18-23.
- Жунгиету Г.И. Изатин и его производные/Г.И. Жунгиету, М.А. Рехтер. -Кишинев: Штиинца, 1977. -225 с.

![Исследование галогенциклизации 8-бром-3-аллилтио-5H-[1,2,4]триазино[5,6-b]индола Исследование галогенциклизации 8-бром-3-аллилтио-5H-[1,2,4]триазино[5,6-b]индола](/file/cover/147160252/issledovanie-galogenciklizacii-8-brom-3-alliltio-5h124-triazino-56-b-indola.png)
