Исследование иодциклизации S-аллильных производных 3-меркапто-1,2,4-триазолов
Автор: Ильиных Елена Сергеевна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 31 (207), 2010 года.
Бесплатный доступ
Установлено, что взаимодействие S-аллильных производных 3-меркапто-1,2,4-триазолов с иодом сопровождается образованием смеси нескольких продуктов иодциклизации (линеарное и ангулярное замыкание пяти- и шестичленных циклов). Структуры исходных и синтезированных соединений исследованы методами хромато-масс-спектрометрии и спектроскопии ЯМР 1Н.
З-аллилтио-1, 4-триазол, 5-метил-3-аллилтио-1, 5-трет-бутил-3-аллилтио-1, 1-ацетж-5-метил-3-аллттио-1, иодциклизация, хромато-масс-спектрометрия, спектроскопия ямр 1н
Короткий адрес: https://sciup.org/147160168
IDR: 147160168 | УДК: 547.792.9
Текст обзорной статьи Исследование иодциклизации S-аллильных производных 3-меркапто-1,2,4-триазолов
1,2,4-Триазол-З-тионы и их производные остаются предметом широких научных исследований. Получение новых конденсированных гетероциклических соединений на основе 3-меркапто-1,2,4-триазолов является актуальной задачей, поскольку эти соединения обладают широким спектром физиологической активности: анальгетической, сосудорасширяющей, противоопухолевой, бактерицидной, оказывают успокаивающее действие [1]; они используются как высокоэффективные добавки к фотоматериалам [2], а также в качестве ингибиторов коррозии цветных металлов и сплавов на их основе [3].
В литературе [4, 5] описана основно-катализируемая внутримолекулярная циклизация S-фенацил- и этилтиоацетатных производных 4-амино-З-меркапто-1,2,4-триазолов, протекающая с образованием [1,2,4]триазоло[3,4-6][1,3,4]тиадиазинов, однако имеется мало сведений о циклизации S-аллильных производных З-меркапто-1,2,4-триазолов. Ранее [6] было показано, что взаимодействие З-аллилтио-5-фенил-1,2,4-триазола с иодом протекает с образованием четырех продуктов иодциклизации по атомам азота N-2 и N-4 (линеарное и ангулярное замыкание тиазолиновых и тиазиновых циклов). В настоящей работе нами с целью синтеза новых представителей гетероциклических соединений на основе З-меркапто-1,2,4-триазолов впервые изучено взаимодействие с иодом 3-аллилтио- (1а), 5-метил-3-аллилтио- (1Ь), 5-трет-бутил-З-аллилтио- (1с) и 1-ацетил-5-метил-3-аллилтио-1,2,4-триазола (2).
Экспериментальная часть
Спектры ЯМР *Н растворов веществ в ДМСО-с/б записаны на спектрометре Broker DRX-400 (400 МГц), внутренний стандарт ТМС. Масс-спектры сняты на ГХ/МС-ЭВМ фирмы Agilent Technologies, газовый хроматограф 6890N, масс-селективный детектор 5975.
З-Аллилтио-1,2,4-триазол (1а), 5-метил-3-аллилтио-1,2,4-триазол (1Ь), З-ш/лчи-бутил-З-аллилтио-1,2,4-триазол (1с) и 1-ацетил-5-метил-3-аллилтио-1,2,4-триазол (2). Масс-спектр (ЭУ, 70 эВ), m/z (10ТН., %): 141 [М]+ (42), 126 [М-СН3]+ (100), 108 [M-SH]+ (40) (la); 155 [М] (43), 140 [М-СН3]+ (100), 122 [M-SH]+ (39) (1b); 197 [М]+ (17), 182 [М-СН3]+ (52), 41 (100) (1с); 155 [М-43]+ (23), 140 (63), 122 (28), 41 (100) (2).
Общая методика иодирования соединений la-с и 2. К раствору 2 ммоль иода в 3 мл растворителя (ледяная уксусная кислота, эфир или хлороформ) добавляют раствор 1 ммоль аллил-сульфида (lac, 2) в 3 мл растворителя. Реакционную смесь выдерживают 6 сут при комнатной температуре (20-25 °C) и отделяют образовавшуюся смесь трииодидов. Выход смеси 43 % (За и 4а); 50 % (ЗЬ и 4Ь); 52 % (ЗЬ, 4Ь и 5); 49 % (4с и 6с); 50 % (7 и 8).
6-Иод-3-метил-6,7-дигидро-5/7-[1,2,4]триазоло[3,4-6][1,3]тиазин (11) и 6-иод-2-метил-6,7-дигидро-5/7-[1,2,4]триазоло[5,1-6][1,3]тиазин (12). К раствору смеси трииодидов ЗЬ и 6Ь в 5 мл ацетона добавляют при охлаждении раствор 3,6 ммоль Na2S2O3-5H2O и 1,2 ммоль Na2CO3 в 10 мл воды. Выпавшие кристаллы оснований 11 и 12 отделяют и сушат. Общий выход 48 %.
Il’inykh Elena Sergeevna - Postgraduate Student of Organic Chemistry Subdepartment, Chemistry Department, South Ural State University. 76, Lenin avenue, Chelyabinsk, 454080.
Ильиных Елена Сергеевна - аспирант кафедры органической химии, химический факультет, ГОУ ВПО «Южно-Уральский государственный университет». 454080, г. Челябинск, пр. им. В.И. Ленина, 76.
Kim Dmitriy Gymnanovich - Dr. Sc. (Chemistry), Professor, Organic Chemistry Subdepartment, Chemistry Department, South Ural State University. 76, Lenin avenue, Chelyabinsk, 454080.
Ким Дмитрий Гымнанович - доктор химических наук, профессор, кафедра органической химии, химический факультет, ГОУ ВПО «Южно-Уральский государственный университет». 454080, г. Челябинск, пр. им. В.И. Ленина, 76.
Спектральные данные ЯМР ]Н исходных и полученных соединений приведены в таблице.
Данные элементного анализа синтезированных соединений За, Ь, 4а-с, 5, 6Ь, с, 7 и 8 на углерод, водород, азот и серу соответствуют расчетным.
Спектральные данные ЯМР 1Н исходных и синтезированных соединений
|
Соединение |
Спектр ЯМР ’Н, 6, м.д. (7, Гц) |
|
1а |
3,78 (2Н, д, SCH2, 7=6,90); 5,07 (Ш, дт, =СН2,7=0,81, ^=10,02); 5,23 (1Н, дк, =СН2,7=1,42,7=16,98); 5,92 (1Н, м, -СН=); 8,59 (1Н, с, Н-5) |
|
1b |
2,30 (ЗН, с, СН3); 3,70 (2Н, д, SCH2,7=6,85); 5,06 (Ш, д.кв, =СН2,7=0,88,7=10,00); 5,22 (1Н, дк, =СН2,7=1,38,7=16,98); 5,91 (1Н, м, -СН=); 13,60 (1Н, уш. с, NH) |
|
1с |
1,40 (9Н, с, Z-Bu); 3,76 (2Н, дт, SCH2, 7=1,12,7=7,02); 5,06 (1Н, д.кв, =СН2, 7=0,64,7=9,99); 5,25 (1Н, дк, =СН2,7=1,32,7=16,95); 5,96 (Ш, м, -СН=) |
|
2 |
2,37 (ЗН, с, СНз -5); 2,62 (ЗН, с, СН3); 3,88 (2Н, дт, SCH2,7=1,01,7=7,00); 5,20 (Ш, дк, =СН2,7=0,99,7=10,12); 5,36 (Ш, дк, =СН2,7=1,31,7=17,00); 6,01 (Ш, м,-СН=) |
|
За |
3,63 (Ш, дд, SCH2,7=8,23,7=13,05); 3,71 (1Н, дд, SCH2,7=2,99,7=12,96); 4,49 (Ш, дд, NCH2,7=7,52,7=13,52); 4,70 (Ш, дд, NCH2,7=3,81,7=13,47); 4,96 (Ш, м, СШ); 8,90 (1Н, с, Н-3) |
|
ЗЬ |
2,38 (ЗН, с, СНз); 3,59 (1Н, дд, SCH2,7=8,85,7=12,88); 3,65 (Ш, дд, SCH2,7=3,51, 7=12,79); 4,30 (Ш, дд, NCH2,7=8,59, >13,14); 4,56 (1Н, дд, NCH2,7=4,33,7=13,09); 4,87 (Ш, м, СШ) |
|
4а |
3,73 (1Н, д, СН21,7=3,56); 3,75 (1Н, д, СЩ, 7=2,03); 3,88 (Ш, дд, SCH2, >6,03, >11,62); 4,33 (Ш, дд, SCH2,7=7,75,7=11,70); 5,05 (1Н, м, NCH); 8,98 (Ш, с, Н-2) |
|
4Ь |
2,60 (ЗН, с, СНз); 3,68 (1Н, дд, СН21,7=6,60,7=11,20); 3,72 (1Н, дд, СН21,7=3,78, 7=11,34); 3,93 (Ш, дд, SCH2,7=4,14,7=11,91); 4,42 (Ш, дд, SCH2,7=8,02,7=11,91); 5,06 (1Н, м, NCH) |
|
4с |
1,38 (9Н, с, Z-Bu); 3,58 (Ш, дд, СН21,7=9,70,7=11,07); 3,68 (1Н, дд, СН21,7=2,84, 7=13,14); 3,97 (1Н, дд, SCH2,7=0,67,7=11,85); 4,43 (Ш, дд, SCH2,7=7,08,7=11,97); 5,10 (1Н,м, NCH) |
|
5 |
2,46 (ЗН, с, СНз); 3,72 (Ш, д, СН21,7=5,09); 3,74 (Ш, д, СН21,7=2,44); 4,19 (Ш, дд, NCH2, 7=4,26,7=11,82); 4,40 (Ш, дд, NCH2,7=7,48,7=11,83); 4,99 (1Н,м, SCH) |
|
бс |
1,38 (9Н, с, Z-Bu); 3,42 (Ш, дт, SCH2,7=1,52,7=11,17); 3,54 (1Н, дд, SCH2,7=7,10, 7=13,05); 4,46 (1Н, дд, NCH2,7=7,05,7=13,85); 4,66 (Ш, м, NCH2); 5,18 (1Н, м, СШ) |
|
7 |
2,52 (ЗН, с, СНз-5); 2,58 (ЗН, с, СН3); 3,67 (1Н, дд, SCH2,7=6,70,7=11,30); 3,70 (Ш, дд, SCH2,7=3,83,7=9,12); 4,38 (Ш, дд, NCH2,7=8,65,7=12,88); 4,67 (1Н, дд, NCH2,7=4,28,7=13,29); 4,85 (1Н, м, CHI) |
|
8 |
2,52 (ЗН, с, СНз-5); 2,58 (ЗН, с, СН3); 3,69 (Ш, дд, СН21,7=3,83,7=9,12); 3,76 (1Н, дд, СН21, >3,07,7=13,44); 3,92 (Ш, дд, SCH2,7=4,13, >11,90); 4,42 (Ш, дд, SCH2, 7=7,85,7=10,79); 5,05 (Ш, м, NCH) |
|
И |
2,28 (ЗН, с, СНз); 3,53 (Ш, дд, SCH2,7=8,16,7=12,91); 3,57 (Ш, дд, SCH2,7=3,96, 7=13,26); 4,24 (Ш, дд, NCH2,7=8,45, >13,03); 4,48 (Ш, дд, NCH2, >4,14,7=13,05); 4,87 (Ш, м, СШ) |
|
12 |
2,18 (ЗН, с, СНз); 3,55 (Ш, дд, SCH2,7=8,10,7=13,28); 3,63 (Ш, дд, SCH2,7=2,54, 7=13,23); 4,40 (Ш, дд, NCH2,7=6,87, >13,82); 4,64 (Ш, дд, NCH2,7=3,87, >13,49); 5,04 (Ш, м, СШ) |
Обсуждение результатов
Электрофильная гетероциклизация соединений la- c и 2 теоретически может протекать по двум нуклеофильным центрам (атомам азота N -2 и N-4) с образованием смеси нескольких продуктов циклизации. Нами изучена иодциклизация соединений la c и 2 и методом ЯМР !Н исследовано строение полученных продуктов.
Органическая химия
Установлено, что взаимодействие с иодом незамещенного 3-аллилтио-1,2,4-триазола (1а) в хлороформе и в ледяной уксусной кислоте сопровождается ангулярным и линеарным замыканием тиазинового и тиазолинового циклов с образованием смеси двух продуктов иодциклизации -трииодидов 6-иод-6,7-дигидро-17/,57А[1,2,4]триазоло[3,4-й][1,3]тиазиния (За) и 6-иодметил-5,6-дигидро[1,3]тиазоло[3,2-5][1,2,4]триазолия (4а), которые под действием Nai в ацетоне превращаются в соответствующие иодиды. Соотношение соединений За и 4а составляет 1,08 : 0,28 (СНС13) и 1,00 : 0,07 (АсОН), соответственно. Ангулярное (по атому азота N-4) и линеарное (по атому азота N—2) замыкание тиазинового и тиазолинового циклов наблюдается и при иодциклизации 1-ацетил-5-метил-3-аллилтио-1,2,4-триазола (2): в данном случае образуется смесь трииодидов 6-иод-2-ацетил-3-метил-б,7-дигидро-577-[1,2,4]триазоло[3,4-6][1,3]тиазиния (7) и 6-иодметил-1-ацетил-2-метил-5,6-дигидро[1,3]тиазоло[3,2-6][1,2,4]триазолия (8) в соотношении 0,85 : 1,00.
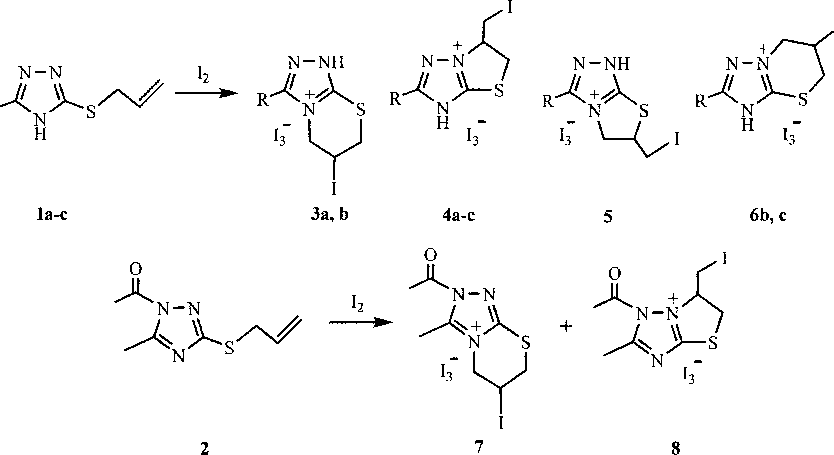
Иодциклизация S-аллильных производных 1,2,4-триазол-З-тионов 1а-с и 2: 1, 3,4 а - R = Н; 1, 3, 4, 6 b и 5 - R = Me; 1,4, 6 с - R = t-Bu
Иодирование 5-метил-З-аллилтио-1,2,4-триазола (1Ь) в хлороформе приводит к образованию смеси трииодидов 6-иод-3-метил-6,7-дигидро-177,5Я-[1,2,4]триазоло[3,4-/>][1,3]тиазиния (ЗЬ), б-иодметил-2-метил-5,6-дигидро[1,3]тиазоло[3,2-^][1,2,4]триазолия (4Ь) и 6-иодметил-З-метил-5,6-дигидро[1,3]тиазоло[2,3-с][1,2,4]триазолия (5). При этом следует отметить, что продукт 5 является неожиданным для реакции соединения 1Ь с иодом, поскольку образование тиазолотриазо-лиевых систем типа 5 характерно для иодирования N-аллильных производных 1,2,4-триазол-З-тионов [7, 8]. Присутствие трииодида 5 в смеси продуктов иодциклизации в данном случае может быть объяснено при рассмотрении механизма реакции.
Промежуточной структурой в реакции иодциклизации соединения 1Ь является иодониевый ион (9), который, вероятно, может претерпевать определенные структурные изменения, в результате чего образуются другие циклические интермедиаты. Одним из таковых является тиирание-вый ион (10), дальнейшая циклизация которого и объясняет появление неожиданного продукта 5 в реакции соединения 1Ь с иодом.
1Ь
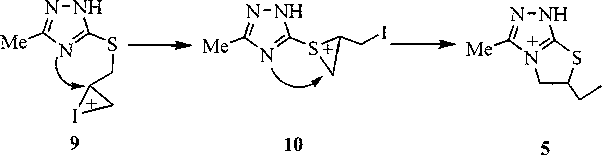
Механизм иодциклизации соединения 1Ь
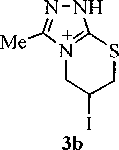
Нами найдено, что при выдерживании раствора смеси трииодидов ЗЬ, 4Ь и 5 в ДМФА в течение длительного времени происходит увеличение содержания триазолотиазина ЗЬ, в результате чего соединение ЗЬ выделено нами в индивидуальном виде. На наш взгляд, это обусловлено ди-гидротиазин-тиазолиновой перегруппировкой, которая протекает через промежуточный тиира-ниевый ион [9]. В случае реакции иодирования соединения 1Ь в ледяной уксусной кислоте образуется смесь трииодидов ЗЬ и 4Ь с преобладанием (более 90 %) соединения ЗЬ. Однако при последующей обработке фильтрата раствором NaI2H2O в ацетоне тиазолотриазол 4Ь также выделен как индивидуальное соединение в виде соответствующего иодида.
Установлено, что продукты иодциклизации соединения 1Ь в эфире - трииодиды ЗЬ и 6Ь -под действием водного раствора Na2S2O3 и Na2CO3 подвергаются дегидрогалогенированию с отщеплением сразу двух молекул Ш и образованием 6-иод-3-метил-6,7-дигидро-577-[1,2,4]триазоло [3,4-/>][1,3]тиазина (И) и 6-иод-2-метил-6,7-дигидро-5Я-[1,2,4]триазоло[5,1-5][1,3]тиазина (12), представляющих собой две отличные друг от друга кристаллические фазы. В спектрах ЯМР 'Н оснований 11 и 12 сигналы протонов находятся в более сильном поле по сравнению с сигналами протонов соответствующих трииодидов, что свидетельствует об исчезновении положительного заряда на атоме азота триазольного кольца вследствие дегидрогалогенирования. На хроматограмме, полученной для раствора соединения 11 в 2-пропаноле, имеется два пика молекулярных ионов (m/z 153) с близкими значениями времени удерживания (20,52 и 21,06 мин). По-видимому, эти сигналы соответствуют двум продуктам элиминирования HI от тиазина 11, представляющим собой изомеры с различным положением двойной связи в тиазиновом кольце. Кроме того, на хроматограмме имеется также пик исходного аллила 1Ь, свидетельствующий о разложении соединения 11 вследствие высоких температур (более 200 °C) в инжекторе.
N37S2O3,
Nt^COg
Ni^^Og,
Na2CO3
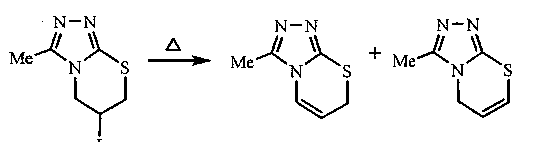
Дегидрогалогенирование продуктов иодциклизации соединения 1Ь
Следует отметить, что в отличие от аллилсульфидов la, Ь и 2 взаимодействие с иодом 5-тире/и-бутил-З-аллилтио-1,2,4-триазола (1с) протекает региоселективно и сопровождается замыканием циклов исключительно по атому азота N-2, что обусловлено, по-видимому, стерическими затруднениями, связанными с присутствием трети-бутильной группы в триазольном кольце.
В спектрах ЯМР ]Н полученных нами продуктов иодциклизации отсутствуют сигналы протонов аллильной группы, имеющиеся в спектрах исходных соединений la c и 2. Подтверждением факта замыкания насыщенных шестичленных и пятичленных циклов является наличие в спектрах определенных наборов сигналов, характерных для данных спиновых систем. Так, кроме сигналов протонов заместителей в триазольном кольце, в спектрах имеется еще три группы сигналов: мультиплеты в слабом поле протонов Н-6, однопротонные дублеты дублетов протонов МСН2-группы (в тиазинах За, b, 6Ь, с и 7) и сигналы протонов группы -СН21 (в тиазолах 4а-с, 5 и 8) и группы -SCH2 (в тиазинах За, b, 6Ь, с и 7). Один из наборов аналогичен сигналам в спектре ЯМР *Н близких по структуре тиазолотриазолов [7, 8], поэтому отнесен к соединению 5. Соединения За, b, 4а-с, 6Ь, с, 7 и 8 идентифицированы на основании анализа и соотнесения данных ЯМР ’н со спектральными данными в работах [6, 8]. Следует отметить, что протоны группы -SCH2 в тиазолотриазолах 4а-с и 8 в отличие от 8СН2-протонов в тиазиниевых системах расщепляются на два дублета дублетов, один из которых располагается в области 3,90-4,00 м.д., а другой - в более слабом поле (4,30-4,50 м.д.). Кроме того, мультиплеты протонов Н-6 тиазинового кольца в соединениях 6Ь, с находятся в более слабом поле, чем аналогичные протоны в продуктах циклизации по атому азота N-4 За, Ь и 7.
Органическая химия
Заключение
Установлено, что 3-аллилтио-1,2,4-триазол, 5-метил-3-аллилтио-1,2,4-триазол, 5-лтрет-бутил-3-аллилтио-1,2,4-триазол и 1-ацетил-5-метил-3-аллилтио-1,2,4-триазол взаимодействуют с иодом с образованием смеси, как правило, двух продуктов иодциклизации - производных [ 1,2,4]триазоло[3,4-6] [ 1,3]тиазиния, [ 1,3]тиазоло[3.2-6] [ 1,2,4]триазолия, [ 1,3]тиазоло[2,3-с][ 1,2,4]триазолия и/или [1,2,4]триазоло[5,1-6][1,3]тиазиния. В реакции иодирования 5-метил-З-аллилтио-1,2,4-триазола один из продуктов - трииодид 6-иодметил-3-метил-5,6-дигидро[1,3]тиазоло[2,3-с] [1,2,4]триазолия - является неожиданным; его образование обусловлено механизмом реакции. Продукты иодциклизации в растворах могут претерпевать дигидротиазин-тиазолиновую перегруппировку, в результате чего их соотношение меняется.
Найдено, что взаимодействие с иодом 5-щрет-бутил-3-аллилтио-1,2,4-триазола протекает ре-гиоселективно (по атому азота N-2) вследствие стерических затруднений.
Список литературы Исследование иодциклизации S-аллильных производных 3-меркапто-1,2,4-триазолов
- Машковский, М.Д. Лекарственные средства/М.Д. Машковский. -Харьков: Торсинг, 1998. -Т. 1.-С. 24-78.
- Пат. 07 175157 (1995). Япония//С.А. 1996.-Vol. 124.-Р 71450т.
- Пат. 09 25587 (1997). Япония//С.А. 1997. -Vol. 126. -Р 228400m.
- Колодина, А.А. Внутримолекулярная циклизация S-алкилпроизводных 4-амино-З-меркапто-1,2,4-триазолов как метод аннелирования тиадиазинового и тиадиазольного циклов/А.А. Колодина, А.В. Лесин//Журнал органической химии. -2009. -Т. 45. -Вып. 1. -С. 142-146.
- Мякушкене, Г. Синтез 4-амино-5-(4,6-дифенил-2-пиримидинил)-3,4-дигидро-2H-1,2,4-триазол-3-тиона и его взаимодействие с С-электрофилами/Г. Мякушкене, П. Вайнилавичюс//Химия гетероциклических соединений. -2007. -№ 7. -С. 1088-1094.
- Шмыгарев, В.И. Неожиданное направление иодциклизации 3-аллилтио-5-фенил-4H-1,2,4-триазола/В.И. Шмыгарев, Д.Г. Ким//Химия гетероциклических соединений. -2004. -№ 9. -С. 1391-1395.
- Мякушкене, Г. Синтез 6-[4-(аллил/фенил)-5-тиоксо-1,2,4-триазол-3-ил]пиримидин-2,4-дионов и их взаимодействие с С-электрофилами/Г. Мякушкене, П. Вайнилавичюс//Химия гетероциклических соединений. -2006. -№ 6. -С. 906-912.
- Шмыгарев, В.И. Изучение продуктов иодциклизации 4-аллил-5-фенил-1,2,4-триазол-З-тиона/В.И. Шмыгарев, Д.Г. Ким//Химия гетероциклических соединений. -2004. -№ 8. -С.1241-1245.
- Химия органических соединений серы. Общие вопросы/под ред. Л.И. Беленького. -М.: Химия, 1988.-С. 227-229.


