Исследование эффектов солей лития в присутствии этанола на продукт окислительного повреждения ДНК плазмы крови здоровых лиц и больных алкоголизмом
Автор: Прокопьева В.Д., Ярыгина Е.Г., Плотников Е.В., Ветлугина Т.П.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 1 (102), 2019 года.
Бесплатный доступ
Исследованы эффекты аскорбата лития и сукцината лития на уровень маркера окислительного повреждения ДНК - 8-гидрокси-2’-дезоксигуанозин (8-OH-dG) - в плазме крови здоровых лиц и больных алкоголизмом в присутствии 0,5%-ного этанола in vitro. Измерение 8-OH-dG проводили иммуноферментным методом. Обнаружено увеличение концентрации 8-OH-dG в плазме крови больных алкоголизмом по сравнению со здоровыми лицами. Этанол в используемой концентрации, как и соли лития на его фоне, заметного влияния на уровень 8-OH-dG плазмы крови не оказывал как у здоровых лиц, так и у больных алкоголизмом. Сделано заключение о том, что в отличие от белков и липидов плазмы крови ДНК оказывается устойчивой к повреждающему воздействию этанола в используемых экспериментальных условиях. Соли лития также не оказывают эффекта на 8-OH-dG плазмы крови.
8-гидрокси-2'-дезоксигуанозин (8-oh-dg), плазма крови, этанол, аскорбат лития, сукцинат лития, алкоголизм
Короткий адрес: https://sciup.org/142220027
IDR: 142220027 | УДК: 616.89-008.441.13:612.118:616-092.4 | DOI: 10.26617/1810-3111-2019-1(102)-5-11
Текст научной статьи Исследование эффектов солей лития в присутствии этанола на продукт окислительного повреждения ДНК плазмы крови здоровых лиц и больных алкоголизмом
У больных алкоголизмом часто выявляется окислительный стресс (ОС) [1, 2, 3], который можно идентифицировать по повышенному содержанию в плазме (или сыворотке) крови продуктов окислительной модификации белков (карбонилов белков) и липидов (продуктов ПОЛ) [2, 3]. В ряде работ в плазме крови больных алкоголизмом выявлено увеличение продукта окислительной модификации ДНК – 8-гидрокси-2’-дезоксигуанозина (8-OH-dG) [4, 5, 6]. Обнаружена корреляция повышенного уровня 8-OH-dG в плазме крови с тяжестью алкогольного абстинентного синдрома [6]. Повышение в крови 8-OH-dG связано с формированием и развитием ОС и происходит при различных патологиях [7, 8]. Это обусловлено, главным образом, поступлением продуктов окислительного повреждения ДНК в кровь в результате гибели клеток в тканях организма вследствие апоптоза и/или некроза, а также при гибели клеток крови, вирусов и бактерий на фоне сформировавшегося ОС [9, 10]. При алко- гольной зависимости этанол и его метаболиты являются факторами, способствующими развитию и поддержанию на высоком уровне состояния окислительного стресса в организме больного [2, 3], а инкубация крови здоровых лиц в присутствии этанола или его метаболита ацетальдегида in vitro увеличивает содержание окисленных белков и липидов в плазме крови [11]. Исследований влияния этанола in vitro на уровень 8-OH-dG плазмы крови до настоящего времени не проводилось.
Важной задачей является поиск веществ, способных снижать уровень окисленных биомолекул у пациентов. К таким веществам в первую очередь относятся антиоксиданты. Перспективными препаратами при лечении больных алкоголизмом с выраженными расстройствами аффективного спектра могут быть лекарственные средства на основе солей лития, содержащие в своем составе анионный компонент с антиоксидантной активностью.
Ранее мы показали, что при защите белков и липидов плазмы крови здоровых лиц от ток- сического действия этанола определенным протекторным потенциалом обладают аскорбат лития [12, 13], а также карбонат лития и сукцинат лития [13].
ЦЕЛЬ ИССЛЕДОВАНИЯ
В данной работе проведено изучение действия аскорбата и сукцината лития in vitro на уровень маркера окислительного повреждения ДНК – 8-OH-dG – в плазме крови здоровых лиц и больных алкоголизмом при инкубации крови с 0,5%-ным этанолом.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования являлась кровь 21 больного алкоголизмом, находящихся в состоянии абстиненции (основная группа), и 15 практически здоровых человек (контрольная группа). Средний возраст участников исследования составил 43,55±1,95 года. Больные поступили на лечение в наркологическое отделение НИИ психического здоровья Томского НИМЦ. Диагноз больных по МКБ-10 квалифицировался как «Психические и поведенческие расстройства в результате употребления алкоголя (синдром зависимости – F10.21 и синдром отмены – F10.30)». Участниками контрольной группы были здоровые лица, не состоящие на учете у психиатра или нарколога, не имеющие хронических соматических заболеваний в стадии обострения и не употребляющие алкоголь, по крайней мере, последние 10 суток перед исследованием.
Кровь для исследования брали из локтевой вены утром натощак с использованием стерильной системы однократного применения Vacutainer («Becton Dickinson», USA) с антикоагулянтом Sodium Hepаrin. Использовали аскорбат лития и сукцинат лития, синтезированные для данного исследования на кафедре физической и аналитической химии Томского политехнического университета [14, 15, 16]. Этанол и соединения лития растворяли в физиологическом растворе (натрия хлорид 0,9%, ОАО
Научно-производственный концерн «ЭСКОМ», Россия). Эффекты исследуемых соединений на уровень 8-OH-dG в плазме крови оценивали после инкубации крови с этанолом in vitro в присутствии аскорбата лития или сукцината лития. В контрольные пробы добавляли физиологический раствор (контроль без этанола) или физиологический раствор и этанол (контроль с этанолом). Конечная концентрация этанола в пробах составляла 0,5%, соединений лития – 1,2 ммоль/л в пересчете на ионы лития. Данная концентрация соединений лития соответствует терапевтической концентрации лития в крови пациентов при терапии аффективных расстройств и алкогольной зависимости с аффективными нарушениями. После инкубации в течение 1 часа при 37°С все пробы центрифугировали в течение 10 минут (3000 об/мин.). Полученную плазму замораживали и хранили при температуре -80°С до измерения в ней 8-OH-dG иммуноферментным методом по протоколу с использованием набора DNA Damage Competitive Elisa Kit (Thermo Fisher Scientific, USA). Измерение оптической плотности проб и расчет концентрации 8-OH-dG осуществляли на приборе Epoch (BioTek, USA).
Статистическую обработку результатов проводили с помощью программы «Statistica-12». Для проверки согласия с нормальным законом распределения количественных показателей использовали критерий Шапиро–Уилка. Данные представляли в виде среднего значения и ошибки среднего (М±m). Для оценки достоверности различий в группах использовали параметрический критерий Стьюдента (Student, Т-test). Статистически значимыми различия считали при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты проведенных экспериментальных исследований представлены в таблице и на рисунках 1 и 2.
Таблица
Влияние солей лития (1,2 мМ) в присутствии этанола (0,5%) на концентрацию 8-гидрокси-2-дезоксигуанозина (8-OH-OG, нг/мл) плазмы крови здоровых лиц и больных алкоголизмом, М±т
|
Группа |
Контроль без этанола |
Контроль с этанолом |
Этанол + Li-аскорбат |
Этанол + Li-сукцинат |
|
Здоровые (n=15) |
11,11±1,32 |
10,41±0,80 +р=0,653 |
11,28±0,89 |
10,58±0,69 |
|
Больные алкоголизмом (n=21) |
12,91±0,58 *p=0,178 |
12,97±0,64 *p=0,011 +р=0,948 |
13,78±1,00 *p=0,083 |
13,96±0,95 * p=0,017 |
П р и м е ч а н и е. *p – Уровень достоверности различий между показателями здоровых лиц и больных алкоголизмом; + р – уровень достоверности различий между показателями в контроле без этанола и с этанолом в соответствующих группах доноров.
У больных алкоголизмом концентрация продуктов окислительной модификации ДНК в плазме крови по сравнению со здоровыми лицами оказалась повышенной. Между контрольными пробами без этанола была выявлена тенденция к повышению этого показателя у больных алкоголизмом относительно здоро-
Здоровые доноры
Больные алкоголизмом
Q К (контроль) @ Э (этанол)
□ Mean aMean±SE rMean±0,95 Conf. Interval
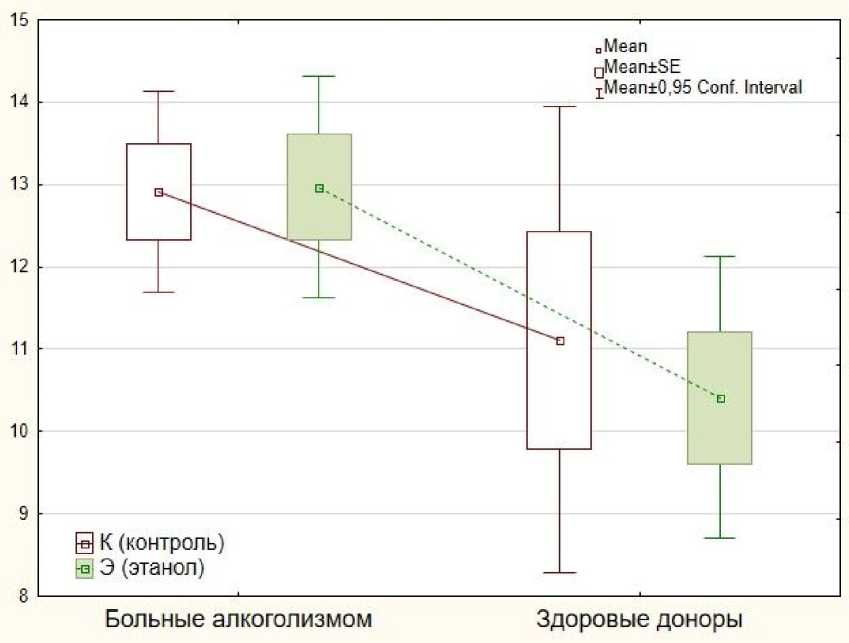
Рисунок 1. Концентрация продуктов окислительной модификации ДНК - 8-гидрокси-2’-дезоксигуанозина (8-OH-dG) в контроле с этанолом и без этанола в плазме крови в основной группе (больных алкоголизмом) и контрольной группе (здоровых доноров), нг/мл
Показано, что уровень значимости различий между контролем без этанола и контролем с этанолом в группе здоровых лиц составил р=0,653, а в группе больных алкоголизмом – р=0,948. То есть статистически значимых различий в уровне 8-OH-dG плазмы крови между пробами с этанолом и без него как у здоровых доноров, так и у больных алкоголизмом не обнаружено. Таким образом, этанол в концентрации 0,5% при инкубации в течение 1 часа при температуре 37°С in vitro заметного влияния на уровень 8-ОН-dG плазмы крови не оказывает (табл., рис. 1).
Соли лития (аскорбат лития и сукцинат лития) статистически значимого эффекта на уровень 8-OH-dG плазмы крови не показали как в группе здоровых лиц, так и в группе больных вых лиц с уровнем значимости р=0,178. Сравнение контрольных проб с этанолом между группами больных и здоровых лиц показало статистически достоверную разницу между обеими группами с уровнем значимости р=0,011 (табл., рис. 1).
алкогольной зависимостью. Уровень значимости различий между контролем и пробами с аскорбатом лития у здоровых составил р=0,922, а у больных алкоголизмом – р=0,426. Между контролем и пробами с сукцинатом лития уровень значимости различий был равен р=0,724 в группе здоровых лиц и р=0,351 в группе больных алкогольной зависимостью.
Повышенный уровень 8-OH-dG плазмы крови в группе пациентов по сравнению с группой здоровых лиц сохраняется в присутствии аскорбата лития на уровне тенденции (р=0,083). В присутствии сукцината лития различия между концентрацией 8-OH-dG в основной группе и контрольной группе были достоверны, уровень значимости различий составил р=0,017 (табл., рис. 2).
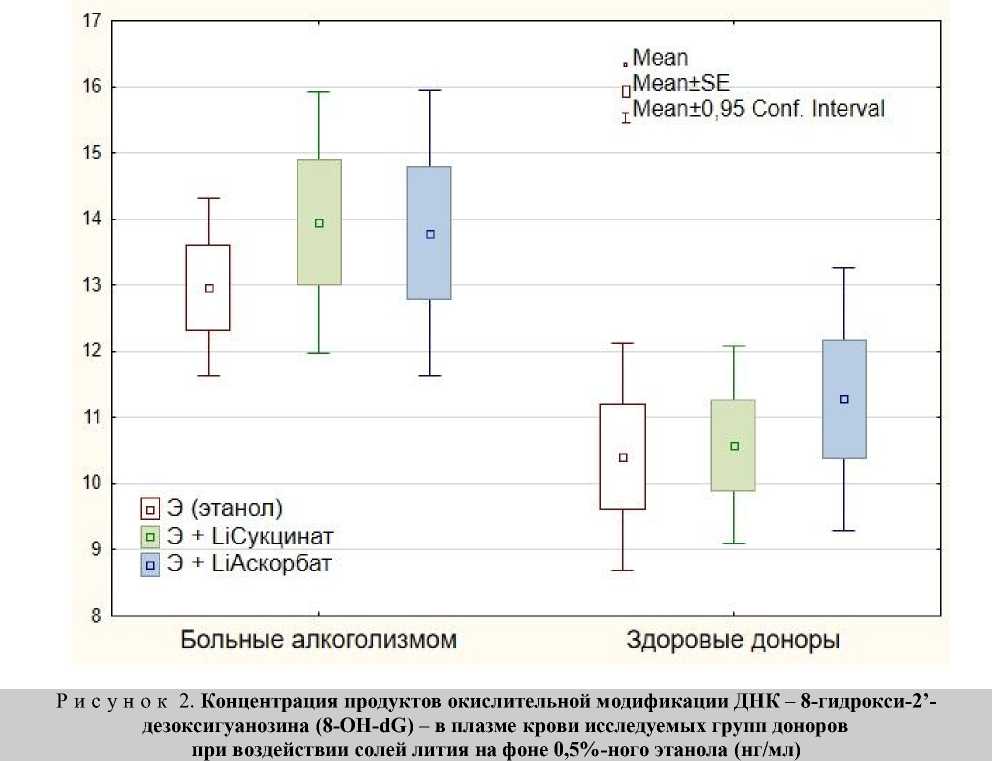
Таким образом, мы обнаружили увеличение продуктов окислительной модификации ДНК – 8-гидрокси-2’-дезоксигуанозина (8-OH-dG) в плазме крови у больных алкогольной зависимостью, что согласуется с данными литературы [4, 5, 6]. Инкубация крови как больных алкоголизмом, так и здоровых лиц с 0,5%-ным этанолом in vitro в течение 1 часа при 37°С не приводит к изменению 8-OH-dG в плазме крови. Ранее было показано, что в таких условиях этанол приводит к окислительному повреждению белков и липидов плазмы крови у здоровых лиц [2, 11, 12], но не у больных алкоголизмом [12]. Вероятно, для увеличения продуктов окислительного повреждения ДНК в плазме при инкубации крови с этанолом in vitro требуются другие условия инкубации, в частности такие как более длительное время воздействия, другая концентрация этанола и др.
ЗАКЛЮЧЕНИЕ
Проведенные экспериментальные исследования позволяют сделать вывод, что в плазме крови больных алкоголизмом концентрация 8-OH-dG увеличена по сравнению со здоровыми лицами. В отличие от белков и липидов плазмы крови ДНК в используемых экспериментальных условиях оказывается устойчивой к повреждающему воздействию этанола. Концентрация продукта окислительной модификации ДНК – 8-OH-dG – в плазме крови больных алкогольной зависимостью и здоровых лиц достоверно не изменяется как после инкубации крови с этанолом, так и в пробах с добавлением солей лития.
Список литературы Исследование эффектов солей лития в присутствии этанола на продукт окислительного повреждения ДНК плазмы крови здоровых лиц и больных алкоголизмом
- Parthasarathy R., Kattimani S., Sridhar M.G. Oxidative stress during alcohol withdrawal and its relationship with withdrawal severity. Indian J. Psychol. Med. 2015; 37 (2): 175-80 DOI: 10.4103/0253-7176.155617
- Бохан Н.А., Прокопьева В.Д., Иванова С.А., Ветлугина Т.П., Епимахова Е.В., Плотников Е.В., Ярыгина Е.Г., Бойко А.С. Окислительный стресс и его коррекция у больных алкогольной зависимостью (итоги исследований в НИИ психического здоровья Томского НИМЦ). Вопросы наркологии. 2018; 3 (163): 27-59.
- Prokopieva V.D., Yarygina E.G., Bokhan N.A., Ivanova S.A. Use of Carnosine for Oxidative Stress Reduction in Different Pathologies. Oxidative Medicine and Cellular Longevity. 2016. Article ID 2939087, 8 pages DOI: 10.1155/2016/2939087
- Kruman I.I., Henderson G.I., Bergeson S.E. DNA damage and neurotoxicity of chronic alcohol abuse. Exp. Biol. Med. 2012; 237 (7): 740-747 DOI: 10.1258/ebm.2012.011421
- Mutul-Turkoglu U., Dogru-Abbasoglu S., Aykac-Toker G., Mirsal H., Beyazyurek M., Uysal M. Increased lipid and protein oxidation and DNA damage in patients with chronic alcoholism. Lab. Clin. Med. 2000; 136 (4): 287-291.
- Chen C.H., Pan C.H., Chen C.C., Huang M.C. Increase oxidative DNA damage in patients with alcohol dependence and its correlation with alcohol withdrawal severity. Alcohol Clin. Exp. Res. 2011; 35 (2): 338-44
- DOI: 10.1111/j.1530-0277.2010.01349
- Di Minno A., Turnu L., Porro B., Squellerio I., Cavalca V., Tremoli E., Di Minno M.N.D. 8-Hydroxy-2-Deoxyguanosine Levels and Cardiovascular Disease: A Systematic Review and Meta-Analysis of the Literature. Antioxid Redox Signal. 2016; 24 (10): 548-555
- DOI: 10.1089/ars.2015.6508
- Kasai H. Analysis of a form of oxidative DNA damage, 8-hydroxy-2'-deoxyguanosine, as a marker of cellular oxidative stress during carcinogenesis. Mutat. Res. 1997; 387: 147-163.
- Vasil’eva I.N., Podgornaya O.I., Bespalov V.G. Nucleosomal fraction of extracellular DNA as a marker of apoptosis. Tsitologiya. 2015; 57: 87-94.
- Черников А.В., Гудков С.В., Усачева А.М., Брусков В.И. Экзогенный 8-оксо-7,8-дигидро-2'-дезоксигуанозин: биомедицинские свойства, механизмы действия, терапевтический потенциал. Успехи биологической химии. 2017; 57: 267302
- DOI: 10.1134/S0006297917130089
- Ярыгина Е.Г., Прокопьева В.Д. Защита белков и липидов плазмы крови от повреждения, индуцированного этанолом и ацетальдегидом. Сибирский вестник психиатрии и наркологии. 2015; 3: 5-8.
- Plotnikov E., Prokopieva V., Yarygina E., Losenkov I. Lithium ascorbate as a protector of human blood biomolecules under ethanol impact. National Journal of Physiology, Pharmacy and Pharmacology. 2018; 8 (1): 82-86
- DOI: 10.5455/njppp.2018.8.0935812102017
- Прокопьева В.Д., Плотников Е.В., Ярыгина Е.Г., Бохан Н.А. Протекторное действие карнозина и органических солей лития при этанолиндуцированном окислительном повреждении белков и липидов плазмы крови у здоровых лиц и больных алкоголизмом. Биомедицинская химия. 2019; 65 (1): 28-32.
- Plotnikov E., Korotkova E., Voronova O., Dorozhko E., Bohan N., Plotnikov S. Lithium-based antioxidants: electrochemical properties and influence on immune cells. Physiology and Pharmacology. 2015; 19: 107-113.
- Plotnikov E., Korotkova E., Voronova O. Lithium salts of Krebs cycle substrates as potential normo-thymic antioxidant agents. Journal of Pharmacy and Bioallied Sciences. 2018; 10: 240-245.
- Plotnikov E., Voronova O., Martemianov D., Korotkova E., Dorozhko E., Astashkina A., Martemianova I., Linert W., Ivanova S., Bokhan N. Antioxidant and immunotropic properties of some lithium salts. Journal of Applied Pharmaceutical Science. 2016; 6 (1): 086-089.


