Исследование экспериментальной модели послеоперационного рубцово-спаечного эпидурита
Автор: Эрдынеев Константин Цыренович, Ларионов Сергей Николаевич, Лепехова Светлана Александровна, Гольдберг Олег Аронович, Сороковиков Владимир Алексеевич
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Статья в выпуске: 12, 2013 года.
Бесплатный доступ
Развитие послеоперационного рубцово-спаечного эпидурита после поясничных дискэктомий является наиболее распространенной и в тоже время спорной проблемой, этиология и патогенез которого до сих пор вызывает множество дискуссий, а подбор оптимальных методов лечения и профилактики продолжается до настоящего времени. В своей работе мы описываем новую экспериментальную модель, где элементы аутологичного межпозвонкового диска играют роль триггера воспалительного, а затем и спаечного процесса приводящего к развитию послеоперационного рубцово-спаечного эпидурита.
Экспериментальная модель, послеоперационный рубцово-спаечный эпидурит, ламинэк-томия
Короткий адрес: https://sciup.org/148181636
IDR: 148181636 | УДК: 616.721.1-007.43-089.168.1-06
Текст научной статьи Исследование экспериментальной модели послеоперационного рубцово-спаечного эпидурита
В настоящее время остеохондроз позвоночника является распространенным заболеванием, исходом которого зачастую является формирование грыжи межпозвонкового диска и компрессия корешка в сочетании с выраженным болевым синдромом и неврологическим дефицитом. Хирургическое удаление грыж межпозвонковых дисков является основным методом лечения этих больных [1, 4, 5, 12]. Вместе с тем количество рецидивов болевого корешкового синдрома не сокращается и достигает порой половины оперированных случаев [10]. Анализ этой категории пациентов показал, что наиболее частыми морфологическим причинами неудовлетворительных исходов лечения являются рецидив грыжи оперированного диска или развитие послеоперационного рубцово-спаечного эпидурита (ПРСЭ) [13, 14, 15]. Таким образом, изучение процессов формирования и развития, послеоперационного рубцово-спаечного эпиду-рита является актуальным вопросом современной нейрохирургии, необходимым для дальнейшей разработки методов лечения и профилактики дегенеративных заболеваний позвоночника.
Нами на базе научного отдела экспериментальной хирургии НЦРВХ СО РАМН была разработана модель послеоперационного рубцовоспаечного эпидурита в поясничном отделе по- звоночника. Целью было оценить гистопатологическую картину предложенной экспериментальной модели послеоперационного рубцовоспаечного эпидурита.
Материалы и методы. Все исследования проведены на крысах-самцах линии Wistar в возрасте 5-6 месяцев, массой 250 ± 30 г. У экспериментальных животных выполняли ламинэктомию на уровне LVI – SI [3, 16], после чего животные были распределены на следующие группы: в контрольной группе животным (n=12) проводилась только экспериментальная ламинэктомия (ЛЭ); в опытной группе (n=12) воспроизводилась экспериментальная модель рубцово-спаечного эпидурита, посредством ламинэктомии на уровне LVI – SI, после чего для стимуляции воспалительного, а затем спаечного процесса в эпидуральное пространство погружали элементы аутологичного межпозвонкового диска (ЛЭ+МПД). На 30-е сутки эксперимента у животных всех групп под эфирным наркозом выполняли декапитацию и вычленяли органокомплекс с анатомической препаровкой позвоночника. Материал для микроскопического исследования фиксировали в 10% формалине и заливали в парафин по общепринятой методике. Процесс рубцово-спаечного эпидурита изучали методом световой микроскопии; окраска ге-матоксилин-эозином по Ван-Гизону, увеличе- ние на 40, 100, 200, 400. Оценка эпидурального фиброза была основана на шкале He (1995) [20].
Результаты и их обсуждение. Исследование гистологических препаратов позвоночного столба поясничного отдела крыс при световой микроскопии выявило следующие изменения в области оперативного вмешательства. Как видно из таблицы, в контрольной группе лишь у части животных обнаружено наличие рубцовоспаечного процесса в эпидуральном пространстве после выполненной ламинэктомии.
Таблица 1
Результаты степени рубцово-спаечного эпидурита в контрольной и опытной группе на 30-е сутки эксперимента
|
Группа |
Степень 0 |
Степень 1 |
Степень 2 |
Степень 3 |
|
Контрольная (ЛЭ) |
0 |
8 (67%) |
4 (33%) |
0 |
|
Опытная (ЛЭ+МПД) |
0 |
1 (8%) |
4 (33%) |
7 (50%)* |
При оценке по шкале He у 67% животных из контрольной группы отмечается эпидуральный фиброз 1 степени (рис. 1), который проявляется в наличии тонкой полоски фиброзной ткани между рубцом и твердой мозговой оболочкой; в просвете позвоночного канала визуализируются свободно лежащие нервные волокна конского хвоста, форма дурального мешка правильная; имеются кровеносные сосуды и костные остатки позвоночной дуги.
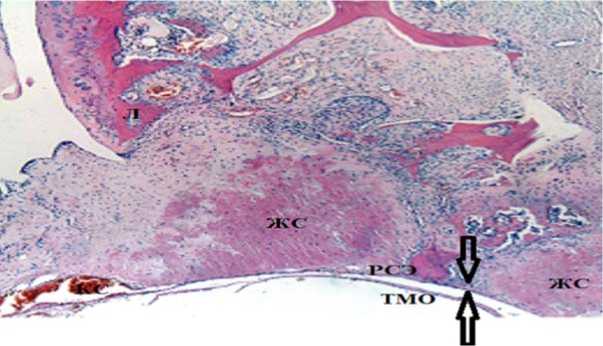
Рис. 1. Степень 1 эпидурального фиброза, 30 сут. эксперимента, световая микроскопия: РСЭ – рубцово-спаечный эпидурит, ТМО – твердая мозговая оболочка, ЖС – желтая связка, Л – ламина, НВ – нервные волокна. Окраска гематоксилином и эозином. Ув. × 40.
Умеренно выраженный спаечный процесс (степень 2) зафиксирован у 4 животных контрольной группы (рис. 2). Следует отметить, что ни у одного животного контрольной группы не наблюдалась эпидурального фиброза 3 степени.
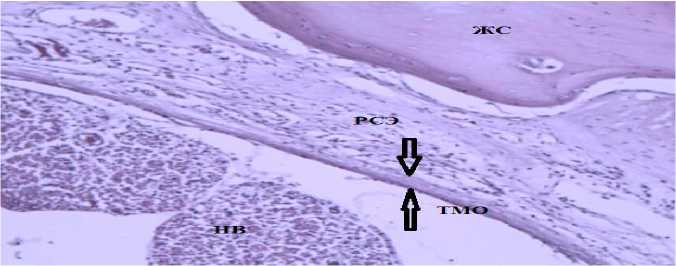
Рис. 2. Степень 2 эпидурального фиброза, 30 сут. эксперимента, световая микроскопия.
Окраска гематоксилином и эозином. Ув. × 40.
В опытной группе превалировали грубые рубцово-спаечные изменения, патоморфологи-ческая картина у 11 животных соответствовала 2 и 3 степени. Причем у 59% животных, у которых в качестве триггера ЭФ были использованы элементы аутологичного межпозвонкового диска, рубцовая фиброзная ткань распространяется на протяжении 2/3 и более от костного дефекта (рис. 3). В просвете позвоночного канала четко визуализируются спаянные нервные волокна конского хвоста с твердой мозговой оболочкой; отмечается деформация дурального мешка с грубыми спаечными процессами, эпидуральное пространство облитерировано; дефект позвоночного канала заполнен большим количеством новообразованной соединительной ткани, который по бокам ограничен фрагментами перестраивающийся желтой связки, все это указывает на развитие и сохранение грубых явлений рубцово-спаечного эпидурита.
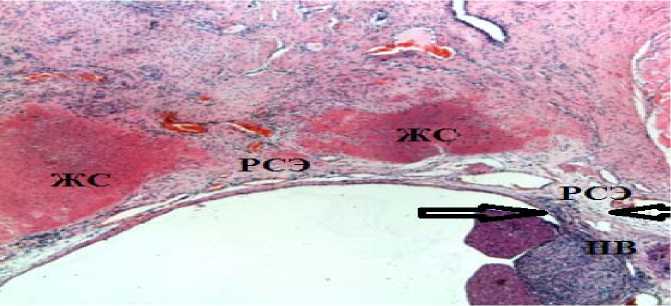
Рис. 3. Степень 3 эпидурального фиброза, 30 сут. эксперимента, световая микроскопия.
Окраска гематоксилином и эозином. Ув. × 40.
Известно, что в ответ на операционную травму всегда образуется рубцовая ткань как физиологическая реакция на любое хирургическое вмешательство. Однако интенсивность и продолжительность этого процесса может быть различной и зависит от многих факторов. До си пор причины развития ПРСЭ вызывают множество дискуссий. По мнению LaRocca ведущую роль в формировании рубцовой ткани и эпидурального фиброза занимает образование гематомы в полости позвоночного канала, которая замещает эпидуральную клетчатку и со временем приводит к развитию асептического воспалительного процесса. Кроме того, из поврежденных параспинальных мышц происходит миграция фибробластов [21], что приводит к усиленному синтезу коллагена в результате чего изменяется соотношение клеток и волокнистых структур, превращение рыхлой соединительной в плотную фиброзную ткань. Также, по мнению ряда исследователей, немаловажную роль играет наследственный фактор, связанный с гипе-рергическим характером реакции фибробластов в ответ на операционную травму [2, 6, 8].
Кроме того, известно, что аутоаллергизация тканью дегенерировано-измененного пульпоз-ного ядра может поддерживать состояние хронического воспаления в нервных корешках, оболочках спинного мозга, эпидуральной клет- чатке и вызывать в них реактивные изменения, которые приводят к развитию рубцовоспаечного процесса [18]. Ткань диска является бессосудистым образованием, она формируется изолированно от иммуннокомпетентной системы организма и обладает антигенными свойствами. В результате разрушения межпозвонкового хряща запускается каскадный механизм клеточного иммунитета, который вызывает образование противодисковых антител. Комплексы антиген-антитело стимулируют синтез провос-палительных веществ (цитокины, простоглан-дин Е и др.) и протеолитических ферментов (протеазы, коллагеназы), что вызывает прогрессирующую дегенерацию межпозвонкового диска и других структур позвоночно-двигательного сегмента [9, 11].
Высокий интерес исследователей к данной теме обусловлен тем, что именно развитие выраженного ПРСЭ является одной из причин компрессии, фиксации нейрососудистых структур и стеноза позвоночного канала, что приводит к рецидиву болевого синдрома и неврологической симптоматики у пациентов, перенесших оперативное вмешательство на поясничном отделе позвоночника. Эпидуральный фиброз является одной из причин возникновения так называемого «синдрома оперированного позвоночника» (failed back surgery syndrome) [19, 22, 23]. Так, по данным различных авторов, послеоперационный рубцово-спаечный эпидурит является причиной до 25% реопераций [7], а в сочетании с рецидивом грыжи диска и стенозом позвоночного канала ПРСЭ встречается более чем у 60% оперированных больных [17].
Таким образом, механизмы развития ПРСЭ до конца неясны. Остается открытым вопрос, почему у одних пациентов после операции при одинаковых условиях развивается выраженный ПРСЭ с соответствующей симптоматикой, а у других он минимален. В отечественной нейрохирургии работы по изучению встречаются нечасто, поэтому клинический и экспериментальный опыт незначительный и требует дальнейших исследований.
На основании вышеизложенных результатов разработанной нами модели ПРСЭ можно констатировать, что на 30-е сут. развиваются гистологические признаки послеоперационного рубцово-спаечного эпидурита, которые включают в себя облитерацию эпидурального пространства, спаечный процесс твердой мозговой оболочки и нервных корешков, перестройку желтой связки, склерозирование кости, избыточное появление фиброзной ткани вокруг гомогенизата аутологичного межпозвонкового диска, заполняющей послеоперационный дефект.
Предлагаемый способ моделирования послеоперационного рубцово-спаечного эпидури-та может широко применяться в экспериментальной медицине для изучения патогенеза рубцово-спаечного эпидурита и разработки способов лечения и профилактики этого заболевания у человека.


