Исследование эмбриотоксического действия наночастиц диоксида титана на крыс
Автор: Шарафутдинова Люция Ахтямовна, Хисматуллина Зухра Рашидовна, Даминов Марсель Раилевич, Валиуллин Виктор Владимирович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Морфомика - новые технологии
Статья в выпуске: 3 т.25, 2017 года.
Бесплатный доступ
Широкое использование наноматериалов в различных отраслях деятельности человека приводит к возникновению ряда проблем. Хорошо известно, что некоторые наноматериалы могут обладать эмбриотоксическим эффектом, оказывая прямое воздействие на плод после проникновения через плацентарный барьер. Цель настоящего исследования - оценить на основе изучения предимплантационной и постимлантационной смертности и особенностей постнатального развития эмбриотоксические свойства нанодисперсного диоксида титана (TO2) при пероральном введении. Показано, что пероральное введение нанодисперсного диоксида титана в дозе 50 мг/кг беременным самкам крыс с 1-го по 19-й день беременности оказывает выраженное эмбриотоксическое действие, выраженное в повышении предимплантационной, постимплантационной и общей эмбриональной смертности плодов. Изучены отдаленные эффекты антенатального воздействия нанодисперсного диоксида титана на развитие потомства крыс в раннем постанатальном периоде онтогенеза, в первые 30 дней жизни...
Наночастицы, диоксид титана, эмбриотоксичность, крыса
Короткий адрес: https://sciup.org/143177197
IDR: 143177197 | DOI: 10.20340/mv-mn.17(25).03.37-42
Текст научной статьи Исследование эмбриотоксического действия наночастиц диоксида титана на крыс
Шарафутдинова Л.А., Хисматуллина З.Р., Даминов М.Р., Валиуллин В.В. Исследование эмбриотоксического действия наночастиц диоксида титана на крыс// Морфологические ведомости.- 2017.- Том 25.- № 3.- С. 37-42. (25).03.37-42 For the citation:
Sharafutdinova LA, Khismatullina ZR, Daminov MR, Valiullin VV. The study of embryotoxic effect of titanium dioxide nanoparticles on rats. Morfologicheskie Vedomosti – Morphological Newsletter. 2017 Sep 30;25(3):37-42. (25).03.37-42
Введение . Динамичное развитие нанотехнологий привело к широкому производству и применению материалов, содержащих наноразмерные частицы (далее - НЧ ) . Интерес к использованию наночастиц в различных отраслях промышленности растет с каждым годом в связи с тем, что в наноразмерном состоянии (<100 нм) некоторые вещества приобретают новые химические, физические и(или) биологические свойства, что может оказаться полезным для их использования в самых разнообразных целях. Наноматериалы используются для адресной доставки лекарственных препаратов, в генной и молекулярной инженерии, в парфюмерно-косметической, пищевой и других областях промышленности [1-4]. Активное производство и использование наноматериалов для решения различных задач обуславливает интерес к их потенциальной биологической активности.
Среди наноматериалов на сегодняшний день в наиболее крупных масштабах вырабатываются и используются наночастицы диоксида титана (далее - TiO2). Так, например, производство нанодисперсного TiO2 составляет 70% от общего объема производства пигментов во всем мире [5]. Ежегодно во всем мире потребляется около 4 млн. тонн TiO2, который входит в пять топ-наноматериалов, используемых в потребительских товарах. Диоксид титана применяется в качестве отбеливающего агента в потребительских товарах и продуктах питания в связи с его яркостью, стойкостью к изменению цвета и высоким показателем преломления. TiO2 используется для производства красок, бумаги, пластмасс, чернил, лекарственных препаратов, пищевых продуктов (пищевая добавка E171), косметики, зубных паст, солнцезащитных кремов и т.д. [6-7]. К пищевым продуктам с высоким содержанием TiO2 относятся жевательные резинки и леденцы [8]. По данным трансмиссионной электронной микроскопии около 36% частиц в составе Е171 имеют размер меньше, чем 100 нм [9]. В области наномедицины использование НЧ TiO2 обсуждается как полезный инструмент для визуализации нанотерапевтических средств [10] и рассматривается как потенциальный фотосенсибилизатор в фотодинамической терапии у онкологических больных.
Массовое использование наночастиц TiO 2 в промышленности объясняется их более высокой каталитической активностью по сравнению с микрочастицами TiO 2 , поскольку при уменьшении размеров частиц их удельная поверхность увеличивается. Традиционно, НЧ TiO 2 рассматривались как плохо растворимые, химически инертные частицы низкой токсичности [11]. По этой причине они использовались в качестве отрицательного контроля сравнения в токсикологических исследованиях [12]. Однако эта точка зрения была подвергнута сомнению после обнаружения опухоли легких у крыс на фоне воздействия высоких концентраций наночастиц TiO 2 [13]. Быстрый рост числа публикаций о токсическом воздействии наночастиц TiO 2 подтверждает, тот факт, что существует высокий уровень научного интереса в отношении безопасности TiO 2 [14-16]. Практически отсутствуют данные о воздействии нанодисперсного диоксида титана на организм наиболее восприимчивых к токсическому воздействию групп населения, таких как беременные женщины. Вместе с тем, любые данные о токсичности НЧ TiO 2 и их влиянии на генеративную функцию, развитие плода и потомства, безусловно, окажутся востребованными в практической медицине.
Цель исследования заключалась в изучении эмбриотоксических свойств нанодисперсного диоксида титана при пероральном введение крысам во время беременности.
Материалы и методы исследования . Исследование эмбриотоксических свойств наноформы диоксида титана проведено в соответствии с методическими указаниями «Токсиколого-гигиеническая оценка безопасности наноматериалов» [17]. Объектом исследования являлись самки крыс линии линии Wistar массой 170-210 г. Всех животных содержали в одинаковых условиях вивария на стандартном сбалансированном рационе, при свободном доступе к воде и пище, в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей. Для получения животных с точно датированным сроком беременности использовали метод анализа содержимого вагинальных мазков. В течение двух эстральных циклов просматривали вагинальные мазки. Отбирали самок в стадии проэструса и подсаживали на ночь в клетку к самцам (из расчета 1-2 самки на 1 самца); утром следующего дня проводили их обследование. Обнаружение в вагинальных мазках сперматозоидов принимали за первый день беременности. При их наличии производили маркировку крысы, определяли у нее массу тела.
В работе использовалась дисперсная форма диоксида титана, полученная разведением порошка TiO 2 в дистиллированной воде. Агрегацию наночастиц предотвращали обработкой суспензии нанодисперсного TiO 2 ультразвуком. Распределение частиц TiO 2 по размерам определяли на анализаторе размеров частиц Shimadzu SALD–7101. Средний размер НЧ TiO 2 составил 40-60 нм . В первой серии опытов изучена эмбриональная токсичность НЧ TiO 2 , регистрируемая в антенатальном периоде развития. Беременные самки крыс были разделены на 2 группы. Животным контрольной группы (n=10) один раз в сутки с 1-го по 20-й день беременности вводили перорально воду в дозе 1,5 мл (1-я группа). Животным экспериментальной группы (n=10) один раз в сутки — также с 1-го по 20-й день беременности — вводили перорально суспензию НЧ TiO 2 в дозе 50 мг/кг. Выбранная концентрация НЧ TiO 2 не превышала максимально переносимых доз для данного вещества.
На 20-й день беременности производили эвтаназию самок передозировкой эфирным наркозом (ЗАО «Вектон», Россия), в соответствии с требованиями Министерства здравоохранения Российской Федерации к работе экспериментально-биологических клиник, а также «Европейской конвенции по защите позвоночных животных, используемых для экспериментов или в научных целях» (г. Страсбург, 1986). Вскрывали матку и извлекали из брюшной полости репродуктивные органы. Матку вместе с яйцеводами и яичниками помещали в чашку Петри с теплым физиологическим раствором. Вскрыв рога матки, под бинокулярной лупой подсчитывали число живых и мертвых плодов, а также количество мест имплантации. В отсепарированных яичниках оценивали количество желтых тел. Критериями оценки эмбриотоксического и тератогенного действия наночастиц диоксида титана служили такие показатели как пред-, постимплантационная и общая смертность эмбрионов. Для определения предимплантационной смертности вычисляли разницу между количеством желтых тел и количеством мест имплантаций и определяли, какую долю составило это число от числа желтых тел в%. Постимплантационная смертность вычислялась по разности между количеством мест имплантаций и количеством живых плодов, соотнесенной на число мест имплантаций в%. Для вычисления общей эмбриональной смертности находили разность между числом желтых тел беременности и количеством живых плодов и определяли, какую долю в процентах составило это число от числа желтых тел беременности. Под бинокулярной лупой в чашке Петри плоды подвергали наружному осмотру, обращая внимание на состояние головы (особенно — лицевого черепа и глаз), позвоночника, хвоста, строение конечностей, наличие подкожных гематом. Проводили взвешивание плодов и с помощью линейки и штангенциркуля и определяли их кранио-каудальный размер.
Во второй серии опытов изучали отдаленные эффекты антенатального воздействия НЧ TiO 2 на развитие потомства крыс в раннем постнатальном периоде онтогенеза. Отбор беременных крыс проводили как описано выше в опыте по изучению антенатального развития. Беременным самкам контрольной группы (n=10) перорально вводили воду, а самкам опытной группы во время всего периода беременности – НЧ TiO 2 в дозе 50 мг/кг. Вели наблюдение за течением беременности, родами и лактации. За несколько дней до родов самок рассаживали в отдельные клетки по одной в каждую. Регистрировали дату родов, длительность беременности. Оценивали физическое развитие потомства в течение первых 30 суток жизни по ряду интегральных и специфических показателей: размер помета, число живых и мертворожденных, день отлипания ушной раковины, день появления первичного волосяного покрова, день прорезывания резцов, день открытия глаз, масса тела крысят (г) на 4-й, 7-й, 14-й и 21-й дни, гибель самок в период вскармливания.
Математико-статистическая обработка количественных данных проведена с использованием лицензионного пакета прикладных программ «STATISTICA» v.7.0 (StatSoft Inc., США). Определялись следующие основные характеристики:
выборочное среднее значение (среднее арифметическое, M) и стандартное отклонение (Standard Deviation, σ). Анализ соответствия вида распределения количественных признаков закону нормального распределения, проведенный с помощью критерия Шапиро-Уилка (Shapirо-Wilk’s W test) показал, что оно подчинялось закону нормального распределения. В связи с чем, сравнительный анализ групп проведен с использованием параметрических критериев сравнения (t-критерий Стьюдента) и оценки статистической значимости разности долей. Различия считали статистически значимыми при p<0,05. Количественные данные в таблице представлены в виде М±σ, где М – выборочное среднее, σ – стандартное отклонение [18, 19].
Результаты исследования и обсуждение. При наблюдении состояния беременных крыс в динамике не было выявлено признаков интоксикации, таких как, угнетение двигательной активности, гиперемия видимых слизистых оболочек, взъерошенность шерсти, снижение реакции на внешние раздражители и масса тела. Потребление воды и пищи животными опытной и контрольной групп не отличались. За все время наблюдения не было зафиксировано случаев патологического прерывания беременности. Результаты проведенного исследования показали, что крысы как контрольной, так и опытной групп на всем сроке беременности прибавляли вес. На 7-й, 14-й дни беременности существенных различий по этому показателю по сравнению с контрольной группой обнаружено не было (p>0,05). Однако, к третьей недели беременности самки крыс опытной группы имели меньший вес, чем крысы контрольной группы (p<0,05); общий прирост массы к исходной, по окончанию эксперимента составил 29±2,5% для контрольной группы и 25±2,8% для опытной. На рис. 1 представлены результаты измерения веса беременных самок контрольной и экспериментальной групп.
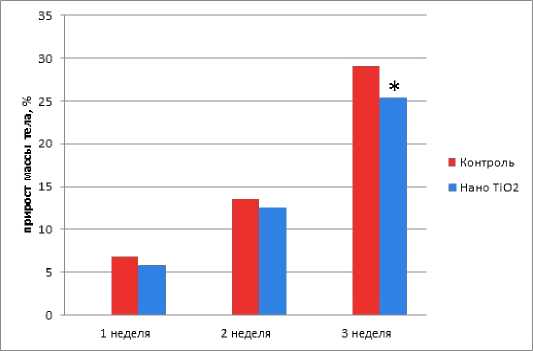
Рис. 1. Динамика массы тела беременных крыс (+% к исходной);
*- статистически значимые различия по сравнению с контролем.
На момент вскрытия все плоды в группах были живы и развиты соответственно сроку беременности. Результаты исследований свидетельствуют о том, что у самок крыс, получавших НЧ TiO 2 такие показатели, как продолжительность беременности, количество желтых тел, количество живых плодов и мест имплантации не отличались от соответствующих показателей интактных животных (табл. 1, p>0,05). Однако, пренатальное введение ноначастиц диоксида титана приводит к существенному повышению таких показателей, как предимплантационная гибель зигот, постимплантационная гибель эмбрионов и общая эмбриональная смертность. Так, предимплантационная смертность в группе крыс, которым перорально вводили НЧ TiO 2 составила 18,48%, а постимплантационная 12,16%, тогда как в контрольной группе эти показатели были равны 10,48% и 9,57%, соответственно. Это свидетельствует о негативном влиянии исследуемых наночастиц на антенатальное развитие потомства, приводящему к снижению их внутриутробной выживаемости.
Таблица 1
Показатели эмбриотоксического действия наночастиц диоксида титана при пероральном введении крысам с 1 по 19 день беременности в дозе 50мг/кг (M±σ и %)
|
Исследуемые показатели |
контроль |
нано TiO 2 |
|
Количество желтых тел яичников на 1 животное, шт. |
10,5±1,38 |
11,2±1,51 |
|
Количество мест имплантации на 1 животное, шт. |
9,40±1,25 |
9,13±1,18 |
|
Количество плодов на 1 животное, шт. |
8,5±1,24 |
8,02±1,05 |
|
Предимплантационная смертность, % |
10,48 |
18,48* |
|
Постимплантационная смертность, % |
9,57 |
12,16* |
|
Общая эмбриональная смертность, % |
19,05 |
28,39* |
|
Кранио-каудальный размер плода, см |
2,8±0,05 |
2,97±0,04 |
|
Масса плода, г |
1,95±0,03 |
2,1±0,01 |
* - статистически значимые различия по сравнению с контрольной группой (p<0,05)
Первые стадии беременности – периоды зачатия и завершения плацентации являются наиболее чувствительными к повреждающим факторам у млекопитающих и человека [20]. Характерным признаком предимплантационного периода развития (1–6 день беременности) является отсутствие морфологической связи между эмбрионом и матерью. Обнаруженные нами отклонения эмбриогенеза от нормального, и, в частности, повышение предимплантационной смертности, являются, по-видимому, суммарным выражением, как опосредованного, так и возможного прямого действия НЧ TiO2.
Постимплантационная смертность определяется количеством участков резорбции эмбрионов в матке, которые после их гибели вместе с окружающими их оболочками обезвоживаются и подвергаются аутолизу. У самок, получавших НЧ TiO 2 во время беременности, по сравнению с контролем, наблюдается тенденция уменьшения количества мест имплантаций и живых плодов, что указывает на увеличение числа резорбций (табл. 1). На рис. 2 представлены результаты вскрытия матки крысы опытной группы с участками резорбций, определяющиеся как уплотнения черного цвета размером 78 мм.
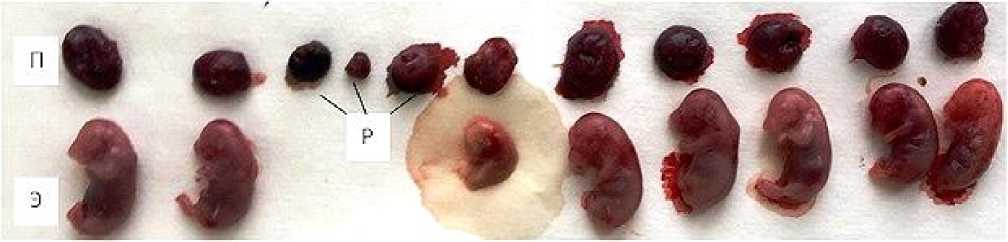
Рис. 2. Результаты вскрытия матки крысы опытной группы. Обозначения: П – плацента, Р – участки резорбций, Э – эмбрион.
При оценке влияния изучаемого препарата на соматометрические показатели плодов крыс установлено, что введение крысам на протяжении всего периода беременности изучаемого соединения не вызывало достоверных изменений кранио-каудального размера и веса плодов. Так, если средний вес плода в контрольной группе крыс составил 1,95±0,03 г, то у плодов на фоне перорального введения НЧ TiO 2 он был равен 2,1±0,01 г. При морфометрическом исследовании потомства крыс установлено, что только среди плодов опытной группы встречаются случаи гиперемии кожных покровов с сопутствующим поражением сосудов (кровоизлияния, гематомы). Таким образом, пероральное введение НЧ TiO 2 беременным самкам крыс оказывает выраженное эмбриотоксическое действие, которое выражается в значимом увеличении показателей эмбриотоксического эффекта - предимплантационной, постимплантационной и общей эмбриональной смертности.
Хорошо известно, что при введении ксенобиотиков, как чужеродных для живых организмов химических веществ, во время беременности их отрицательное влияние может проявляться не только в гибели и уродствах эмбрионов, но и в разнообразных отклонениях развития, наблюдаемых в постнатальном периоде [21]. Поэтому при изучении эмбриональной токсичности обязательными являются исследования возможного неблагоприятного антенатального воздействия изучаемых соединений на развитие потомства в раннем постнатальном периоде онтогенеза. В связи с этим, нами изучены отдаленные эффекты антенатального воздействия НЧ TiO 2 на постнатальное развитие потомства. Проводилось наблюдение на 88 крысятах контрольной группы и 83 крысятах опытной группы. Установлено, что пероральное введение НЧ TiO 2 не влияет на продолжительность беременности самок, которая составила в среднем 22-23 дня. Среднее количество плодов на одну самку и соотношение крысят по полу во всех группах было примерно одинаковым. Однако, наблюдение за потомством самок крыс в течение месяца позволило установить, что развитие крысят в опытной группе и контроле происходит с некоторыми различиями. Прежде всего, эти различия затронули важные показатели онтогенеза, которые позволяют судить о характере и выраженности действия ксенобиотиков. К ним можно отнести постнатальную смертность и прирост массы тела (табл. 2). В опытной группе крыс гибель крысят в период вскармливания была выше, чем в группе контроля (6,81%) и составила 13,97% (p<0,05). Взвешивание крысят на 4-й, 7-й, 14-й и 21-й дни после родов показало, что масса тела крысят в группе крыс, которым перорально вводили НЧ TiO 2 была ниже, что позволяет сделать вывод об угнетающем действии изучаемого соединения на массу тела крысят. В опытной группе нами было обнаружено, что основные морфологические признаки созревания крысят, такие как отлипание ушной раковины, появление первичного волосяного покрова, прорезывание резцов, открывание глаз проявлялись позже, чем у крыс контрольной группы (различия статистически значимы при p<0,05, табл.2). Таким образом, при изучении антенатального воздействия НЧ TiO 2 на постнатальное развитие потомства было выявлено повышение смертности крысят в период их вскармливания, отставание в наборе веса и задержка морфофункционального созревания на постнатальном этапе онтогенеза.
Полученные нами данные о негативном влиянии перорального введения НЧ TiO 2 во время беременности на пренатальное и постнатальное развитие потомства крыс хорошо согласуются с результатами исследований других авторов. Так, ранее было показано, что подкожное введение беременным самкам мышей НЧ TiO 2 приводит к определенным повреждениям репродуктивных органов и нейронов центральной нервной системы потомства [22]. По данным этих авторов подкожная инъекция беременным самкам мышей наноформы диоксида титана вызывает изменение экспрессии генов, связанных с развитием мозга, гибелью нейронов, оксидативным стрессом и повышением активности митохондрий в головном мозге в перинатальный период.
В других исследованиях обнаружено, что диоксид титана с размером частиц 70 и 35 нм при внутривенном введении беременным самкам мышей также провоцирует осложнение беременности [23]. При этом НЧ были обнаружены в плаценте, печени и головном мозге плодов. Наблюдение за развитием потомства крыс, которым во время беременности интраназально вводили НЧ TiO2, продемонстрировало нарушение поведения и когнитивных функций крысят в возрасте пяти месяцев [23]. При исследовании влияния внутрижелудочного введения НЧ TiO2 беременным крысам в дозе 100 мг/кг на пролиферативную активность клеток головного мозга потомства показано, что в нейронах гиппокампа значительно снижается число Ki-67-имунопозитивных клеток. В этой же работе результаты теста Морриса свидетельствовали о том, что НЧ TiO2 вызывают ухудшение памяти и способность к обучению у потомства. Эти и другие данные указывают на нейротоксический эффект нанодисперсного диоксида титана при пренатальном введении беременным самкам крыс [24].
Таблица 2
Влияние перорального введения нанодисперсного диоксида титана самкам крыс во время беременности на постнатальное развитие потомства (M±σ и %)
|
Исследуемые показатели |
контроль |
нано TiO 2 |
|
Среднее число крысят на самку при рождении |
8,8±1,5 |
8,3±1,8 |
|
Гибель крысят в период вскармливания, % |
6,81% |
13,97%* |
|
Соотношение полов (самки/самцы) |
1,29 |
1,33 |
|
День отлипания ушной раковины |
4,09±0,05 |
4,68±0,05* |
|
День появления первичного волосяного покрова |
5,71±0,23 |
5,48±0,15 |
|
День прорезывания резцов |
10,75±0,17 |
11,5±0,08 |
|
День открытия глаз |
15,87±0,08 |
16,9±0,02* |
|
масса тела крысят (г) на 4-й день |
8,07±0,03 |
7,45±0,02* |
|
масса тела крысят (г) на 7-й день |
14,03±0,02 |
13,15±0,03* |
|
масса тела крысят (г) на 14-й день |
18,06±0,07 |
16,60±0,04* |
|
масса тела крысят (г) на 21-й день |
27,51±0,23 |
25,5±0,05* |
- статистически значимые различия по сравнению с контрольной группой (p<0,05).
Сравнительное изучение эмбриотоксического действия водных дисперсий микро- и наноформ (40 нм, смесь рутила и анатаза) диоксида титана при пероральном введении крысам во время беременности в дозе 100 мг/кг показало, что наночастицы и микрочастицы оказывают на лабораторных крыс-самок сходное слабо выраженное общетоксическое действие [25]. Однако при исследовании пренатального воздействия НЧ TiO 2 авторами были описаны разнонаправленные модификации процессов морфофункционального созревания, зарегистрирован комплекс отклонений, индуцированных у потомков диоксидом титана разной размерности. Аналогичная зависимость эмбриотоксических эффектов от размерности и форм была продемонстрирована в ряде исследований для наночастиц золота [26-28].
Заключение. Таким образом, несмотря на существование биологических барьеров, которые в целом достаточно эффективно защищают развивающийся организм, исследованные нами наночастицы диоксида титана, по-видимому, оказывают существенные эмбриотоксические эффекты, в том числе отсроченные по их проявлению у подвергшегося воздействию потомства. Несмотря на то, что воздействие наночастиц диоксида титана, как правило, считается относительно безопасным, в связи с полученными экспериментальными данными должна сохраняться высокая настороженность по поводу потенциального негативного воздействия наночастиц на наиболее восприимчивые к воздействию ксенобиотиков группы населения, такие как беременные женщины и развивающийся плод.
Список литературы Исследование эмбриотоксического действия наночастиц диоксида титана на крыс
- Oberdorster G. Pulmonary effects of inhaled ultrafine particles. Int Arch Occup Environ Health. 2001; 74 (1): 8.
- Kaida T., Kobayashi K., Adachi M., Suzuki F. Optical characteristics of titanium oxide interference film and the film laminated with oxides and their applications for cosmetics. J Cosmet Sci. 2004; 55: 219-220.
- Wang J.J., Sanderson B.J., Wang H. Cyto-and genotoxicity of ultrafine TiO2 particles in cultured human lymphoblastoid cells. Mutat Res. 20076289 (99): 106.
- Wolf R., Matz H., Orion E., Lipozencic J. Sunscreens -the ultimate cosmetic. Acta Dermatovenerol Croat. 2003; 11: 158-162.
- Baan R., Straif K., Grosse Y., et al. Carcinogenicity of carbon black, titanium dioxide, and talc. Lancet Oncol. 2006; 7: 295-296.
- Robertson T.A., Sanchez W.Y., Roberts M.S. Are commercially available nanoparticles safe when applied to the skin? J Biomed Nanotechnol. 2010; 6: 452-468.
- EU -European Commission Recommendation on the definition of nanomaterial. URL: http://osha.europa.eu/en/news/eu-european-commissionrecommendation-on-the-definition-of-nanomaterial. Date of request 30/09/2017.
- American Conference of Governmental Industrial Hygienists (ACGIH): Threshold limit values and biological exposure indices for 1992-1993. Cincinnati: Ohio: American Conference of Governmental industrial hygienists, 1992.
- Weir A., Westerhoff P., Fabricius L., Hristovski K., von Goetz N. Titanium dioxide nanoparticles in food and personal care products. Environ SciTechnol. 2012; 46: 2242-2250.
- Yuan Y., Ding J., Xu J., Deng J., Guo J. TiO2 nanoparticles co-doped with silver and nitrogen for antibacterial application. J Nanosci Nanotechnol. 2010; 10: 4868-4874.
- Risk Science Institute Workshop Participants ILSI. The relevance of the rat lung response to particle overload for human risk assessment: A workshop consensus report. Inhal Toxicol. 2000; 12: 1-17.
- Zhao J., Bowman L., Zhang X., et al. Titanium dioxide (TiO2) nanoparticles induce JB6 cell apoptosis through activation of the caspase-8/Bid and mitochondrial pathways. J Toxicol Environ Health A. 2009; 72: 1141-1149.
- Lee K.P., Trochimowicz H.J., Reinhardt C.F. Pulmonary response of rats exposed to titanium dioxide (TiO2) by inhalation for two years. Toxicol Appl Pharmacol. 1985; 79: 179-192.
- Hongbo S., Ruth M., Vincent C., Jinsbun Z. Titanium dioxide nanoparticles: a review of current toxicological data. Particle and Fibre Toxicology. 2013; 10(15): 1-33.
- Songo B., Liu J., Feng X., Wi L., Shao L. A review on potential neurotoxicity of titanium dioxide nanoparticles. Nanoscale res Lett. 2015; 10(1): 1042.
- Syed N.S., Zahir S., Muzammal H., Muzaffar K. Hazardous Effects of Titanium Dioxide Nanoparticles in Ecosystem. Bioinorganic Chemistry and Applications. 2017;
- DOI: 10.1155/2017/4101735
- MU 1.2.2520_09 Toksikologo-gigienicheskaya otsenka bezopasnosti nanomaterialov. M., 2007. URL: https://ohranatruda.ru/ot_biblio/normativ/data_normativ/57/57354/Date of request 30/09/2017.
- Lang E.A. Kak opisyvat' statistiku v meditsine. Annotirovannoe rukovodstvo dlya avtorov, redaktorov i retsenzentov. M.: prakticheskaya meditsina, 2011. 480s.
- Petri A., Sebin K. Naglyadnaya statistika v meditsine. M.: GEOTAR-media, 2003. 144s.
- Mazur I.A., Voloshin N.A., Grigor'eva E.A. i dr. Doklinicheskoe issledovanie embriotoksichnosti i teratogennosti preparata liziniy. Patologiya. 2011; 8(2): 85-88.
- Bokov D.A., Neverova P.S., Obidchenko M.P., Senchukova M.A., Shevlyuk N.N. Eksperimental'noe modelirovanie toksigennoy patologii embriogeneza: ekologicheskie aspekty. Vestnik Orenburgskogo universiteta. 2015; 10(185): 203-207.
- Shimizu M., Tainaka H., Oba T., et al. Maternal exposure to nanoparticulate titanium dioxide during the prenatal period alters gene expression related to brain development in the mouse. Part Fibre Toxicol. 2009; 6: 20.
- Engler-Chiurazzi E.B., Stapleton P.A., et al. Impacts of prenatal nanomaterial exposure on male adult Sprague-Dawley rat behavior and cognition. J. Toxicol Environ Health A. 2016; 79(11): 447-52.
- Mohammadipour A., Fazel A., Haghir H., et al. Maternal exposure to Titanium dioxide nanoparticles during pregnancy; impaired memory and decreased hippocampal cell proliferation I rat offspring. Environ. Toxicol. Pharmacol. 2014; 37(2): 617-25.
- Tochilkina L.P., Bocharova L.Yu., Sroslov M.S., Filatov B.N., Khodykina N.V. Eksperimental'noe issledovanie embriotoksichnosti nanochastits dioksida titana. Meditsina ekstremal'nykh situatsiy. 2014; 4(50): 48-58.
- Михеева Н.А., Рыжова М.В., Никифоров Р.В., Терентюк Г.С., Хлебцов Н.Г., Хайруллин Р.М. Проницаемость гемато-плацентарного барьера белых крыс для золотых наночастиц//Российский биотерапевтический журнал. -2011. -T. 10. -№ 4. -S. 113.
- Цыганова Н.А., Хайруллин Р.М., Терентюк Г.С., Хлебцов Б.Н., Богатырев В.А., Дыкман Л.А., Ерыков С.Н., Хлебцов Н.Г. Проницаемость пегилированных золотых наночастиц через гематоплацентарный барьер крыс//Бюллетень экспериментальной биологии и медицины. -2014. -T. 157. -№ 3. -S. 366-369.
- Михеева Н.А., Хайруллин Р.М. Проницаемость наночастиц через гематоплацентарный барьер/В кн.:: Современная медицина: традиции и новации. Сб. ст. II межднар.. науч.-практ. конф.-Екатеринбург: Издательско-полиграфическое предприятие Макс-Инфо, 2017. -С. 26-30.


