Исследование кинетики аланинаминотрансферазной активности в картофеле
Автор: Бландов А.Н., Муста оглы Н.М.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Фундаментальная и прикладная химия, химическая технология
Статья в выпуске: 4 (66), 2015 года.
Бесплатный доступ
Аминотрансферазы (трансаминазы) катализируют межмолекулярный перенос аминогруппы с аминокислот на кетокислоты, причем коферментом в этой реакции служит пиридоксальфосфат, который выполняет роль промежуточного акцептора аминогруппы. Например, аланинаминотрансфераза (АлАТ) катализирует реакцию переаминирования между аланином и α-кетоглутаровой кислотой. Определены кинетические параметры аланинаминотрансферазы картофеля методом Лайнуивера-Берка: Km = 0,298 ммоль/л, V max = 0,0151 мкмоль/мин. При больших концентрациях субстрата было обнаружено снижение скорости ферментативной реакции. Поскольку степень конверсии субстрата в продукт в условиях опыта не превышает 1 %, это говорит о явлении субстратного ингибирования. Используя предположение об образовании неактивного двухсубстратного комплекса, проанализирована соответствующая кинетическая схема для бесконкурентного ингибирования, где роль ингибитора играет субстрат. Выведено уравнение Михаэлиса-Ментен и Лайнуивера-Берка для этого случая и, путем дифференцирования, определено положение точки экстремума на графике Лайнуивера-Берка: Ki = [ S ]2min/ Km. Это позволило рассчитать константу ингибирования субстратом, которая составила Ki = 0,428 ммоль/л.
Аланинаминотрансфераза (алат), субстратное ингибирование, константа михаэлиса, максимальная скорость реакции, константа ингибирования
Короткий адрес: https://sciup.org/14043236
IDR: 14043236 | УДК: 547.772
Текст научной статьи Исследование кинетики аланинаминотрансферазной активности в картофеле
Аминотрансферазы являются одними из ключевых ферментов обмена аминокислот и кетокислот. Они представлены как в тканях человека и животных, так и растений и микроорганизмов. По международной классификации их относят к классу трансфераз, подкласс переносящие азотистые группы, подподкласс аминотрансферазы. Наиболее известными их представителями являются аланин- и аспартатаминотрансфераза (КФ 2.6.1.2 и 2.6.1.1), катализирующие следующие реакции трансаминирования (рисунок 1)[1, 2].
При этом в клетках происходит синтез необходимых аминокислот из кетокислот, являющихся метаболитами гликолиза и цикла Кребса, либо наоборот превращение аминокислот в кетокислоты с последующим их использованием на энергетические нужды. Учитывая обратимость этих реакций, равновесия могут смещаться в ту или другую сторону в зависимости от потребностей клеток.
|
COOH |
COOH |
|||||
|
CH 3 |
+ |
CO |
аланинамино- |
CH 3 |
CH NH 2 |
|
|
CH NH 2 COOH |
CH 2 |
CO COOH |
+ |
CH 2 CH 2 COOH |
||
|
CH 2 COOH |
трансфераза |
|||||
|
аланин |
α-кетоглутаровая кислота |
пировиноградная кислота |
глутаминовая кислота |
|||
|
б |
||||||
|
COOH CH 2 |
+ |
COOH CO |
аспартатамино- |
COOH CH 2 |
COOH CH NH 2 |
|
|
CH NH 2 COOH |
CH 2 |
CO COOH |
+ |
CH 2 CH 2 COOH |
||
|
CH 2 COOH |
трансфераза |
|||||
|
аспарагиновая кислота |
α-кетоглутаровая кислота |
щавелево-уксусная кислота |
глутаминовая кислота |
|||
|
Рисунок 1. Реакции трансаминирования: а |
– аланинаминотрансфераза; б – |
аспартатаминотрансфераза |
||||
Эти ферменты (сокращенно АЛТ, АСТ) широко используются в медицинской диагностике заболеваний, связанных с цитолизом – гепатиты, инфаркты, т. к. они являются в основном внутриклеточными ферментами и их уровень в крови резко повышается при массивном цитолизе (разрушении клеток). В связи с этим их называют индикаторными ферментами [3-7].
В растениях эти ферменты выполняют аналогичные биохимические функции, однако гораздо меньше изучались, чем в организме человека и животных. Так, в работе [8] была изучена динамика активности АЛТ и АСТ при прорастании семян сои и было показано, что активность АЛТ в семядолях значительно повышается на третьи сутки проращивания, а через пять суток резко снижается (в три раза по сравнению с первыми сутками). Это связано, по-видимому, с тем, что семядоли значительно атрофируются к этому моменту. Однако активность АЛТ в проростках повышается в три раза на пятые сутки роста. Это может быть связано, по мнению авторов, с участием пирувата в синтезе глюкозы по реакциям глюконеогенеза [8-12]. Активность АСТ в семядолях также значительно повышается на третьи сутки, а на пятые сутки возвращается к исходным значениям. В проростках она также значительно повышается на 3-5 сутки. Авторы объясняют это необходимостью синтеза α-кетоглутарата, который занимает централь- ное место в синтезе аминокислот и затем белков, в том числе ферментов [8-12].
Однако в литературе не изучался более широкий ряд растительных объектов, а также кинетические параметры рассматриваемых ферментов. Поэтому целью настоящего исследования стало изучение активности и кинетических параметров АЛТ в растительном сырье. В качестве объекта исследования нами был выбран картофель.
Между тем, ранее было показано, что активность АЛТ может служить показателем свежести рыбного сырья [13-15]. Поэтому, изучение активности АЛТ в растительном сырье может представлять интерес при анализе пищевого сырья и контроле качества готовых продуктов, о возможном влиянии химических добавок, в частности, консервантов и образующихся из них вторичных метаболитов на ферментативную активность пищевых систем, что делает энзиматические исследования актуальными и приложимыми для решения практических задач пищевой промышленности.
По количеству образовавшейся пировиноградной кислоты можно судить об активности фермента. Пировиноградную кислоту определяют колориметрически по цветной реакции с 2,4-динитрофенилгидразином, приводящей к образованию окрашенного 2,4-динитрофенилгидразона (рисунок 2).
CH 3
CO +
COOH пировиноградная кислота
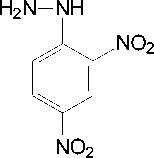
- H 2 O
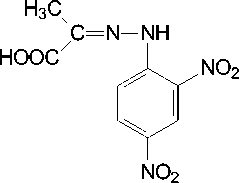
2,4-динитро-фенилгидразин
2,4-динитрофенилгидразон (красно-бурого цвета)
Рисунок 2. Цветная реакция пировиноградной кислоты с 2,4-динитрофенилгидразином
Субстратная смесь, приготовленная следующим образом: в 100 мл фосфатного буфера с pH 7,4 растворяют 1,78 г DL-аланина (или 0,89 г α-аланина) и 29,2 мг α-кетоглутаровой кислоты (смесь хранится в замороженном виде); 0,02 %-й раствор 2,4-динитрофенилгидразина в 1н HCl; 0,4н раствор NaOH. Фотоэлектрический колориметр ФЭК-Н-57 с зеленым светофильтром с λ = 540 нм и кюветами с рабочим расстоянием 10 мм; термостат на 38 °С; картофель.
Определение активности аланинаминотрансферазы
Навеска картофеля 2 г растиралась в ступке с 10 мл воды и полученный гомогенат фильтровался через бумажный фильтр. Затем к 0,2 мл фильтрата гомогената добавляли 0,5 мл субстратной смеси, выдерживали при температуре 38 ºС в течение 30 мин, после чего добавля- ли 0,5 мл раствора ДНФГ и через 15 мин 5 мл 0,4н NaOH. Определяли оптическую плотность раствора относительно холостой пробы, полученной при использовании вместо фильтрата гомогената 0,2 мл дистиллированной воды.
Формулы для расчетов
C = D мкмоль; (1)
E- 1 ,
V = C мкмоль/мин, (2)
t, где ε = 0,45; l = 1 см; t = 30 мин.
Коэффициент экстинкции ε определяется по ряду стандартных растворов, содержащих ДНФГ пировиноградной и α-кетоглутаровой кислоты. Результаты эксперимента приведены в таблице 1 и показаны на рисунке 3.
Т а б л и ц а 1
Численные результаты опытов
|
№ разведения |
[ S ], ммоль/л |
1/[ S ], л/ммоль |
D 1 |
D 2 |
D средн |
V средн, мкмоль/мин |
1/ V , мин/мкмоль |
|
1 |
1,429 |
0,7 |
0,165 |
0,150 |
0,1575 |
0,01167 |
85,71 |
|
2 |
0,714 |
1,4 |
0,140 |
0,150 |
0,145 |
0,01074 |
93,10 |
|
3 |
0,476 |
2,1 |
0,120 |
0,130 |
0,125 |
0,00926 |
108,00 |
|
4 |
0,357 |
2,8 |
0,125 |
0,100 |
0, 1125 |
0,00833 |
120,00 |
|
5 |
0,286 |
3,5 |
0,120 |
0,085 |
0,1025 |
0,00759 |
131,71 |
|
6 |
0,238 |
4,2 |
0,085 |
0,100 |
0,0925 |
0,00685 |
145,95 |
|
7 |
0,204 |
4,9 |
0,080 |
0,090 |
0,085 |
0,00630 |
158,82 |
|
8 |
0,179 |
5,6 |
0,080 |
0,075 |
0,0775 |
0,00574 |
174,19 |
Определены кинетические параметры аланинаминотрансферазы картофеля методом Лайнуивера-Берка: К m = 0,298 ммоль/л, V max = 0,0151 мкмоль/мин.
Из графика (рисунок 3) видно, что в области больших концентраций наблюдается небольшое отклонение графика вверх. Это может говорить о наличии субстратного ингибирования.
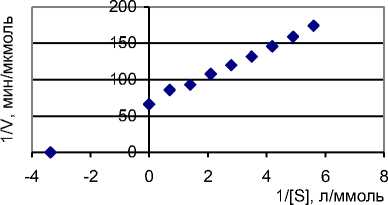
Рисунок 3. Определение активности аланинаминотрансферазы
Субстратное ингибирование (ингибирование избытком субстрата) можно рассматривать в качестве частного случая бесконкурентного ингибирования. Помимо изменения свойств среды при больших [ S ] причиной такого явления может быть образование неактивного комплекса с двумя молекулами субстрата ES 2 и тогда субстрат фактически играет роль бесконкурентного ингибитора, а кинетическая схема выглядит следующим образом:
S
V = V max ------ ■ .
K m + [ S ] + [ S L
K i
Тогда уравнение Лайнуивера-Берка будет иметь следующий вид:
1 1 fl K [ S ] )
= 1 + -m +^
V V max V [ S ] K ; J
E + S _ w ES -----► E + P k-i
* c [ES] [S]
+ S Ki= ------ t [ES2]
ES 2
,(3)
здесь K i – константа ингибирования субстратом, т.е. константа диссоциации двойного фер-мент-субстратного комплекса. Проведем для этого случая вывод уравнения Михаэлиса-Ментен:
V = k 2 [ ES ] ; V max = k 2 [ E ] , ;
k 1 [ E ][ S ] = k -1 [ ES ] + k 2 [ ES ] ; (4)
[ E H k _ , + k 2
[ ES ] k , m .
Запишем уравнение материального баланса по ферменту, в котором в данном случае будет три слагаемых:
[ E ] o = [ E ] + [ ES ] + [ ES 2 ] = [ E ] + [ ES ] f 1 +[ S 1 '■
V K i 2 7
Выразим отсюда [ E ] и подставим в выражение константы Михаэлиса:
При этом на графике Лайнуивера-Берка в области больших концентраций субстрата наблюдается отклонение от линейности, и на графике, как в нашем случае, будет наблюдаться минимум (см. рисунок 3).
Для того чтобы найти [ S ], соответствующую минимуму, продифференцируем обратную скорость (обозначим ее y ) по обратной концентрации (обозначим ее x ). В точке экстремума производная обращается в ноль. Исходя из этого, находим [ S min ]:
_ = y;
V [ S ]
У = — 1 + K m x +— ; (8)
Vmax V dy = _LfK + * 1=JLfK -[St' dx Vmax V m X2 Ki J V,,, V m Ki
[ s min ] = K K Ki^ ;
K i =
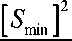
= 0;
[ E ] , - [ ES ] ' ' +K
[ ES ]
[ S ]
—= K m ; (5)
[ s ][ E ]0- = k + [ S ] K L±I S 1
L J [ ES ] m L J K i
.
Теперь выразим отсюда [ ES ] и преобразуем выражение в форму, похожую на уравнение Михаэлиса-Ментен:
[ ES ] = [ E ]>
[ S ]
K m + [ S ] [ 1 + [ - ]
V K J
Непосредственно по графику рассчитать K i невозможно, т.к. на первом участке кривой зависимость не является линейной. Однако в точке минимума на графике Лайнуивера-Берка производная d(1/ V )/d(1/[ S ]) обращается в ноль. Отсюда следует, что K i = [ S min ]2/ K m . Это дает возможность рассчитать константу ингибирования исходя из точки экстремума на графике.
Кинетические параметры реакции определяются экстраполяцией линейного участка графика в области малых концентраций до пересечения с осями, как и в обычном случае.
Для проверки предположения об ингибировании субстратом мы провели опыт, взяв меньшее количество фермента (1,5 г картофеля в том же объеме воды) и увидели явное отклонение вверх при больших концентрациях субстрата, что подтверждает предположение о субстратном ингибировании. Результаты эксперимента представлены в таблице 2 и показаны на рисунке 4.
Т а б л и ц а 2
Численные результаты опытов
|
№ разведения |
[ S ], ммоль/л |
1/[ S ], л/ммоль |
D 1 |
D 2 |
D средн |
V средн, мкмоль/мин |
1/ V , мин/мкмоль |
|
1 |
1,429 |
0,7 |
0,165 |
0,150 |
0,1575 |
0,01167 |
85,71 |
|
2 |
0,714 |
1,4 |
0,140 |
0,150 |
0,145 |
0,01074 |
93,10 |
|
3 |
0,476 |
2,1 |
0,120 |
0,130 |
0,125 |
0,00926 |
108,00 |
|
4 |
0,357 |
2,8 |
0,125 |
0,100 |
0, 1125 |
0,00833 |
120,00 |
|
5 |
0,286 |
3,5 |
0,120 |
0,085 |
0,1025 |
0,00759 |
131,71 |
|
6 |
0,238 |
4,2 |
0,085 |
0,100 |
0,0925 |
0,00685 |
145,95 |
|
7 |
0,204 |
4,9 |
0,080 |
0,090 |
0,085 |
0,00630 |
158,82 |
|
8 |
0,179 |
5,6 |
0,080 |
0,075 |
0,0775 |
0,00574 |
174,19 |
|
300 250 |
♦ |
|
200 |
|
|
150 |
|
|
100 |
|
|
50 |
|
|
—♦ 0 |
-5 0 5 10
1/[S], л/ммоль
Рисунок 4. Определение активности аланинаминотрансферазы
Из графика, показанного на рисунке 4, видно, что минимум на графике Лайнуивера-Берка соответствует четвертому разведению, т.е. [S]min = 0,357 ммоль/л. Это позволяет вычислить константу ингибирования субстратом по формуле Ki = [S]2min /KM = 0,428 ммоль/л. Константа Михаэлиса здесь определяется экстраполяцией линейной части графика в области малых концентраций субстрата до пересечения с осями и она численно совпадает с определенной в первом опыте. Однако Vmax = 0,0128 мкмоль/мин, что меньше, чем в первом опыте, т.к. использовалась меньшая масса картофеля и соответственно меньшее количество фермента.
Аналогичная ситуация наблюдалась в работе [16] для АЛТ чеснока, для которой были найдены K M = 0,0206 ммоль/л и K i =0,0777 ммоль/л. Отсюда видно, что сродство к субстрату для АЛТ чеснока гораздо больше, чем для картофеля.
Список литературы Исследование кинетики аланинаминотрансферазной активности в картофеле
- Комов В.П., Шведова В.Н. Биохимия. 3-е изд. М.: Дрофа, 2008. 638 с.
- Смирнов В.А., Климочкин Ю.Н. Ферменты. Классификация и номенклатура. Самара, 2008. 42 с.
- Николаев А.Я. Биологическая химия. 3-е изд. М.: Медицинское информационное агентство. 2004. 566 с.
- Северин Е.С. Биохимия: учебник. 4-е изд. М.: ГЭОТАР-Медиа, 2006. 784 с.
- Северин Е.С., Николаев А.Я. Биохимия. Краткий курс с упражнениями и задачами. М.: ГЭОТАР-МЕД, 2001. 448 с.
- Щербак И.Г. Биологическая химия. СПб.: Издательство СПбГМУ, 2005. 480 с.
- Березов Т.Т., Коровкин Б. Ф. Биологическая химия: учебник. 3-е изд. М.: Медицина, 1998, 704 с.
- Бездудная О.Ф., Калиман П.А. Изменение содержание белка и трансаминирования аминокислот при прорастании семян сои (GLICINE MAX L.)//Вiсник Харкiвського нацiонального унiверситету iменi В.Н.Каразiна. Серiя: бiологiя. 2006. Вып. 4. № 748. С. 17-20.
- Плакунов В.К. Основы энзимологии. М.: Логос, 2002. 128 с.
- Lancien M., Hodges M. Enzyme redundancy and the importance of 2-oxoglutarate in higher plant ammonia assimilation//Plant Physiol. 2000. V. 123. P. 817-824.
- Жмурко В.В., Джамаев В.Ю. Дегидрогеназная активность и содержание растворимого белка в корнях проростков сои (Glicine max L.) при оптимальной и пониженной температурах//Физиология и биохимия культурных растений. 1999. Т. 31. № 4. С. 308-313.
- Жмурко В.В., Джамеев В.Ю. Рiст, завиток та фiзiолого-бiохiмiчнi процеси у теплолюбивих культур при адаптацїї до пониженої температури//Фiзiологiя рослин в Українi на межi тисячолiть. 2001. Т. 2. С. 182-189.
- Шлейкин А.Г., Данилов Н.П., Шарапова Т.А. Технологические и медико-биологические аспекты действия трансглутаминазы//Известия СПбГУНиПТ. 2009. № 3/4. С. 47-49.
- Shleikin A.G., Danilov N.P. Evolutionary-biological peculiarities of transglutaminase. Structure, physiological functions, application//Journal of Evolutionary Biochemistry and Physiology. 2010. V. 47. № 1. P. 1-14.
- Shleikin A.G., Danilov N.P., Ternovskoy G.V. Modification of food products properties by use of transglutaminase. Original Research//Procedia Food Science. 2011. V. 1. P. 1568-1572.
- Маджидов Ш.Б. Изучение аминотрансферазной активности растительного сырья. СПб.: Университет ИТМО. 2014. 76 с.


