Исследование кристаллических структур 2,4-динитробензолсульфонатов алкилтрифенилфосфония [Ph3PAlk][ OSO2C6H3(NO2)2-2,4], Alk = C3H5-cyclo, (CH2)2OH, CH2OH, CH2С(O)Me
Автор: Шарутин В.В., Механошина Е.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
Из бромидов алкилтрифенилфосфония и 2,4-динитробензолсульфоновой кислоты в воде получены и структурно охарактеризованы ионные 2,4-динитробензолсульфонаты алкилтрифенилфосфония [Ph3PAlk][OSO2C6H3(NO2)2-2,4] (Alk = C3H5-cyclo (1), (CH2)2OH (2), CH2OH (3), CH2С(O)Me (4)). Кристаллы 1 [C27H23N2O7PS, M 550,50; сингония моноклинная, группа симметрии P-1; параметры ячейки: a = 9,354(11), b = 9,764(10), c = 15,416(17) Å; a = 106,29(4)°, β = 94,67(5)°, g = 97,98)6)°; V = 1328(3) Å3, Z = 2; rвыч = 1,377 г/см3], 2 [C26H23N2O8PS, M 554,49; сингония моноклинная, группа симметрии P21/с; параметры ячейки: a = 13,049(7), b = 14,816(10), c = 13,261(7) Å; a = 90,00°, β = 93,901(15), g = 90,00°, V = 2558(2) Å3, Z = 4; rвыч = 1,440 г/см3], 3 [C25H21N2O8PS, M 540,47; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 9,086(14), b = 10,95(2), c = 13,17(2) Å; a = 86,20(9)°, β = 71,93(6)°, g = 89,51(11), V = 1243(4) Å3, Z = 2; rвыч = 1,444 г/см3], 4 [C27H23N2O8PS, M 566,50; сингония триклинная, группа симметрии P-1; параметры ячейки: a = 9,746(10), b = 11,371(11), c = 13,657(10) Å; a = 66,78(3)°, β = 86,30(3)°, g = 74,46(5), V = 1339(2) Å3, Z = 2; rвыч = 1,405 г/см3]. По данным РСА, атомы фосфора в катионах 1-4 имеют искаженную тетраэдрическую координацию, сульфонатные анионы обладают обычной геометрией с тетраэдрическим атомом серы. Длины связей Р-С изменяются в интервале 1,768(3)-1,830(3) Å; валентные углы СРС принимают значения 105,54(9)-112,42(9)°. В аренсульфонатных анионах комплексов расстояния S-C близки между собой [1,794(2)-1,807(3) Å], связи S-О практически выровнены [1,363(4)-1,495(4) Å]. Структурная организация в комплексах 1-4, в основном, обусловлена слабыми межмолекулярными контактами типа O···Н 2,31-2,71 Å (1), 2,35-2,64 Å (2), 2,38-2,70 Å (3), 2,24-2,90 Å (4).
2, 4-динитробензолсульфоновая кислота, бромид алкилтрифенилфосфония, 2, 4-динитробензолсульфонат алкилтрифенилфосфония, синтез, молекулярная структура, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147246065
IDR: 147246065 | УДК: 546.185 | DOI: 10.14529/chem240404
Текст научной статьи Исследование кристаллических структур 2,4-динитробензолсульфонатов алкилтрифенилфосфония [Ph3PAlk][ OSO2C6H3(NO2)2-2,4], Alk = C3H5-cyclo, (CH2)2OH, CH2OH, CH2С(O)Me
Фосфорорганические соединения обладают уникальными свойствами и находят применение в различных сферах практической деятельности: в качестве пластификаторов, дефолиантов, фунгицидов, гербицидов, инсектицидов, антипиренов, присадок к бензинам и смазочным маслам [1]. Органические соединения фосфора также являются катализаторами гидрофункционализации непредельных субстратов [2], реагентами для транс -металлирования [3], метатезиса σ -связей [4], для получения элементоорганических соединений [5] и олефинов [6]. Четвертичные фосфониевые соли обладают высокой биологической активностью и применяются в качестве противоопухолевых и антимикробных соединений [7‒9]. Простейшие производные тетраорганилфосфония можно синтезировать по реакции пентафенилфосфора с кислотами [10‒13], окислительного присоединения из трифенилфосфина и органилгалогенида [14, 15] или ненасыщенных соединений с последующей обработкой HCl или HBr [16, 17]. В работах [18‒22] обсуждались структурные характеристики ряда аренсульфонатов тетраорганилфосфония. Для синтеза данных комплексов смеси аренсульфоновой кислоты и галогенидов тетраорганилфосфония выдерживали при нагревании в различных растворителях (ДМФА, бензоле, метаноле, диэтиловом эфире, ацетоне, ТГФ, ацетонитриле); выходы продуктов при этом не превышали 78%. Разработка методов получения фосфониевых солей, содержащих в лигандах при атоме фосфора различные функциональные группы с анионами сложного строения, является на сегодняшний день одним из перспективных направлений в элементорганической химии.
В настоящей работе впервые синтезированы и структурно охарактеризованы 2,4-динитробензолсульфонаты алкилтрифенилфосфония [Ph 3 PAlk][OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] (Alk = C 3 H 5 - cyclo ( 1 ) , (CH 2 ) 2 OH ( 2 ), CH 2 OH ( 3 ), CH 2 С(O)Me ( 4 ).
Экспериментальная часть
ИК-спектры соединений 1 ‒ 4 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
В работе использовали бромиды алкилтрифенилфосфония и 2,4-динитробензолсульфоновую кислоту производства фирмы Alfa Aesar.
Общая процедура синтеза
Для синтеза 2,4-динитробензолсульфонатов алкилтрифенилфосфония смешивали эквимолярные количества водных растворов бромида алкилтрифенилфосфония и 2,4-динитробензолсульфоновой кислоты. При медленном испарении растворителя выделялись бесцветные кристаллы, которые сушили на воздухе и взвешивали.
Выход соединения 1 составил 93 %, т. пл. 112 ° С.
Для [Ph 3 PC 3 H 5 - cyclo ][OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] ( 1 ) найдено (%): C 58,61; Н 4,64, для C 27 H 23 N 2 O 7 PS рассчитано (%): С 58,91; Н 4,18. ИК-спектр ( v , см - 1): 3105 сл., 3001 ср., 1602 ср., 1587 сл., 1541 с., 1530 оч.с., 1485 ср., 1441 с., 1354 оч.с., 1233 оч.с., 1115 оч.с., 1026 с., 897 с., 835 ср., 775 ср., 746 с., 721 с., 692 с., 664 ср., 635 с., 557 ср., 527 с., 498 с., 489 ср., 418 ср.
Выход соединения 2 составил 85 %, т. разл. 143 ° С.
Для [Ph 3 P(CH 2 ) 2 OH][OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] ( 2 ) найдено (%): C 56,01; Н 4,26; для C 26 H 23 N 2 O 8 PS рассчитано (%): С 56,32; Н 4,15. ИК-спектр ( v , см - 1): 3100 ср., 1600 с., 1590 ср., 1534 с., 1437 с., 1356 с., 1261 с., 1115 с., 1056 ср., 1022 с., 997 ср., 897 ср., 855 ср., 833 ср., 739 с., 723 ср., 691 с., 563 ср., 530 ср., 495 ср., 488 cр., 435 сл., 416 сл.
Выход соединения 3 составил 84 %, т. пл. 163 ° С.
Для [Ph 3 PCH 2 OH][OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] ( 3 ) найдено (%): C 55,37; Н 4,10; для C 25 H 21 N 2 O 8 PS рассчитано (%): С 55,56; Н 3,89. ИК-спектр ( v , см - 1): 3101 ср., 1601 ср., 1589 ср., 1545 ср., 1531 с., 1481 ср., 1437 с., 1356 с., 1261 с., 1115 с., 1056 ср., 1022 с., 997 ср., 920 сл., 897 ср., 855 ср., 833 ср., 739 с., 723 ср., 691 с., 660 сл., 590 сл., 563 ср., 548 сл., 530 ср., 495 ср., 488 cр., 455 сл., 426 сл.
Выход соединения 4 составил 90 %, т. пл. 173 ° С.
Для [Ph 3 PCH 2 C(O)Me][OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] ( 4 ) найдено (%): C 57,04; Н 4,13; для C 27 H 23 N 2 O 8 PS рассчитано (%): С 57,24; Н 4,06. ИК-спектр ( v , см - 1): 3103 сл., 3086 сл., 2905 ср., 2884 ср., 1717 с., 1601 ср., 1587 ср., 1485 ср., 1437 с., 1368 с., 1362 с., 1289 с., 1156 сл., 1111 с., 1083 ср., 1026 с., 997 ср., 903 ср., 861 ср., 833 ср., 791 ср., 746 оч.с., 719 ср., 691 ср., 665 ср., 635 ср., 557 ср., 513 ср., 494 ср., 467 ср., 442 сл., 415 ср.
РСА проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo Ка-излучение, X = 0,71073 А, графитовый монохроматор) при 293(2) K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [23‒25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2175820 (1), № 2181163 (2), № 2153959 (3), № 2158374 (4); ; . Основные кристаллографические данные и результаты уточнения структур 1‒4 приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1‒4
|
Параметр |
1 |
2 |
3 |
4 |
|
Стехиометрическая формула |
C 27 H 23 N 2 O 7 PS |
C 26 H 23 N 2 O 8 PS |
C 25 H 21 N 2 O 8 PS |
C 27 H 23 N 2 O 8 PS |
|
М |
550,50 |
554,49 |
540,47 |
566,50 |
|
Сингония |
Триклинная |
Моноклинная |
Триклинная |
Триклинная |
|
Пространственная группа |
P –1 |
P 2 1 / с |
P –1 |
P –1 |
|
a , Å |
9,354(11), |
13,049(7), |
9,086(14), |
9,746(10), |
|
b , Å |
9,764(10), |
14,816(10), |
10,95(2), |
11,371(11), |
|
c, Å |
15,416(17) |
13,261(7) |
13,17(2) |
13,657(10) |
|
α, град. |
106,29(4), |
90,00, |
86,20(9), |
66,78(3), |
|
β, град. |
94,67(5), |
93,901(15), |
71,93(6), |
86,30(3), |
|
γ, град. |
97,98(6) |
90,00 |
89,51(11) |
74,46(5) |
Окончание табл. 1
|
Параметр |
1 |
2 |
3 |
4 |
|
V , Å3 |
1328(3) |
2558(2) |
1243(4) |
1339(2) |
|
Z |
2 |
4 |
2 |
2 |
|
ρ выч, г/см |
1,377 |
1,440 |
1,444 |
1,405 |
|
µ , мм–1 |
0,231 |
0,243 |
0,248 |
0,234 |
|
F (000) |
572,0 |
1152,0 |
560,0 |
588,0 |
|
Размер кристалла, мм |
0,45×0,3×0,09 |
0,42×0,19×0,17 |
0,47×0,22×0,17 |
0,47×0,13×0,13 |
|
Диапазон сбора данных по 2 θ , град. |
5,86–59,48 |
6,16‒56,82 |
6,04–56,66 |
6,1–56,8 |
|
Диапазон индексов |
–13 ≤ h ≤ 13, –13 ≤ k ≤ 13, –21 ≤ l ≤ 21 |
–17 ≤ h ≤ 17, –19 ≤ k ≤ 19, –15 ≤ l ≤ 17 |
–12 ≤ h ≤ 12, –14 ≤ k ≤ 14, –17 ≤ l ≤ 17 |
–12 ≤ h ≤ 12, –15 ≤ k ≤ 15, –18 ≤ l ≤ 18 |
|
Число измеренных рефлексов |
92232 |
63127 |
43680 |
47110 |
|
Чисто независимых рефлексов |
7492 |
6406 |
6134 |
6638 |
|
R int |
0,0903 |
0,0502 |
0,0350 |
0,0656 |
|
GOOF |
1,031 |
1,028 |
1,039 |
1,016 |
|
Число параметров |
343 |
344 |
337 |
353 |
|
R -факторы по I > 2 σ ( I ) |
R 1 = 0,0794, wR 2 = 0,2208 |
R 1 = 0,0516, wR 2 = 0,1290 |
R 1 = 0,0366, wR 2 = 0,0960 |
R 1 = 0,0481, wR 2 = 0,1144 |
|
R -факторы по всем рефлексам |
R 1 = 0,1051, wR 2 = 0,2423 |
R 1 = 0,0713, wR 2 = 0,1432 |
R 1 = 0,0463, wR 2 = 0,1030 |
R 1 = 0,0836, wR 2 = 0,1320 |
|
Остаточная электронная плотность (max/min), e/A3 |
1,54/–0,86 |
0,58/–0,54 |
0,46/–0,52 |
0,33/–0,41 |
Таблица 2
|
Связь \ |
d , Å 1 |
Угол 1 |
ω, град. |
|
1 |
|||
|
S1–O1 |
1,495(4) |
O1‒S1‒O2 |
110,7(4) |
|
S1–O2 |
1,363(4) |
O1‒S1‒C31 |
102,0(2) |
|
S1–O3 |
1,399(3) |
O2‒S1‒O3 |
119,9(3) |
|
S1–C31 |
1,802(3) |
O2‒S1‒C31 |
107,99(19) |
|
P1–C1 |
1,785(3) |
O3‒S1‒O1 |
108,3(2) |
|
P1–C21 |
1,791(3) |
O3‒S1‒C31 |
106,33(17) |
|
P1–C11 |
1,788(3) |
C1‒P1‒C21 |
107,20(14) |
|
P1–C7 |
1,768(3) |
C1‒P1‒C11 |
110,78(15) |
|
O6‒N2 |
1,210(4) |
C11‒P1‒C21 |
108,76(15) |
|
O5‒N1 |
1,152(5) |
C7‒P1‒C1 |
110,50(15) |
|
O7‒N2 |
1,209(3) |
C7‒P1‒C21 |
110,21(15) |
|
N2‒C34 |
1,469(4) |
C7‒P1‒C11 |
109,36(15) |
|
2 |
|||
|
S1–O2 |
1,4325(18) |
O2‒S1‒O3 |
113,47(13) |
|
S1–O3 |
1,4333(19) |
O2‒S1‒C31 |
104,27(10) |
|
S1–O1 |
1,431(2) |
O3‒S1‒C31 |
104,22(11) |
|
S1–C31 |
1,794(2) |
O1‒S1‒O2 |
113,31(12) |
|
P1–C11 |
1,794(2) |
O1‒S1‒O3 |
115,34(14) |
|
P1–C21 |
1,788(2) |
O1‒S1‒C31 |
104,67(10) |
|
P1–C1 |
1,798(2) |
C11‒P1‒C1 |
109,67(9) |
|
P1–C7 |
1,794(2) |
C21‒P1‒C11 |
108,02(9) |
|
O8‒C8 |
1,393(3) |
C21‒P1‒C1 |
108,88(9) |
|
N2‒O6 |
1,208(4) |
C7‒P1‒C21 |
112,16(9) |
Окончание табл. 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
N1‒O5 |
1,177(3) |
C7‒P1‒C11 |
105,54(9) |
|
O7‒N2 |
1,214(4) |
C7‒P1‒C1 |
112,42(9) |
|
3 |
|||
|
S1–O1 |
1,437(3) |
O1‒S1‒O3 |
114,22(13) |
|
S1–O3 |
1,441(2) |
O1‒S1‒O2 |
113,52(16) |
|
S1–O2 |
1,460(2) |
O1‒S1‒C31 |
104,13(15) |
|
S1–C31 |
1,807(3) |
O3‒S1‒O2 |
113,52(15) |
|
P1–C1 |
1,791(3) |
O3‒S1‒C31 |
105,51(14) |
|
P1–C11 |
1,800(4) |
O2‒S1‒C31 |
104,61(15) |
|
P1–C21 |
1,796(3) |
C11‒P1‒C1 |
110,03(12) |
|
P1–C7 |
1,830(3) |
C1‒P1‒C21 |
109,07(13) |
|
O8–C7 |
1,404(3) |
C1‒P1‒C7 |
108,94(11) |
|
O6–N2 |
1,222(3) |
C11‒P1‒C7 |
110,04(14) |
|
O4–N1 |
1,220(3) |
C21‒P1‒C11 |
110,24(15) |
|
O5–N1 |
1,221(3) |
C21‒P1‒C7 |
108,48(13) |
|
4 |
|||
|
S1–O2 |
1,429(2) |
O2‒S1‒O3 |
114,49(16) |
|
S1–O3 |
1,452(3) |
O2‒S1‒O4 |
114,49(15) |
|
S1–O4 |
1,429(2) |
O2‒S1‒C31 |
103,93(13) |
|
S1–C31 |
1,807(3) |
O3‒S1‒C31 |
104,22(14) |
|
P1–C1 |
1,789(2) |
O4‒S1‒O3 |
112,02(15) |
|
P1–C11 |
1,800(3) |
O4‒S1‒C31 |
106,42(13) |
|
P1–C21 |
1,792(2) |
C1‒P1‒C11 |
109,66(11) |
|
P1–C7 |
1,805(2) |
C1‒P1‒C21 |
108,95(10) |
|
O1–C8 |
1,208(3) |
C1‒P1‒C7 |
111,59(11) |
|
O7–N2 |
1,202(5) |
C11‒P1‒C7 |
106,04(10) |
|
O6–N1 |
1,219(4) |
C21‒P1‒C11 |
108,32(9) |
|
O8–N2 |
1,233(5) |
C21‒P1‒C7 |
112,19(11) |
Обсуждение результатов
Целевые 2,4-динитробензолсульфонаты алкилтрифенилфосфония были получены из бромидов алкилтрифенилфосфония и 2,4-динитробензолсульфоновой кислоты в воде.
[Ph 3 PAlk]Br + HOSO 2 C 6 H 3 [(NO 2 ) 2 -2,4] ⎯⎯⎯⎯-> [Ph 3 PAlk][OSO 2 C 6 H 3 [(NO 2 ) 2 -2,4] -HBr
Alk = C 3 H 5 - cyclo ( 1 ) , (CH 2 ) 2 OH ( 2 ), CH 2 OH ( 3 ), CH 2 С(O)Me ( 4 )
Медленное испарение воды приводило к образованию прозрачных кристаллов, хорошо растворимых в аренах, этаноле, хлороформе, четыреххлористом углероде и плохо ‒ в воде при комнатной температуре.
В ИК-спектрах комплексов 1 ‒ 4 присутствуют характерные полосы поглощения высокой интенсивности при 1223‒1192 см-1 и средней интенсивности при 1049‒1032 см-1, которые отвечают асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Интенсивные полосы поглощения в области 696‒689 см–1 соответствуют валентным колебаниям связи S‒O. Также содержатся характерные полосы валентных колебаний углеродного скелета ароматических фрагментов при 1603‒1483 см–1. Валентным колебаниям связей CAr‒S и CAr‒P отвечают интенсивные полосы в области 600‒597 см‒1 и 760‒716 см–1 соответственно [26]. Cпектры соединения 1 - 4 содержат по две интенсивных полосы валентных колебаний группы NO2 при ∼ 1500 и ∼ 1350 см–1.
По данным рентгеноструктурного анализа, кристаллы соединений 1 ‒ 4 образованы катионами алкилтрифенилфосфония и 2,4-динитробензолсульфонатными анионами (рис. 1‒4).
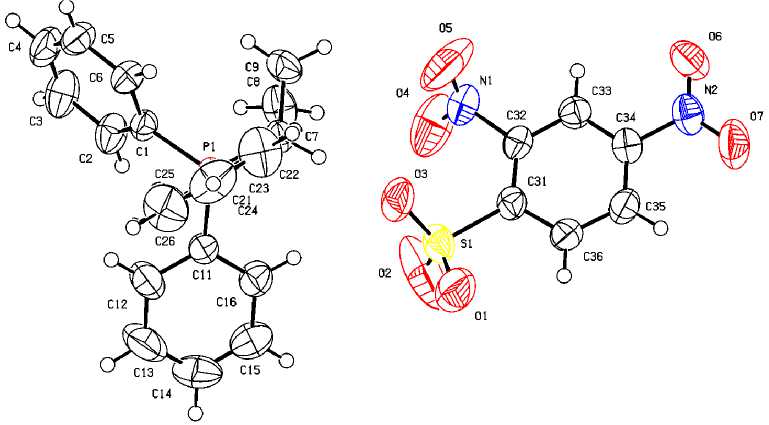
Рис. 1. Общий вид комплекса 1
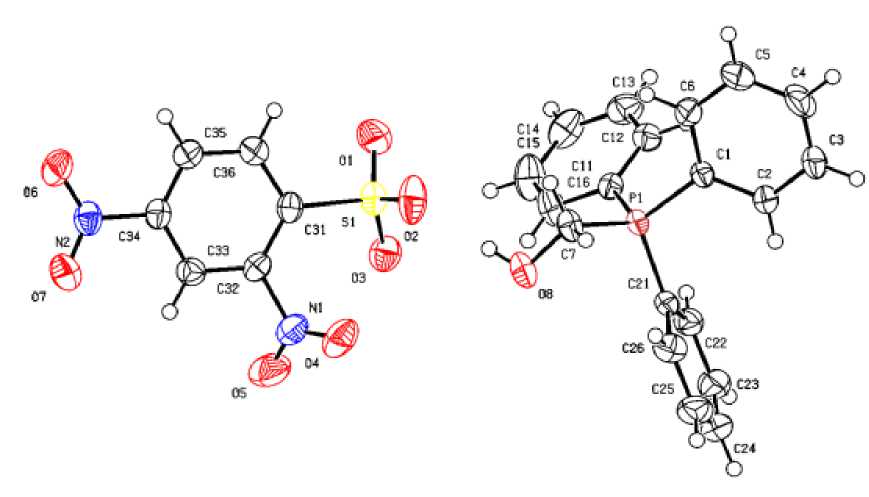
Рис. 2. Общий вид комплекса 2
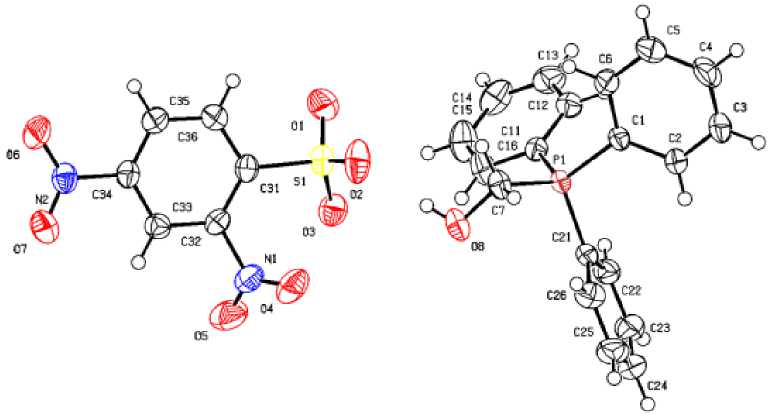
Рис. 3. Общий вид комплекса 3
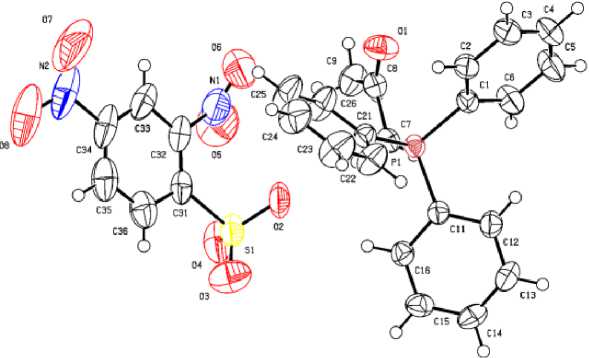
Рис. 4. Общий вид комплекса 4
Катионы алкилтрифенилфосфония в 1 ‒ 4 имеют незначительно искаженную тетраэдрическую конфигурацию. Длины связей Р-С принимают значения 1,768(3)-1.815(2) Å [1,768(3)-1,791(3) Å ( 1 ); 1,788(2)–1,798(2) Å ( 2 ); 1,791(3)–1,830(3) Å ( 3 ); 1,789(2)–1,805(3) Å ( 4 )], что меньше суммы ковалентных радиусов атомов-партнеров (1,83 Å) [28]. Валентные углы СРС изменяются в интервалах: 107,20(14)-110,78(15)° ( 1 ); 105,54(9)-112,42(9)° ( 2 ); 108,48(13)-110,24(15)° ( 3 );
106,04(10)-112,19(11)° ( 4 ). В 2,4-динитробензолсульфонатных анионах расстояния S-C близки между собой и принимают значения 1,794(2)-1,807(3) Å. Связи S‒О в 1 (1,363(4)‒1,495(4) Å), 2 (1,431(2)‒1,4333(19) Å), 3 (1,437(3)‒1,460(2) Å) и 4 (1,429(2)‒1,452(3) Å) практически выровнены, что указывает на равномерное распределение электронной плотности в SO3‒ группах. Валентные углы OSC (102,29(10)°-107,99(19)°) меньше, чем углы OSO (110,7(4)°-119,9(3)°), что соответствует теории отталкивания электронных пар валентных оболочек [29]. Кристаллы 1 ‒ 4 отличаются упаковкой анионов. В кристаллах катионы и анионы связаны между собой межмолекулярными водородными связями О∙∙∙Н, образованными атомами кислорода нитро-, сульфогрупп и атомами водорода Ph 3 PR-групп (2,3 - 2,7 Å для 1 ; 2,3 - 2,6 Å для 2 ; 2,4 - 2,7 Å для 3 и 2,2 - 2,9 Å для 4 ).
Выводы
Установлено, что реакции бромидов алкилтрифенилфосфония с 2,4-динитробензолсульфоновой кислотой в воде приводят к образованию 2,4-динитробензолсульфонатов алкилтрифенилфосфония, состоящих из тетраэдрических алкилтрифенилфосфониевых катионов и 2,4-динитробензолсульфонатных анионов.
Список литературы Исследование кристаллических структур 2,4-динитробензолсульфонатов алкилтрифенилфосфония [Ph3PAlk][ OSO2C6H3(NO2)2-2,4], Alk = C3H5-cyclo, (CH2)2OH, CH2OH, CH2С(O)Me
- Hartley F.R. The Chemistry of Organophosphorus Compounds: Phosphonium Salts, Ylides and Phosphoranes, Volume 3. John Wiley & Sons, Ltd., 1993.
- Wang D., Astruc D. // Chem. Rev. 2015. V. 115. P. 6621. DOI: 10.1021/acs.chemrev.5b00203.
- Cordovilla C., Bartolome C., Martinez-Ilarduya J.M., Espinet P. // ACS Catal. 2015. V. 5. P. 3040. DOI: 10.1021/acscatal.5b00448.
- Chong C.C., Hirao H., Kinjo R. // Angew. Chem. Int. Ed. 2015. V. 127. P. 192. DOI: 10.1002/ange.201408760.
- Razuvaev G.A., Osanova N.A., Brilkina T.G., Zinovjeva T.I., Sharutin V.V. // J. Organomet. Chem. 1975. V. 99. P. 93. DOI: 10.1016/S0022-328X(00)86365-2.
- Barton D., Ollis W.D. Comprehensive Organic Chemistry. V. 2 Phosphorus Compounds. Oxford, UK: Pergamon, 1979.
- Milenkovic M., Warzajtis B., Rychlewska U. et al. // Molecules. 2012. V. 17. P. 2567. DOI: 10.3390/molecules17032567.
- Pavlova J.A., Khairullina Z.Z., Tereshchenkov A.G. et al. // Antibiotics. 2021. V. 10. P. 489. DOI: 10.3390/antibiotics 10050489.
- Tsepaeva O.V., Salikhova T.I., Grigor'eva L.R. et al. // Med. Chem. Res. 2021. V. 30. P. 925. DOI: 10.1007/s00044-020-02674-6.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Boyarkina E.A. // Russ. J. Gen. Chem. 2009. V. 79. P. 78. DOI: 10.1134/S1070363209010125.
- Sharutin V.V., Sharutina O.K., Rybakova A.V., Gubanova Yu.O. // Russ. J. Gen. Chem. 2018. V. 88. P. 1629. DOI: 10.1134/S1070363218080133.
- Sharutin V.V., Mukusheva N., Urzhumova A.V. // Bull. South Ural State Univ., Ser. Chem. 2018. V. 10, No. 2. P. 48. (In Russ.). DOI: 10.14529/chem180206.
- Sharutin V.V., Sharutina O.K., Gubanova Yu.O. // Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol. 2019. V. 62. P. 4. DOI: 10.6060/ivkkt.20196202.5823.
- Sodano F., Rolando B., Spyrakis F. et al. // ChemMedChem. 2018. V. 13. P. 1238. DOI: 10.1002/cmdc.201800088
- Mironov V.F., Nemtarev A.V., Tsepaeva O.V. et al. // Molecules. 2021. V. 26. P. 6350. DOI: 10.3390/molecules2621635.
- Khasiyatullina N.R., Gubaidullin A.T., Shinkareva A.M. et al. // Russ. Chem. Bull., Int. Ed., 2020. V. 69. P. 2140. DOI: 10.1007/s11172-020-3012-3.
- Romanov S., Aksunova A., Bakhtiyarova Y. et al. // J. Organomet. Chem. 2020. V. 910. P. 121130. DOI: 10.1016/j.jorganchem.2020.121130.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14. № 2. С. 41. DOI: 10.14529/chem220205
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. общ. химии. 2022. Т. 92, № 6. С. 885. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. структ. химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 31. DOI: 10.14529/chem230103.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. C. 55. DOI: 10.14529/chem230204
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Васильев А.В., Гриненко Е.В., Щукин A.O. и др. Инфракрасная спектроскопия органических и природных соединений. СПб: СПбФТУ, 2007. 54 с.
- Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. DOI: 10.1039/B801115J.
- Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул. М.: Мир. 1992. С.75.

![Исследование кристаллических структур 2,4-динитробензолсульфонатов алкилтрифенилфосфония [Ph3PAlk][ OSO2C6H3(NO2)2-2,4], Alk = C3H5-cyclo, (CH2)2OH, CH2OH, CH2С(O)Me Исследование кристаллических структур 2,4-динитробензолсульфонатов алкилтрифенилфосфония [Ph3PAlk][ OSO2C6H3(NO2)2-2,4], Alk = C3H5-cyclo, (CH2)2OH, CH2OH, CH2С(O)Me](/file/cover/147246065/issledovanie-kristallicheskih-struktur-24-dinitrobenzolsulfonatov.png)
