Исследование кристаллических структур 7-иод-8-оксихинолин-5-сульфонатов алкилтрифенилфосфония [Ph3PAlk][OSO2C9NH4(I-7)(OH-8)], Alk = CH2Ph, CH=CHMe, CH2C≡CH
Автор: Шарутин В.В., Шарутина О.К., Механошина Е.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
Из бромидов алкилтрифенилфосфония и 7-иод-8-оксихинолин-5-сульфоновой кислоты в воде получены и структурно охарактеризованы ионные 7-иод-8-оксихинолин-5-сульфонаты алкилтрифенилфосфония [Ph3PAlk][OSO2C9NH4(I-7)(OH-8)], Alk = CH2Ph (1), CH=CHMe (2), CH2C≡CH (3). Кристаллы 1 [C34H27NO4PSI, M 703,50; сингония моноклинная, группа симметрии P21/c; параметры ячейки: a = 8,805(4), b = 16,146(10), c = 20,833(11) Å; β = 93,410(17), V = 2956(3) Å3, Z = 4; rвыч = 1,581 г/см3], 2 [C30H25NO4PSI, M 653,44; сингония ромбическая, группа симметрии P212121; параметры ячейки: a = 9,382(3), b = 14,033(4), c = 21,035(6) Å; a = β = g = 90,00 град., V = 2769,5(15) Å3, Z = 4; rвыч = 1,567 г/см3], 3 [C30H27NO6PSI, M 687,46; сингония моноклинная, группа симметрии P21/n; параметры ячейки: a = 9,426(3), b = 19,239(5), c = 16,088(5) Å; β = 97,296(14) град., V = 2894,0(15) Å3, Z = 4; rвыч = 1,578 г/см3]. По данным РСА, атомы фосфора в катионах 1-3 имеют искаженную тетраэдрическую координацию, сульфонатные анионы обладают обычной геометрией с тетраэдрическим атомом серы. Длины связей Р-С изменяются в интервале 1,772(3)-1,815(2) Å; валентные углы СРС принимают значения 106,08(11)°-112,33(11)°. В аренсульфонатных анионах комплексов расстояния S-C близки между собой [1,781(2)-1,7920(19) Å], связи S-О практически выравнены [1,4464(16)-1,4590(17) Å]. В кристалле гидрата 3 [Ph3PCH2C≡CH][OSO2C9NH4(I-7)(OH-8)] ∙ 2H2O молекулы воды участвуют в образовании димерного аниона (расстояния O∙∙∙H и N∙∙∙H составляют 1,93 и 2,03 Å, при этом ареновые кольца сульфонатных лигандов почти параллельны (угол между ними равен 3,24°)). Другие молекулы воды связывают димерные анионы в цепочку водородными связями (расстояния O∙∙∙H 2,12 и 2,15 Å). Структурная организация в комплексах 1-3 в основном обусловлена слабыми межмолекулярными контактами типа O···Н 2,04-2,69 Å (1), 2,05-2,69 Å (2), 2,12-2,15 Å (3).
7-иод-8-оксихинолин-5-сульфоновая кислота, бромид алкилтрифенилфосфония, 7-иод-8-оксихинолин-5-сульфонат алкилтрифенилфосфония, синтез, молекулярная структура, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147244639
IDR: 147244639 | УДК: 546.185+547.53.024+547.21.024+ | DOI: 10.14529/chem240209
Текст научной статьи Исследование кристаллических структур 7-иод-8-оксихинолин-5-сульфонатов алкилтрифенилфосфония [Ph3PAlk][OSO2C9NH4(I-7)(OH-8)], Alk = CH2Ph, CH=CHMe, CH2C≡CH
Фосфорорганические соединения обладают уникальными свойствами и находят применение в различных сферах практической деятельности: в качестве пластификаторов, дефолиантов, фунгицидов, гербицидов, инсектицидов, антипиренов, присадок к бензинам и смазочным маслам [1]. Органические соединения фосфора также являются катализаторами гидрофункционализации непредельных субстратов [2], реагентами для транс-металлирования [3], метатезиса σ-связей [4], для получения элементоорганических соединений [5] и олефинов [6]. Четвертичные фосфониевые соли обладают высокой биологической активностью и применяются в качестве противоопухолевых и антимикробных соединений [7‒9]. Простейшие производные тетраорганилфосфония можно синтезировать по реакции пентафенилфосфора с кислотами [10‒13], окислительного присоединения из трифенилфосфина и органилгалогенида [14, 15] или ненасыщенных соединений с последующей обработкой HCl или HBr [16, 17]. В работах [18‒22] обсуждались структурные характеристики ряда аренсульфонатов тетраорганилфосфония. Для синтеза данных комплексов смеси аренсульфоновой кислоты и галогенидов тетраорганилфосфония выдерживали при нагревании в различных растворителях (ДМФА, бензоле, метаноле, диэтиловом эфире, ацетоне, ТГФ, ацетонитриле); выходы продуктов при этом не превышали 78 %. Разработка методов получения фосфониевых солей, содержащих в лигандах при атоме фосфора различные функциональные группы с анионами сложного строения, является на сегодняшний день одним из перспективных направлений в элементорганической химии.
В настоящей работе впервые синтезированы и структурно охарактеризованы 7-иод-8-оксихинолин-5-сульфононаты алкилтрифенилфосфония [Ph 3 PAlk][OSO 2 C 9 NH 4 (I-7)(OH-8)],
Alk = CH 2 Ph ( 1 ), CH=CHMe ( 2 ), CH 2 C≡CH ( 3 ).
Экспериментальная часть
ИК-спектры соединений 1 ‒ 3 записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000 - 400 см - 1.
Элементный анализ выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
Общая процедура синтеза. В работе использовали бромиды алкилтрифенилфосфония производства фирмы Alfa Aesar. Для синтеза 7-иод-8-оксихинолин-5-сульфононата бензилтрифенилфосфония ( 1 ) раствор бромида бензилтрифенилфосфония (0,11 г, 0,25 ммоль) в 8 мл воды смешивали с 8 мл водного раствора 7-иод-8оксихинолин-5-сульфоновой кислоты (0,09 г, 0,25 ммоль). При медленном испарении растворителя выделялись бесцветные кристаллы, которые сушили на воздухе.
Выход соединения 1 составил 93 %, т. пл. 210 ° С.
Для [Ph 3 PCH 2 Ph][OSO 2 C 9 NH 4 (OH-8)(I-7)] 1 найдено (%): C 58,79; Н 3,92, для C 34 H 27 INO 4 PS рассчитано (%): С 58,00; Н 3,84.
ИК-спектр ( v , см - 1): 3173 сл., 3088 сл., 3059 сл., 3028 сл., 2889 ср., 2801 сл., 1603 сл., 1585 ср., 1560 ср., 1483 оч. с., 1456 сл., 1439 оч. с., 1412 ср., 1395 ср., 1371 ср., 1317 ср., 1261 ср., 1227 с., 1209 с., 1165 с., 1144 ср., 1111 с., 1043 с., 1032 с., 995 ср., 951 ср., 910 ср., 839 ср., 820 ср., 789 ср., 760 c., 743 ср., 696 с., 658 ср., 600 с., 584 ср., 536 ср., 514 ср., 496 с., 444 ср.
Соединения 2 , 3 синтезировали аналогично из бромидов алкилтрифенилфосфония.
Выход соединения 2 составил 85 %, т. разл. 183 ° С.
Для [Ph 3 PCH=CHMe][OSO 2 C 9 NH 4 (I-7)(OH-8)] ( 2 ) найдено (%): C 55,00; Н 3,91; для
C 30 H 25 NO 4 PSI рассчитано (%): С 55,09; Н 3,83.
ИК-спектр ( v , см - 1): 3096 сл., 3053 сл., 3003 сл., 1609 ср., 1584 ср., 1560 ср., 1485 с., 1439 с., 1387 ср., 1369 ср., 1310 ср., 1217 с., 1144 ср., 1111 с., 1049 с., 1036 с., 995 ср., 951 ср., 922 сл., 849 ср., 814 с., 793 с., 754 ср., 741 ср., 727 ср., 710 с., 692 с., 656 ср., 598 оч.с., 536 с., 519 ср., 505 сл., 422 сл.
Выход соединения 3 составил 84 %, т. пл. 106 ° С.
Для [Ph 3 PCH 2 C≡CH][OSO 2 C 9 NH 4 (I-7)(OH-8)] ∙ 2H 2 O ( 3 ) найдено (%): 52,17; Н 4,08;
для C 30 H 27 NO 6 PSI рассчитано (%): С 52,37; Н 3,93.
ИК-спектр ( v , см - 1): 3356 сл., 3240 ср., 2916 ср., 2882 ср., 1630 с., 1585 с., 1489 оч. с., 1439 оч. с., 1391 с., 1315 с., 1223 с., 1192 с., 1175 с., 1144 ср., 1113 оч. с., 1038 оч. с., 995 ср., 955 ср., 816 ср., 791 ср., 743 ср., 716 с., 689 с., 658 ср., 602 с., 542 с., 492 ср., 422 сл.
РСА проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo Ка-излучение, X = 0,71073 А, графитовый монохроматор) при 293(2) K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC и OLEX2 [23‒25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2179617 (1), № 2180452 (2), № 2180450 (3); ; . Основные кристаллографические данные и результаты уточнения структур 1‒3 приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
|
Параметр |
1 |
2 |
3 |
|
Стехиометрическая формула |
C 34 H 27 NO 4 PSI |
C 30 H 25 NO 4 PSI |
C 30 H 27 NO 6 PSI |
|
М |
703,50 |
653,44 |
687,46 |
|
Сингония |
Моноклинная |
Ромбическая |
Моноклинная |
|
Пространственная группа |
P2 1 /c |
P2 1 2 1 2 1 |
P2 1 /n |
|
a , b , c, Å |
8,805(4), 16,146(10), 20,833(11) |
9,382(3), 14,033(4), 21,035(6) |
9,426(3), 19,239(5), 16,088(5) |
|
α, β, γ, град. |
90,00, 93,410(17), 90,00 |
90,00, 90,00, 90,00 |
90,00, 97,296(14), 90,00 |
|
V , Å3 |
2956(3) |
2769,5(15) |
2894,0(15) |
|
Z |
4 |
4 |
4 |
|
ρ выч , г/см3 |
1,581 |
1,567 |
1,578 |
|
µ, мм–1 |
1,249 |
1,326 |
1,278 |
|
F (000) |
1416,0 |
1312,0 |
1384,0 |
|
Размер кристалла, мм |
0,41 × 0,39 × 0,21 |
0,42 × 0,24 × 0,12 |
0,21 × 0,17 × 0,1 |
|
Диапазон сбора данных по 2θ, град. |
5,72–63,22 |
5,58‒65,36 |
6,08–68,8 |
|
Диапазон индексов |
–10 ≤ h ≤ 12, –23 ≤ k ≤ 23, –30 ≤ l ≤ 30 |
–14 ≤ h ≤ 14, –18 ≤ k ≤ 21, –31 ≤ l ≤ 31 |
–14 ≤ h ≤ 14, –30 ≤ k ≤ 30, –25 ≤ l ≤ 25 |
|
Число измеренных рефлексов |
87415 |
51810 |
86548 |
|
Число независимых рефлексов |
9819 |
10124 |
12131 |
|
R int |
0,0349 |
0,0377 |
0,0398 |
|
GOOF |
1,031 |
1,077 |
1,039 |
|
Метод уточнения |
Полноматричный МНК по F 2 |
Полноматричный МНК по F 2 |
Полноматричный МНК по F 2 |
|
Число параметров |
380 |
347 |
368 |
|
R -факторы по I > 2σ( I ) |
R 1 = 0,0387, wR 2 = 0,0828 |
R 1 = 0,0425, wR 2 = 0,0736 |
R 1 = 0,0462, wR 2 = 0,0882 |
|
R -факторы по всем рефлексам |
R 1 = 0,0625, wR 2 = 0,0925 |
R 1 = 0,0659 wR 2 = 0,0791 |
R 1 = 0,0852, wR 2 = 0,0998 |
|
Остаточная электронная плотность (max/min), e/A3 |
1,18/–1,59 |
0,82/–1,03 |
0,99/–1,53 |
Таблица 2
|
Связь \ |
d , Å 1 |
Угол 1 |
ω, град. |
|
1 |
|||
|
S1–O1 |
1,4483(17) |
O1‒S1‒O2 |
112,99(12) |
|
S1–O2 |
1,4555(17) |
O1‒S1‒O3 |
113,85(10) |
|
S1–O3 |
1,4590(17) |
O1‒S1‒C41 |
106,41(9) |
|
S1–C41 |
1,7920(19) |
O2‒S1‒O3 |
112,85(11) |
|
P1–C11 |
1,798(2) |
O2‒S1‒C41 |
105,43(9) |
|
P1–C37 |
1,805(2) |
O3‒S1‒C41 |
104,29(10) |
|
P1–C21 |
1,797(2) |
C11‒P1‒C37 |
106,08(11) |
|
P1–C1 |
1,802(2) |
C11‒P1‒C1 |
110,44(11) |
|
O4‒C44 |
1,344(2) |
C21‒P1‒C11 |
109,66(11) |
|
I1‒C43 |
2,094(2) |
C21‒P1‒C37 |
111,20(11) |
|
N1‒C46 |
1,316(3) |
C21‒P1‒C1 |
107,15(10) |
|
N1‒C45 |
1,359(3) |
C1‒P1‒C37 |
112,33(11) |
Окончание табл. 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
2 |
|||
|
S1–O1 |
1,448(2) |
O1‒S1‒O2 |
112,56(14) |
|
S1–O2 |
1,454(2) |
O1‒S1‒C31 |
104,81(12) |
|
S1–O3 |
1,447(2) |
O2‒S1‒C31 |
105,78(12) |
|
S1–C31 |
1,781(2) |
O3‒S1‒O1 |
112,67(13) |
|
P1–C11 |
1,791(3) |
O3‒S1‒O2 |
114,13(14) |
|
P1–C1 |
1,792(3) |
O3‒S1‒C31 |
105,93(13) |
|
P1–C21 |
1,781(3) |
C11‒P1‒C1 |
106,56(13) |
|
P1–C7 |
1,772(3) |
C21‒P1‒C11 |
111,29(15) |
|
O4‒C34 |
1,337(3) |
C21‒P1‒C1 |
109,63(16) |
|
N1‒C35 |
1,354(4) |
C7‒P1‒C11 |
108,96(15) |
|
N1‒C39 |
1,307(4) |
C7‒P1‒C1 |
111,02(16) |
|
I1‒C33 |
2,095(2) |
C7‒P1‒C21 |
109,36(16) |
|
3 |
|||
|
S1–O2 |
1,4477(16) |
O2‒S1‒O1 |
112,36(11) |
|
S1–O1 |
1,4584(17) |
O2‒S1‒C31 |
105,76(9) |
|
S1–O3 |
1,4464(16) |
O1‒S1‒C31 |
106,12(9) |
|
S1–C31 |
1,7824(18) |
O3‒S1‒O2 |
113,60(11) |
|
P1–C11 |
1,786(2) |
O3‒S1‒O1 |
111,97(11) |
|
P1–C1 |
1,797(2) |
O3‒S1‒C31 |
106,34(9) |
|
P1–C21 |
1,788(2) |
C11‒P1‒C1 |
110,44(10) |
|
P1–C7 |
1,815(2) |
C11‒P1‒C21 |
108,74(10) |
|
O4–C37 |
1,346(2) |
C11‒P1‒C7 |
107,47(10) |
|
N1–C35 |
1,321(3) |
C1‒P1‒C7 |
109,50(10) |
|
N1–C36 |
1,369(3) |
C21‒P1‒C1 |
111,17(9) |
|
I1–C38 |
2,092(2) |
C21‒P1‒C7 |
109,46(10) |
Обсуждение результатов
Целевые 7-иод-8-оксихинолин-5-сульфононаты алкилтрифенилфосфония были получены из бромидов алкилтрифенилфосфония и аренсульфоновой кислоты в воде.
[Ph3PAlk]Br + HOSO2C9NH4(I-7)(OH-8)----- * [Ph3PAlk][OSO2C9NH4(I-7)(OH-8)]
-HBr
Alk = CH 2 Ph ( 1 ), CH=CHMe ( 2 ), CH 2 C≡CH ( 3 )
Медленное испарение воды приводило к образованию прозрачных кристаллов, хорошо растворимых в аренах, ацетонитриле, этаноле, хлороформе, четыреххлористом углероде и плохо ‒ в воде при комнатной температуре.
В ИК-спектрах комплексов 1 ‒ 3 присутствуют характерные полосы поглощения высокой интенсивности при 1223‒1192 см-1 и средней интенсивности при 1049‒1032 см-1, которые отвечают асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Интенсивные полосы поглощения в области 696‒689 см–1 соответствуют валентным колебаниям связи S‒O. Также содержатся характерные полосы валентных колебаний углеродного скелета ароматических фрагментов при 1603‒1483 см–1. Валентным колебаниям связей C Ar - H принадлежат полосы при 3088‒3028 см–1; плоскостным деформационным колебаниям этих же связей ‒ полосы при 1165‒1031 см–1, внеплоскостным деформационным колебаниям – при 910‒849 см–1. Валентным колебаниям связей C Ar ‒S и C Ar ‒P отвечают интенсивные полосы в области 600‒597 см‒1 и 760‒716 см–1 соответственно [26]. Спектры соединения 1 - 3 содержат полосу валентных колебаний связи C - I в оксихинолиновом фрагменте в области 496‒602 см–1. Неплоским деформационным колебаниям связей C‒H ароматических фрагментов принадлежат полосы при 995‒906 см–1 [27]. Синглет средней интенсивности при 2882 см–1 в ИК-спектре подтверждает присутствие тройной связи в комплексе 3 , широкая полоса при 3356 см–1 свидетельствует о наличии в комплексе сольватных молекул воды.
По данным рентгеноструктурного анализа, кристаллы соединений 1 ‒ 3 образованы катионами алкилтрифенилфосфония и 7-иод-8-оксихинолин-5-сульфонатными анионами (рис. 1‒3).
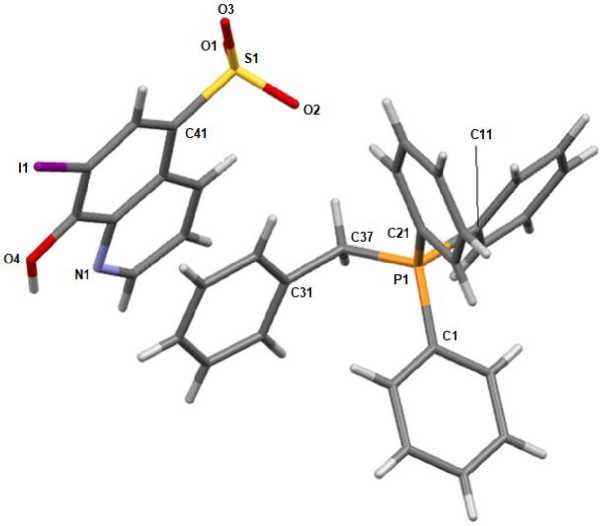
Рис. 1. Общий вид комплекса 1
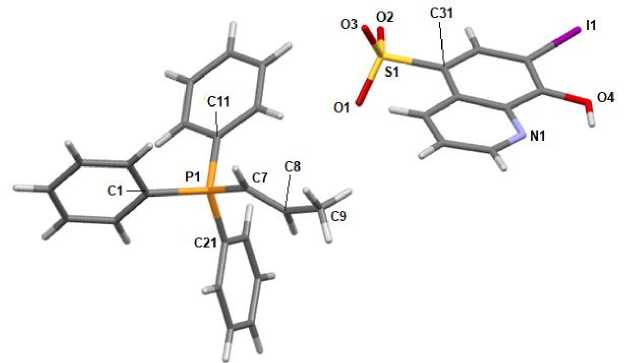
Рис. 2. Общий вид комплекса 2
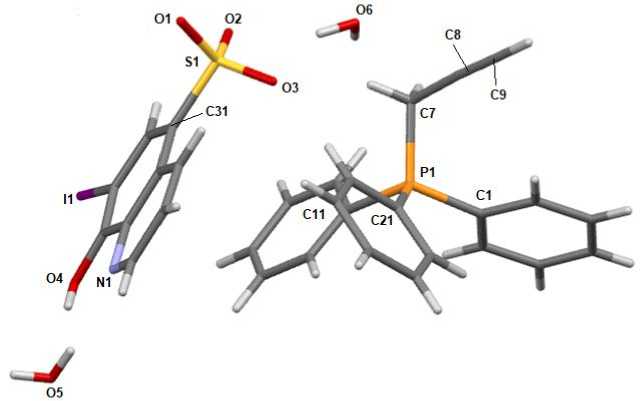
Рис. 3. Общий вид гидрата комплекса 3
Катионы алкилтрифенилфосфония в 1 - 3 имеют незначительно искаженную тетраэдрическую конфигурацию. Длины связей Р-С принимают значения 1,772(3)-1,815(2) А [1,797(2)-1,805(2) А ( 1 ); 1,772(3)-1,792(3) А ( 2 ); 1,786(2)-1,815(2) А ( 3 )], что меньше суммы ковалентных радиусов атомов-партнеров (1,83 А) [28]. Валентные углы СРС изменяются в интервалах: 106,08(11)-112,33(11)° ( 1 ); 106,56(13)-111,29(15)° ( 2 ); 07,47(10)-111,17(9)° ( 3 ). В 7-иод-8-оксихинолин-5-сульфонатных анионах расстояния S-C близки между собой и принимают значения 1,781(2)-1,7920(19) А. Связи S-О в 1 - 3 практически выравнены (1,4483(17)-1,4590(17) А, 1,447(2)-1,454(2) А и 1,4464(16)-1,4584(17) А соответственно), что указывает на равномерное распределение электронной плотности в SO3- группах. Валентные углы OSC (104,29(10)-106,41(9)°) меньше, чем углы OSO (111,97(11)-114,13(14)°), что соответствует теории отталкивания электронных пар валентных оболочек [29].
Кристаллы 1 - 3 отличаются упаковкой анионов. В 1 анионы связаны межмолекулярными водородными связями, образованными гидроксильными и сульфогруппами (О3--Н4А - О4: 2,04 А, О3-Ю4: 2,75 А), в цепочки, ориентированными вдоль кристаллографической оси а (рис. 4), между которыми расположены катионы (имеют место множественные короткие контакты между катионами и анионами типа □•••Н - САг 2,28 - 2,67 А).
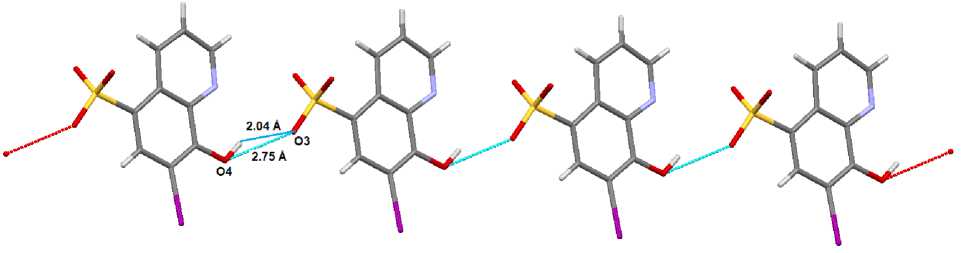
Рис. 4. Цепочка анионов в кристалле 1
В кристалле 2 аналогичные цепочки анионов (водородные связи имеют параметры О2--Н4А - О4: 2,05 А, О2---О4: 2,73 А) образуют зигзагообразные поверхности, формируемые короткими контактами O3---I1 (3,063 А) (рис. 5), между которыми располагаются катионы (короткие контакты между катионами и анионами типа □•••H - C 2,34 - 2,70 А) .
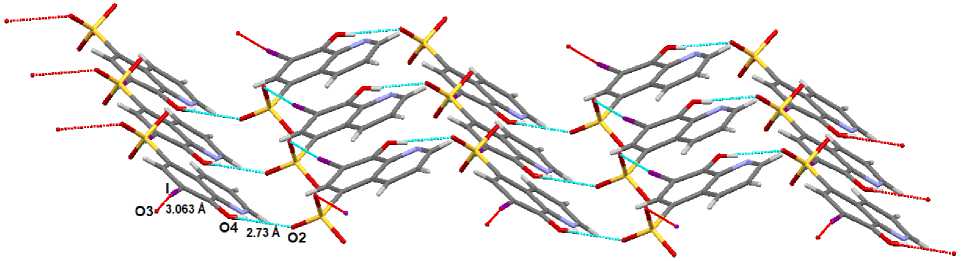
Рис. 5. Расположение анионов в кристалле 2
В кристалле гидрата 3 структурная организация, которая формируется с участием молекул воды, более сложная. Анионы связаны системой водородных связей О2∙∙∙Н - О6 (расстояние О2---О6 2,98 А), О6--Н - О5 (расстояние О6---О5 2,95 А), О5 - Н--О1 (расстояние О5---О1 2,76 А), образуя циклы, включающие молекулы воды (рис. 6).
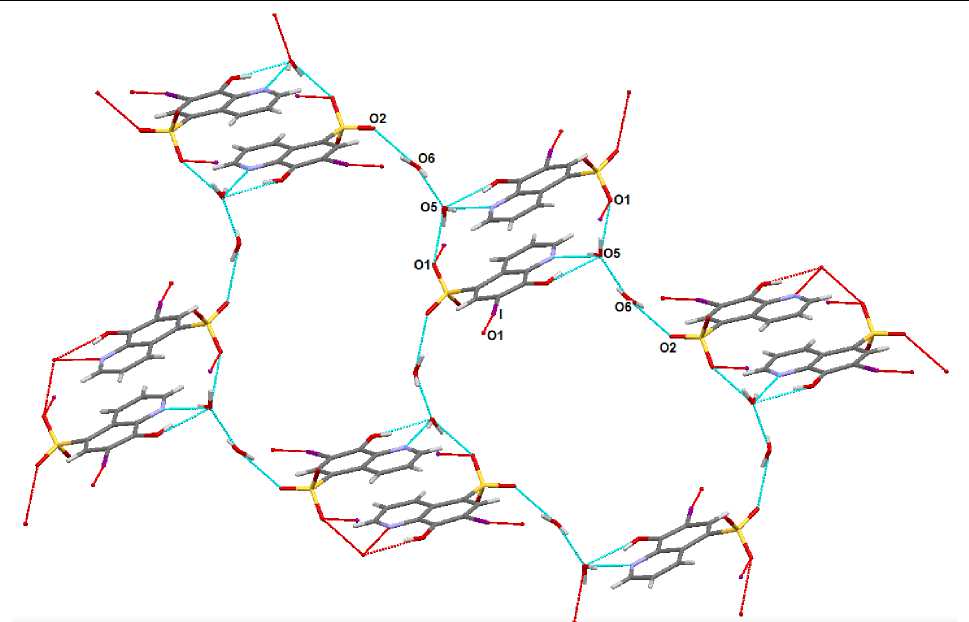
Рис. 6. Система водородных связей, объединяющих анионы в кристалле 3
В полостях, образованных анионами, располагаются катионы (рис. 7).
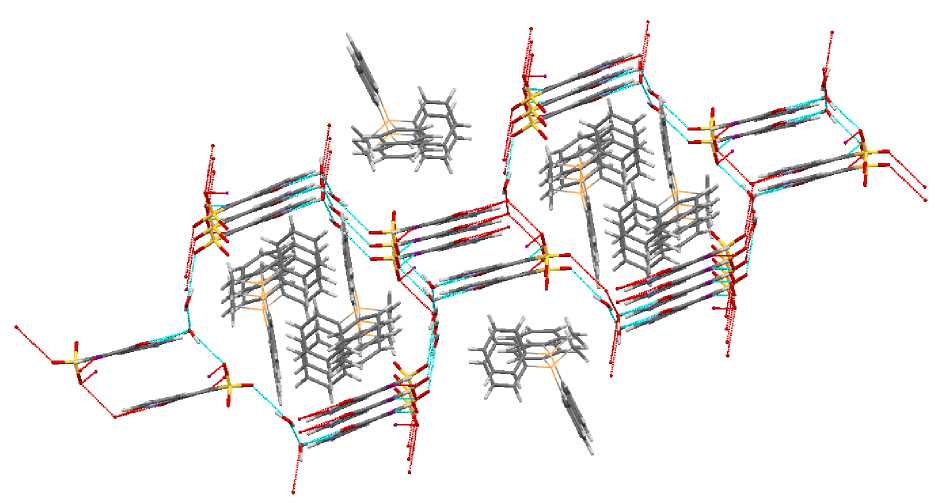
Рис. 7. Расположение катионов и анионов в кристалле 3
Выводы
Установлено, что реакции бромидов алкилтрифенилфосфония с 7-иод-8-оксихинолин-5-сульфоновой кислотой в воде приводят к образованию 7-иод-8-оксихинолин-5-сульфонатов алкилтрифенилфосфония, состоящих из тетраэдрических алкилтрифенилфосфониевых катионов и 7-иод-8-оксихинолин-5-сульфонатных анионов.
Список литературы Исследование кристаллических структур 7-иод-8-оксихинолин-5-сульфонатов алкилтрифенилфосфония [Ph3PAlk][OSO2C9NH4(I-7)(OH-8)], Alk = CH2Ph, CH=CHMe, CH2C≡CH
- Hartley F.R. The Chemistry of Organophosphorus Compounds: Phosphonium Salts, Ylides and Phosphoranes, Vol. 3. John Wiley & Sons, Ltd., 1993.
- Wang D., Astruc D. // Chem. Rev. 2015. V. 115. P. 6621. DOI: 10.1021/acs.chemrev.5b00203.
- Cordovilla C., Bartolome C., Martinez-Ilarduya J.M., Espinet P. // ACS Catal. 2015. V. 5. P. 3040. DOI: 10.1021/acscatal.5b00448.
- Chong C.C., Hirao H., Kinjo R. // Angew. Chem. Int. Ed. 2015. V. 127. P. 192. DOI: 10.1002/ange.201408760.
- Razuvaev G.A., Osanova N.A., Brilkina T.G., Zinovjeva T.I., Sharutin V.V. // J. Organomet. Chem. 1975. V. 99. P. 93. DOI: 10.1016/S0022-328X(00)86365-2.
- Barton D., Ollis W.D. Comprehensive Organic Chemistry. Vol. 2 Phosphorus Compounds. Oxford, UK: Pergamon, 1979.
- Milenkovic M., Warzajtis B., Rychlewska U. et al. // Molecules. 2012. V. 17. P. 2567. DOI: 10.3390/molecules17032567.
- Pavlova J.A., Khairullina Z.Z., Tereshchenkov A.G. et al. // Antibiotics. 2021. V. 10. P. 489. DOI: 10.3390/antibiotics10050489.
- Tsepaeva O.V., Salikhova T.I., Grigor’eva L.R. et al. // Med. Chem. Res. 2021. V. 30. P. 925. DOI: 10.1007/s00044-020-02674-6.
- Sharutin V.V., Senchurin V.S., Sharutina O.K., Boyarkina E.A. // Russ. J. Gen. Chem. 2009. V. 79. P. 78. DOI: 10.1134/S1070363209010125.
- Sharutin V.V., Sharutina O.K., Rybakova A.V., Gubanova Yu.O. // Russ. J. Gen. Chem. 2018. V. 88. P. 1629. DOI: 10.1134/S1070363218080133.
- Шарутин В.В., Мукушева Н., Уржумова А.В. // Вестник Южно-Уральского государственного университета. Серия: Химия. 2018. Т. 10, № 2. С. 48. DOI: 10.14529/chem180206.
- Sharutin V.V., Sharutina O.K., Gubanova Yu.O. // Izv. Vyssh. Uchebn. Zaved. Khim. Khim. Tekhnol. 2019. V. 62. P. 4. DOI: 10.6060/ivkkt.20196202.5823.
- Sodano F., Rolando B., Spyrakis F. et al. // ChemMedChem. 2018. V. 13. P. 1238. DOI: 10.1002/cmdc.201800088
- Mironov V.F., Nemtarev A.V., Tsepaeva O.V. et al. // Molecules. 2021. V. 26. P. 6350. DOI: 10.3390/molecules2621635.
- Khasiyatullina N.R., Gubaidullin A.T., Shinkareva A.M. et al. // Russ. Chem. Bull., Int. Ed., 2020. V. 69. P. 2140. DOI: 10.1007/s11172-020-3012-3.
- Romanov S., Aksunova A., Bakhtiyarova Y. et al. // J. Organomet. Chem. 2020. V. 910. P. 121130. DOI: 10.1016/j.jorganchem.2020.121130.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41. DOI: 10.14529/chem220205
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. общ. химии. 2022. Т. 92, № 6. С. 885. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. структ. химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 31. DOI: 10.14529/chem230103.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. C. 55. DOI: 10.14529/chem230204.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Dis-playing Crystal Structures from Diffraction Data. Madison, Wisconsin, USA: Bruker AXS Inc., 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Васильев А.В., Гриненко Е.В., Щукин А.О. и др. Инфракрасная спектроскопия органических и природных соединений: Учебное пособие. СПб.: СПбФТУ, 2007. 54 с.
- Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. DOI: 10.1039/B801115J.
- Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул. М.: Мир. 1992. 75 с.

![Исследование кристаллических структур 7-иод-8-оксихинолин-5-сульфонатов алкилтрифенилфосфония [Ph3PAlk][OSO2C9NH4(I-7)(OH-8)], Alk = CH2Ph, CH=CHMe, CH2C≡CH Исследование кристаллических структур 7-иод-8-оксихинолин-5-сульфонатов алкилтрифенилфосфония [Ph3PAlk][OSO2C9NH4(I-7)(OH-8)], Alk = CH2Ph, CH=CHMe, CH2C≡CH](/file/cover/147244639/issledovanie-kristallicheskih-struktur-7-iod-8-oksihinolin-5-sulfonatov.png)
