Исследование кровотока в больших аневризмах при моделировании разных уровней физиологической активности
Автор: Горина А.В., Коновалов А.Н., Гребенев Ф.В., Телышев Д.В.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 3 т.29, 2025 года.
Бесплатный доступ
Разрыв аневризмы головного может привести к внутричерепному кровотечению и, как результат, стать причиной инвалидизации или смерти. Одним из ключевых факторов, влияющих на динамику кровотока в сосуде, является изменение сердечного ритма, которое происходит при физической активности. Подобные изменения существенно влияют на скорость кровотока и характер течения, что сказывается на состоянии аневризмы. В статье представлены результаты численного моделирования динамики кровотока в больших аневризмах при физической активности и в состоянии покоя. Исследование проводилось на основе четырёх реальных моделей церебральных сосудов с аневризмой, полученных из данных ангиографии реальных пациентов, а также четырёх синтетических моделях на одинаковом сердечном цикле. Проанализировано изменение линий тока в куполе аневризмы, поскольку в этой области наблюдается значительное изменение гемодинамики кровотока при изменении граничных условий. Результаты моделирования демонстрируют, что при физической активности максимальная площадь вихря внутри купола увеличивается, что свидетельствует о повышенной нагрузке на стенки сосуда в данном состоянии. Были получены распределения полей скорости, давлений на стенке сосуда, пристеночные касательные напряжения и индекс колебаний пристеночных касательных напряжений для выбранных случаев. При физической активности давление на стенки сосуда в некоторых случаях возрастает в 4 раза при небольших изменениях пристеночных касательных напряжений. При этом увеличение пристеночных касательных напряжений в другой модели не сопровождается значительным изменением давления. Анализ результатов позволил сделать вывод, что геометрия купола играет важную роль в определении характера кровотока. Определены закономерности в характере течения, зависящие от геометрии сосуда и аневризмы. Это подчёркивает необходимость учета индивидуальных анатомических особенностей сосудов при оценке состояния аневризмы.
Аневризма головного мозга, большая аневризма, компьютерное моделирование, сегментация изображений, изменение сердечного ритма
Короткий адрес: https://sciup.org/146283198
IDR: 146283198 | УДК: 539.37/531 | DOI: 10.15593/RZhBiomeh/2025.3.07
Текст научной статьи Исследование кровотока в больших аневризмах при моделировании разных уровней физиологической активности
RUSSIAN JOURNAL OF BIOMECHANICS
Цереброваскулярные заболевания подвергают пациента серьезной опасности, так как по данным Всемирной организации здравоохранения около 15 млн человек умирают от проблем с сосудистой системой головного мозга, что составляет 30 % от общего числа ежегодных смертей [1; 2]. Аневризма -структурное локальное расширение стенки сосуда, которое сопровождается потерей её эластичности. В различных источниках сообщается, что от 3 до 5 % людей по всему миру страдают от внутричерепных аневризм [2-7]. Серьезной опасностью для пациента является разрыв аневризмы, приводящий к церебральному кровотечению, которое может стать причиной летального исхода [7; 10].
Долгое время аневризмы классифицировали по принадлежности к материнскому сосуду, но подобный подход не учитывает характер кровотока внутри самого купола аневризмы, что напрямую влияет на рост и риск разрыва [11; 12]. В настоящее время в литературе представлено большое количество классификаций внутричерепных аневризм, чаще всего их разделяют по размеру: малые (до 3 мм в диаметре), средние (от 4 до 15 мм), большие (от 16 до 25 мм), гигантские (более 25 мм в диаметре) [13; 14]. Характер кровотока в больших и гигантских аневризмах не до конца изучен. Основной особенностью является высокое значение соотношения AR = диаметр купола / диаметр шейки сосуда [13; 14]. Если у пациента наблюдается резкое увеличение размеров аневризмы, то риск разрыва может возрастать до 12 раз [19]. Существуют исследования, которые изучают изменения потока и нагрузку на стенки купола аневризмы до фазы активного роста и после заметного увеличения диаметра [20]. Аневризмы больших размеров считаются сложными объектами для изучения кровотока. В них чаще всего возникают сложные турбулентные течения. В литературе есть работы, которые изучают различные аспекты характера течения крови в больших и гигантских аневризмах [21-23].
Существует большое количество факторов, которые влияют на образование, рост и риск разрыва аневризмы [24; 25]. Значительный эффект оказывают генетическая предрасположенность, наличие вредных привычек, сопутствующих заболеваний, геометрии сосудов купола аневризмы и гемодинамический стресс. Оценку риска разрыва проводят на основании размера аневризмы, но достоверность данных предположений можно увеличить, если принимать во внимание особенности гемодинамических показателей [26-28]. Важным параметром для оценки состояния сосуда и риска разрыва аневризмы являются пристеночные касательные напряжения ( wall shear stress - WSS (т„)), [11; 29]. Кроме того, анализ индекса колебаний пристеночных касательных напряжений ( oscillatory shear index - OSI )
дает возможность определить количественно направление изменения пристеночных касательных напряжений за время одного сердечного цикла [29].
T w =0

OSI = 1
Г T , У
J o T d
J„ lT w dt
где tw - пристеночные касательные напряжения, p - динамическая вязкость жидкости, R - радиус сосуда, дv д r
- градиент скорости, Т - продолжительность одного сердечного цикла.
В здоровых артериях значения пристеночных касательных напряжений равны 1-2,5 Па. Аномально низкие или высокие значения пристеночных касательных напряжений негативно сказываются на состоянии сосудистой стенки [30; 31]. Низкие значения пристеночных касательных напряжений (< 0,5 Па) наблюдаются в зонах роста аневризмы (купол и шейка) [32; 33]. В данных областях происходит ремоделирование сосудистой стенки из-за воспалительных процессов [34]. Высокие значения пристеночных касательных напряжений (> 4 Па) в сложных геометрических местах сосудистой сети (бифуркации и разветвления) свидетельствуют о зарождении аневризм [35]. Высокие уровни сдвиговых напряжений приводят к активации воспалительных реакций, изменению экспрессии генов и повышению чувствительности клеток сосудистой стенки к механическим раздражителям, увеличивая риск прогрессирования патологического процесса. Анализ того, насколько сильно изменяется направление кровотока в непосредственной близости к сосудистой стенки, имеет решающее значение в изучении риска разрыва. Высокие значения индекса колебаний пристеночных касательных напряжений (> 0,1) могут свидетельствовать о зарождающихся процессах разрушения эндотелиального слоя сосудистой стенки, а также о формировании аневризмы.
В работе [31] приведены результаты исследований связи между гемодинамическими параметрами. В процессе роста аневризмы могут характеризоваться низкими значениями пристеночных касательных напряжений (< 0,4 Па) в сочетании с высокими значениями индекса колебаний пристеночных касательных напряжений (> 0,3). Это объясняется тем, что в процессе роста в куполе формируется зона рециркуляции крови. В данном случае возможно образование тромбов, увеличение проницаемости сосудистой стенки и деградация внеклеточного матрикса. Если материнский сосуд обладает высокой кривизной, то в аневризмах возникает высокоинерционный поток, для которого характерны пристеночные касательные напряжений (выше 7 Па). Знания о характере кровотока сосуда с аневризмой могут служить основой для оценки вероятности риска разрыва аневризмы.
На характер кровотока сильное влияние оказывает сердечный ритм [36]. При изменении амплитуды сердечного выброса значения скорости в сосуде могут значительно измениться. Воздействие потока на стенки также зависит от скорости потока. Анализ поведения кровотока в сосуде с аневризмой может быть затруднен тем, что в куполе образуются сложные вихревые течения, которые меняются со временем, следовательно, воздействие на сосуд не может быть очевидным. При изменении сердечного ритма в куполе могут появиться новые вихревые потоки, которые будут воздействовать на те участки сосуда, на которых не наблюдалось повышенное давление в состоянии покоя.
В течение дня пульс человека может сильно изменяться, что влечет за собой изменение течения крови в сосудах [37]. Во время физических нагрузок пульс человека может повышаться до 180 ударов в минуту. В этот момент характер течения крови в сосудах изменяется. Для обычного человека это допустимые нагрузки, которые может спокойно переносить его организм, но если у человека диагностирована аневризма сосудов головного мозга, то подобная физическая активность может спровоцировать ее разрыв.
В рамках данной работы было проведено численное моделирование гемодинамики в больших фузиформных аневризмах с целью оценки влияния геометрии сосуда и изменения сердечного ритма на характер кровотока. Было проведено сравнение состояний кровотока при физической активности и в покое в четырех реальных случаях с диагностированной у пациентов большой церебральной аневризмой, а также в четырёх моделях, полученных синтетическим образом.
Материалы и методы
Геометрия сосудов головного мозга с аневризмой
Для данного исследования были использованы результаты исследований четырех пациентов (П1 – женщина в возрасте 59 лет, П2 – женщина 64 лет, П3 – мужчина 51 года, П4 – женщина 66 лет), у которых была диагностирована большая фузиформная аневризма средней мозговой артерии, а также четыре синтетически сгенерированных геометрии сосудов с аневризмами, основанные на данных реальных пациентов. Для создания пациент-специфичных моделей геометрии аневризм использовались DICOM -данные компьютерной томографии пациентов ФГАУ НМИЦН им. акад. Н.Н. Бурденко Минздрава России, по результатам была сделана сегментация участка церебральных сосудов с аневризмой. Все пациенты подписали добровольное информированное согласие на использование их данных в научных исследованиях, проводимых на базе центра и его партнёров. Поскольку исследование не оказывало влияния на оказание нейрохирургической помощи больным с аневризмами головного мозга, прохождение экспертизы этического комитета не требовалось. В результате были реконструированы геометрические модели сосудов с различной конфигурацией, но с сопоставимыми диаметрами купола (табл. 1).
Результаты компьютерной томографии ангиографии пациента формата DICOM были обработаны в открытом программном пакете для работы с медицинским изображениями 3 D Slicer ( The Slicer Community , США), где была проведена сегментация сосуда с аневризмой и построена 3 D -модель (рис. 1). Дальнейшая постобработка сегментированной модели проводилась в открытом программном пакете MeshMixer ( Autodesk, Inc , США).
Геометрические характеристики моделей
|
Модель |
Максимальный диаметр купола, мм |
Диаметр афферентного сосуда ( inlet ), мм |
Диаметр эфферентного сосуда ( outlet ), мм |
|
Пациент № 1 |
18,46 |
2,54 |
2,24 |
|
Пациент № 2 |
17,68 |
1,65 |
1,78 |
|
Пациент № 3 |
21,54 |
4,14 |
4,45 |
|
Пациент № 4 |
23,27 |
2,01 |
1,63 |
|
Синтетическая № 1 |
16,96 |
2,59 |
2,19 |
|
Синтетическая № 2 |
16,52 |
1,87 |
1,66 |
|
Синтетическая № 3 |
18,22 |
4,03 |
5,26 |
|
Синтетическая № 4 |
25,97 |
3,27 |
3,41 |
Компьютерное моделирование
Вычислительная гидродинамика является мощным инструментом анализа течения крови как в крупных [38; 39] и более мелких [40; 41] сосудах, так и позволяет проводить исследования взаимодействия сердечнососудистой системы с устройствами вспомогательного кровообращения [42; 43].
В работе моделирование проводилось в лицензионном программном пакете COMSOL Multiphysics (COMSOL Inc ., Швеция), в котором был использован модуль для изучения ламинарного течения ( Laminar Flow ), позволяющий анализировать области возникновения турбулентности. В сосуде преобладает ламинарное течение, но в куполе возникают турбулентные области. Число Рейнольдса в моделях варьируется от 840 до 3000, что позволяет использовать модель ламинарного потока для расчетов. В данном случае модель ламинарного потока используется в том числе для ускорения времени расчетов. Пренебрегая силами, действующими на тело, уравнения сохранения массы и импульса принимают вид [44]:
Р
д и
--+ и -V и д t
-V p + ^V и
и уравнение несжимаемости
-
V- и = 0,
где и - вектор скорости, t - время, ц - вязкость, р - плотность, p - давление.
Для исследуемой жидкости были определены параметры для имитации крови. Динамическая вязкость используемой жидкости равна 4 мПа-с, а плотность жидкости 1050 кг/м3. В данном случае в качестве граничных условий принимается постоянное значение вязкости ньютоновской жидкости [45]. В модели используется условие жёсткой стенки, что подразумевает отсутствие деформации сосудистой стенки под действием гемодинамических сил, подобные допущения позволяют сократить временные затраты на расчёт, не искажая результаты моделирования [46-48].
Система уравнений (3)–(4) решалась численно на основе метода конечных объемов [49]. Для вычислительной модели использовалась расчётная сетка с тетрагональными элементами. Были созданы три призматических слоя на внутренней стенке сосуда, размеры которых изменялись по экспоненциальному закону, начиная с высоты 0,2 мм с соотношением сторон 1,2, что позволяет получить точные результаты моделирования на границе сосуда, не увеличивая временные затраты на расчёт [50]. Количество элементов сетки для моделей пациентов № 1, 2 и синтетических моделей № 1-3 составляло 150 000 ячеек, а для пациентов № 3, 4 и для синтетической модели № 4 250 000 ячеек, разное количество элементов для моделей обусловлено геометрическими размерами купола. Тестовые расчеты продемонстрировали, что дальнейшее увеличение количества элементов сетки не приводит к количественному или качественному изменению результатов расчёта.
Для исследования кровотока в состоянии покоя был взят сердечный ритм реального пациента, длительность которого составляла 1 с. В ходе нейрохирургического вмешательства на аневризмах, стандартно проводились измерения линейной скорости кровотока в проксимальных и дистальных по отношению к аневризме сосудах.
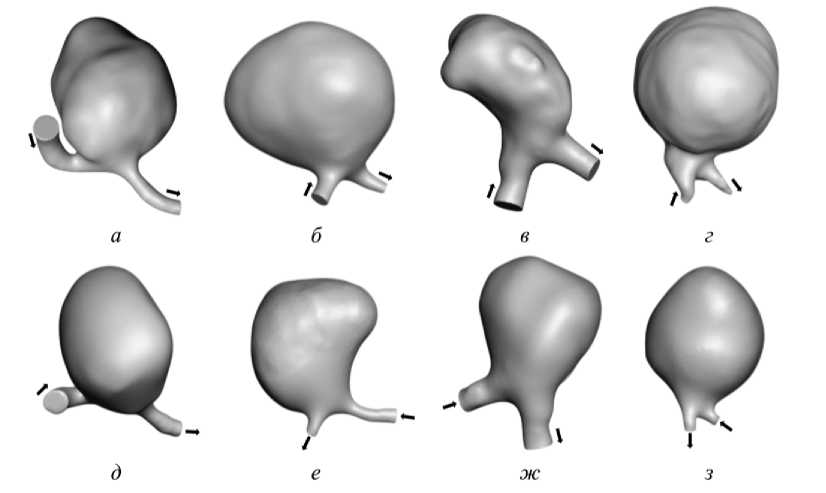
Рис. 1. 3 D -модель участка сосуда с аневризмой, построенная по результатам КТ, стрелками обозначено направление потока крови (буквами а-г обозначены геометрии пациентов № 1-4; буквами д-з - синтетические модели № 1-4)
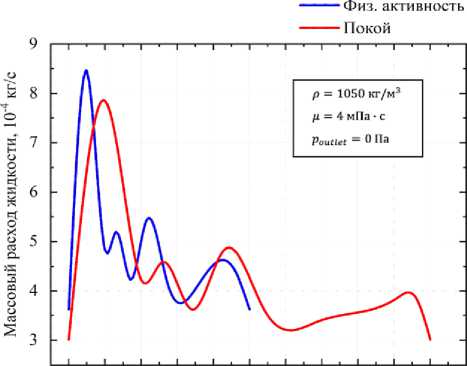
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0 1,1 Время, с
Рис. 2. Данные массового расхода жидкости для пациента
Измерения выполнялись на фоне инвазивного мониторинга гемодинамики (инвазивное измерение артериального давления через катетер в лучевой артерии), данные ЛСК сопоставлялись с данными системной гемодинамики и в соответствии с сердечным циклом (систола и диастола). Для измерений использовался аппарат «АНГИОДИН–УК» (АО НПФ «БИОСС», Россия).
При физической активности у человека учащается сердцебиение, что приводит к сокращению времени одного сердечного цикла и увеличению максимального значения скорости, при этом форма сигнала остается без значимых изменений [51]. Сердечный цикл при физической активности был синтетически получен путем сокращения продолжительности самого цикла и изменения амплитуды значений скорости, сохраняя основные пиковые значения самого цикла, основываясь на литературные источники (рис. 2.) [49].
Граничные условия прилипания использовались на стенках сосуда. Каждая модель имеет один афферентный ( inlet ) и один эфферентный сосуды ( outlet ). На вход подавалось переменное периодическое условие для массового расхода за 5 с. На выходе было задано условие нулевого давления.
Результаты
Результаты моделирования приводятся для 3-го исследуемого цикла, первые циклы не анализируются, так как используются для достижения стационарной сходимости численного решения. Момент времени был выбран через 0,05 с после систолического пика (для состояния покоя 0,15 с, для состояния при физической активности 0,1 с). Были проанализированы значения скорости, давления на стенки материнского сосуда и купола аневризмы, пристеночных касательных напряжений, индекса колебаний пристеночных касательных напряжений, а также линии тока в сосуде.
Во всех случаях в куполе образовывался вихревой поток в состоянии покоя и при физической активности. Визуальный анализ линий тока выявил расширение зон рециркуляции при нагрузке (рис. 3). Максимальное увеличение наблюдалось у пациента № 2, наименее заметные изменения были у пациента № 3 и в синтетической модели № 3. У пациента № 4 увеличилось количество вихревых потоков в куполе при физической активности, также количество вихрей увеличилось у синтетической модели № 1 и 2.
Скорость потока (рис. 4) и давление на стенках сосуда (рис. 5) в состоянии покоя также изменяются при физической нагрузке. У пациента № 1 скорость увеличивается в два раза при схожем характере вихревого потока при активности и в покое, но у пациента № 3 скорость потока изменяется незначительно при заметном изменении вихревого течения в куполе. В случае пациента № 4 значительно изменилась площадь потока при физической активности.
При анализе давления на стенки сосуда с аневризмой у пациента № 3 значения увеличились в 4 раза, а у пациента № 4 почти в 2 раза, у пациентов № 1 и № 2 наблюдались лишь незначительные изменения. У синтетической модели № 3 значения увеличились в 2 раза. Резкое изменение давления во время сердечного цикла является причиной экстремальной деформации сосудистой стенки [47].
Кроме того, проанализированы значения пристеночных касательных напряжений для всех случаев (рис. 6.). Относительно материнского сосуда значение пристеночных касательных напряжений в куполе пониженное, но на стенках в некоторых случаях есть выраженные области повышенных значений. Наиболее характерно они наблюдаются в случае пациентов № 2, 4. В большинстве случаев в куполе аневризмы значения пристеночных касательных напряжений менее 0,5 Па, что свидетельствует о росте аневризмы и ремоделировании сосудистой стенки [33; 34]. У синтетических моделей № 1, 2 наблюдаются повышенные значения пристеночных касательных напряжений более 4 Па, что говорит о протекании воспалительных процессов сосудистой стенки [35].
Проведен анализ индекса колебаний пристеночных касательных напряжений для всех моделей (рис. 7). У пациента № 3 и синтетической модели № 3 значения индекса колебаний пристеночных касательных напряжений не превышают 0,1 в состоянии покоя и при физической активности, что может свидетельствовать об отсутствия зарождающихся процессов разрушения сосудистой стенки.
У пациента № 1 и синтетической модели № 1 повышенные значения индекса колебаний пристеночных касательных напряжений в куполе, при этом низкие значения пристеночных касательных напряжений. Такая же ситуация наблюдается в случае синтетической модели № 4.
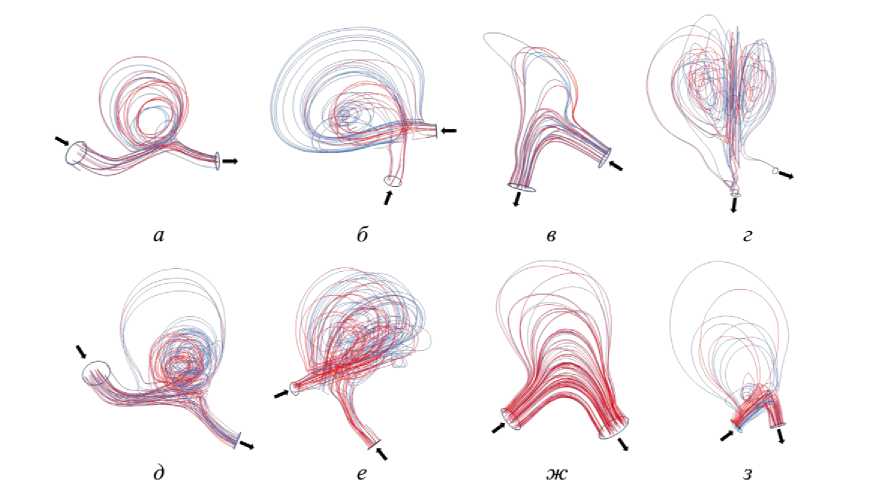
Рис. 3. Линии тока в куполе аневризмы (красные линии – состояние покоя, синие линии – состояние физической нагрузки): а–г – пациент № 1–4, д–з – синтетические модели № 1–4
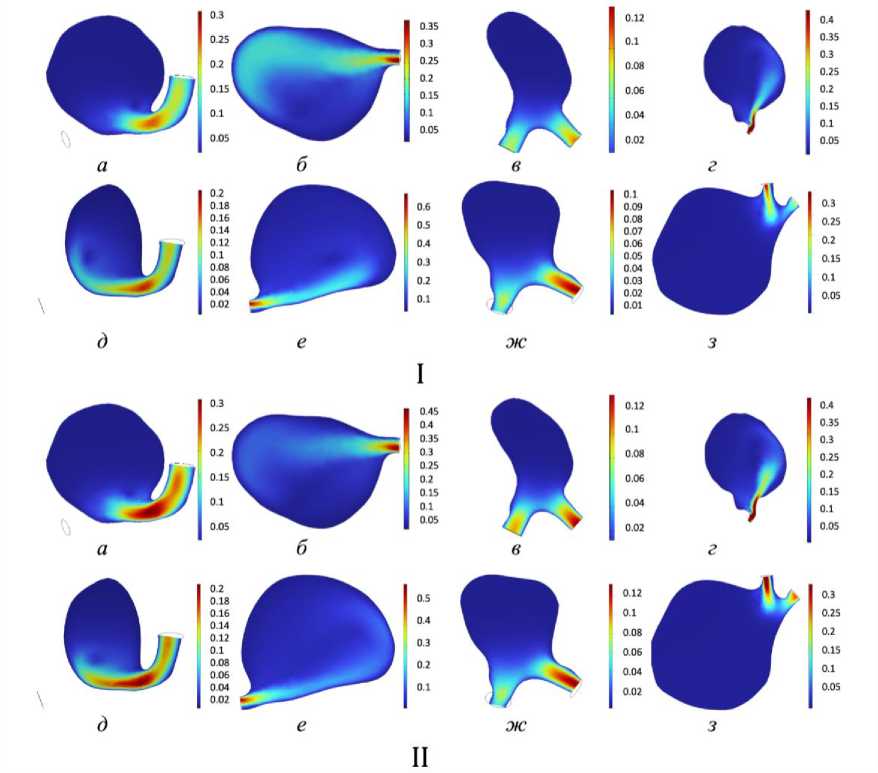
Рис. 4. Распределение скоростей (м/с): I – в состоянии покоя, II – при физической нагрузке ( а–г – пациент № 1–4; д – з – синтетические модели № 1–4)
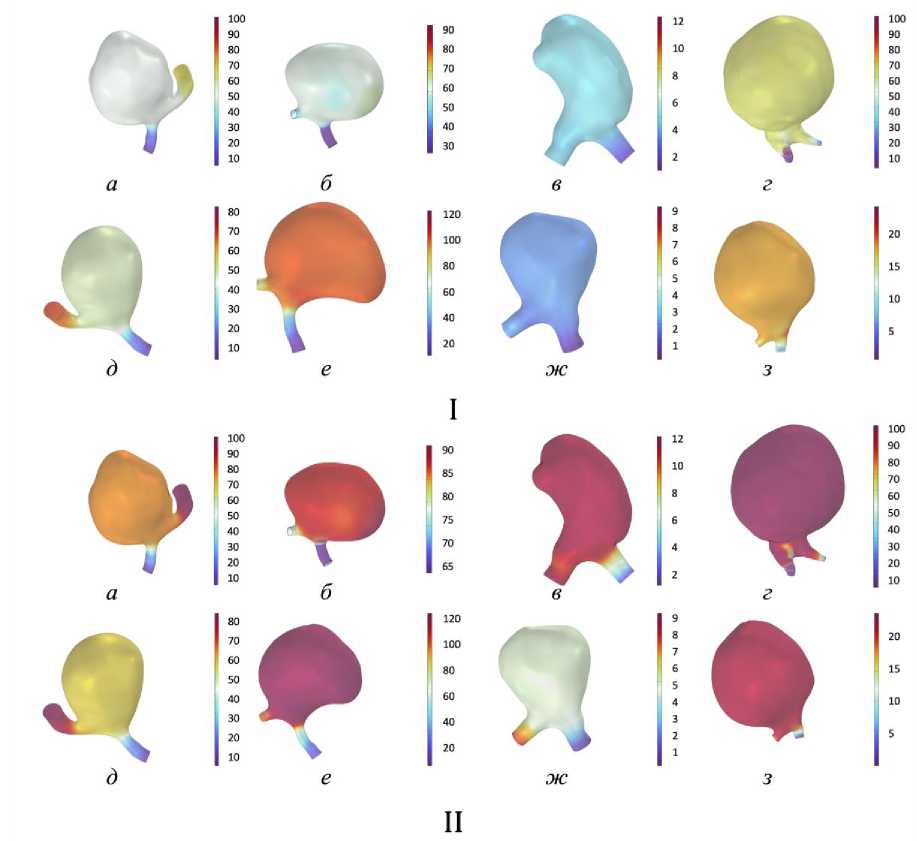
Рис. 5. Давление (Па) на стенках сосуда: I – в состоянии покоя; II – при физической нагрузке ( а–г – пациент № 1–4; д–з – синтетические модели № 1–4)
Обсуждение
В рассмотренных случаях не удалось выявить четкой корреляции между изменением сердечного цикла в покое и при физической активности и характером кровотока в сосуде. Полученные результаты демонстрируют, что реакция кровотока на физическую активность, сопровождающуюся изменением сердечного ритма, существенно варьируется в зависимости от индивидуальных анатомических особенностей сосудов. У пациента № 2 было отмечено значительное изменение характера линий тока и пристеночных касательных напряжений. Это может свидетельствовать о том, что в данном случае геометрия аневризмы способствовала формированию сложных вихревых структур, которые оказывали влияние на распределение пристеночных касательных напряжений, но не приводили к существенному изменению давления.
Подобные особенности могут быть связаны с наличием зон рециркуляции или турбулентности, которые характерны для сложных геометрий.
Наибольшее изменение скорости кровотока при изменении сердечного ритма наблюдалось в моделях пациентов № 1, 4, а также синтетической модели № 1.
Подобные изменения могут приводить к увеличению нагрузки на стенки сосуда, особенно в зонах с высокой скоростью потока, что требует дополнительного внимания при оценке риска разрыва.
У пациента № 3 и синтетической модели № 3 значения индекса колебаний пристеночных касательных напряжений наиболее близки к норме, при этом данные модели обладают максимально вытянутой формой, купол остальных геометрий шарообразный.
Такие закономерности могут свидетельствовать, что вытянутая форма купола способствует более равномерному распределению гемодинамической нагрузки на сосудистую стенку.
При этом вытянутая форма аневризмы может провоцировать резкий рост давления при физической активности. Например, у пациента № 3, а также у синтетической модели № 3 давление на стенке увеличивалось в 2,5 раза.
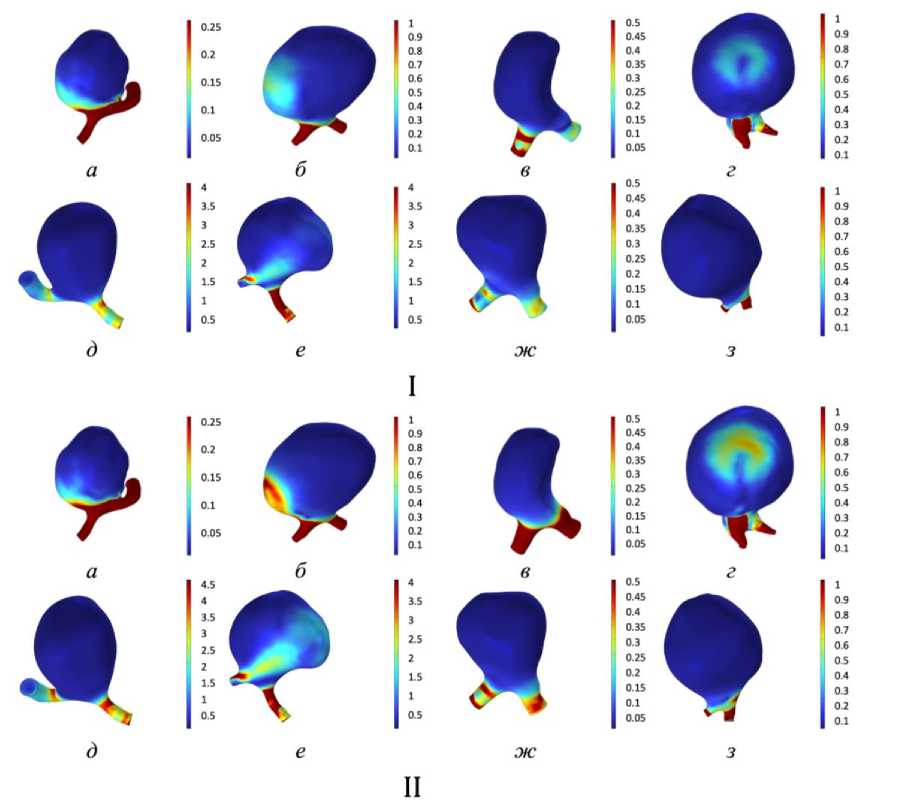
Рис. 6. Пристеночные касательные напряжений (Па): I – в состоянии покоя;
II – при физической нагрузке ( а–г – пациент № 1–4, д–з – синтетические модели № 1–4)
Шарообразная форма купола может провоцировать повышенные индекс колебаний пристеночных касательных напряжений. Такой эффект наблюдается у пациента № 1 и у синтетических моделей № 1 и 4.
Геометрия сосуда у пациента № 4 также шарообразная, но при этом место присоединения купола к материнскому сосуду более выражено, чем в других случаях, что также провоцирует повышение пристеночных касательных напряжений и индекс колебаний пристеночных касательных напряжений преимущественно в этой области.
При этом в случаях пациента № 3 и синтетической модели № 3 наблюдалось значительное изменение давления в куполе при практически неизменном пристеночном касательном напряжении. Это может указывать, что в данном случае геометрия аневризмы способствовала равномерному распределению сдвиговых напряжений, но при этом изменение сердечного ритма привело к значительным колебаниям давления.
Такие результаты подчеркивают, что даже при стабильном пристеночном касательном напряжении изменение давления может быть критическим фактором, влияющим на риск разрыва аневризмы.
У пациента № 1 и синтетической модели № 1 повышенные значения индекса колебаний пристеночных касательных напряжений в куполе, при этом низкие значения пристеночных касательных напряжений, такое сочетание может свидетельствовать о возможном тромбообразовании [31]. Такая же ситуация наблюдается в случае синтетической модели № 4.
Подобные различия подчеркивают, что индивидуальные анатомические особенности сосудистой системы каждого пациента играют важную роль в оценке гемодинамических процессов. Для установления более точных закономерностей и подтверждения поставленной гипотезы необходимо провести подобное исследование на выборке с большим количеством данных геометрии сосуда с аневризмой.
В данном исследовании сосудистые стенки моделировались как жёсткие, что не учитывает эластичность стенки и взаимодействие жидкости с деформируемой структурой, это могло привести к повышенным значениям пристеночных касательных
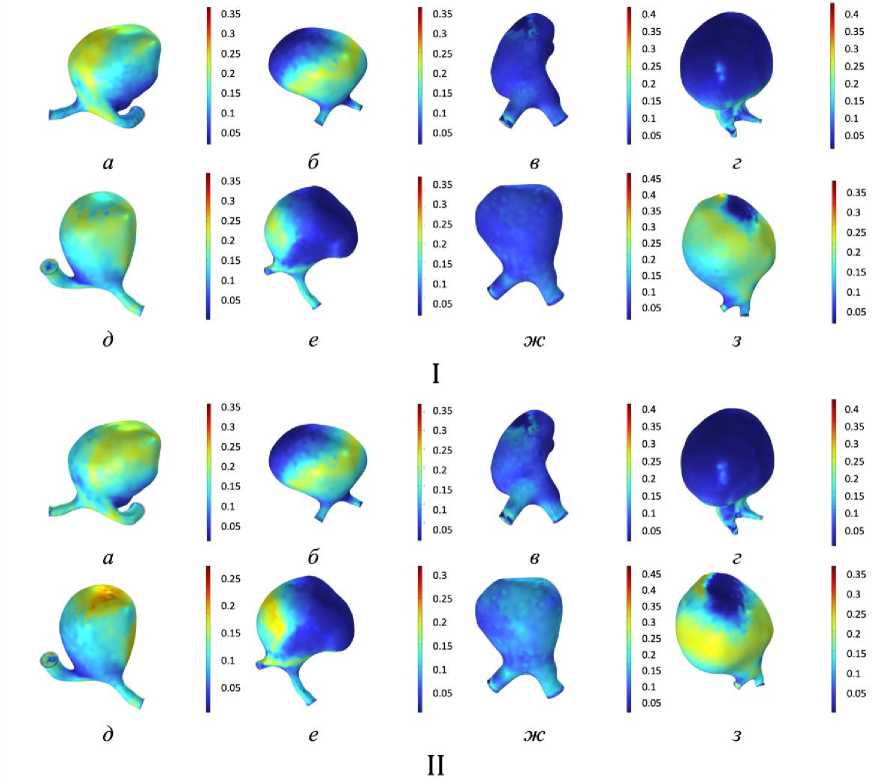
Рис. 7. Индекс колебаний пристеночных касательных напряжений: I – в состоянии покоя; II – при физической нагрузке ( а–г – пациент № 1–4, д–з – синтетические модели № 1–4)
напряжений. Для повышения точности результатов необходимо комбинировать методы CFD ( Computational Fluid Dynamics ) и FSI ( Fluid–Structure Interaction ) моделирования.
Заключение
Проведенное исследование позволило выявить закономерности в гемодинамическом поведении церебральных аневризм. Анализ результатов показал отсутствие статистически значимой связи между изменениями сердечного цикла (в покое и при физической нагрузке) и характером кровотока в исследуемых моделях. Наблюдаемая вариабельность изменений характера кровотока в значительной степени обусловлена индивидуальными анатомическими особенностями сосудов.
Геометрические характеристики аневризм продемонстрировали выраженное влияние на исследуемые параметры. Аневризмы с вытянутой морфологией купола характеризовались более равномерным распределением пристеночных касательных напряжений и близкими к нормальным значениями индексу колебания пристеночных касательных напряжений в состоянии покоя. В противоположность этому, для шарообразных образований были характерны повышенные показатели индекса колебаний пристеночных касательных напряжений и локальные увеличения пристеночных касательных напряжений, особенно выраженные в зоне соединения с материнским сосудом.
Особый интерес представляют выявленные различия в реакции на изменения сердечного ритма. Модели с шарообразной конфигурацией показали значительное возрастание скорости кровотока, тогда как для вытянутых аневризм было зарегистрировано резкое повышение давления при сохранении относительной стабильности пристеночных касательных напряжений. В отдельных случаях сложная геометрия аневризмы способствовала формированию устойчивых вихревых структур без значительного влияния на давление.
Полученные данные подчеркивают критическое значение индивидуальных морфологических особенностей при оценке гемодинамических параметров аневризм. Особую значимость приобретает комплексный анализ параметров, зависящих друг от друга. Для подтверждения установленных закономерностей и разработки надежных диагностических критериев необходимы дальнейшие исследования на расширенной клинической выборке с применением современных методов многопараметрического анализа.


