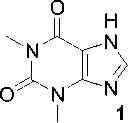
Исследование n-алкильных производных теофиллина методом хроматомасс-спектрометрии
Автор: Ошеко К.Ю., Ким Д.Г., Алзамили А.Ф., Еременко Т.Д.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 4 т.10, 2018 года.
Бесплатный доступ
В настоящей работе методом масс-спектрометрии на газовом хромато-масс-спектрометре GCMS-QP2010 UltraShimadzu проведен анализ спектров и изучено поведение при электронной ионизации 7-аллил-, 7-пропаргил-, 7-(2-(4-бромфенил)-2-оксоэтил)-, 7-металлил-, 7-(2-бромэтил)-, 7-(2-гидроксиэтил)-, 7-[2-(2-хлорэтокси)этил]-, 7-[2-(2-гидроксиэтокси)этил]-, 7-(2,3-дибромпропил)-теофиллинов и 7,7'-этан-1,2-диилбис(теофиллина), выявлены закономерности фрагментации молекул. 7-(2,3-Дибромпропил)теофиллин получен присоединением брома по двойной связи 7-аллилтеофиллина в уксусной кислоте при комнатной температуре в течение 24 часов. 7-[2-(2-Хлорэтокси)этил]- и 7-[2-(2-гидроксиэтокси)этил]теофиллины синтезированы взаимодействием теофиллина с 2,2'-дихлордиэтиловым эфиром, а 7-металлилтеофиллин - алкилированием теофиллина хлористым металлилом при нагревании в ДМФА в присутствии безводного карбоната калия с обратным холодильником в течение 6-8 часов. Структура 7-металлилтеофиллина подтверждена методом протонного магнитного резонанса. В масс-спектрах изученных соединений присутствуют пики, характерные для фрагментации теофиллина. Практически во всех масс-спектрах анализируемых производных теофиллина имеются пики с m/z 180, принадлежащие катион-радикалу теофиллина, что свидетельствует о разрыве связи N-CH2. В случае 7-пропаргил- и 7-(2-(4-бромфенил)-2-оксоэтил)теофиллинов этот пик отсутствует, в случае 7-аллил- и 7-металлилтеофиллинов обладают низкой интенсивностью, что обусловлено более высокой устойчивостью N-алкильной связи. В условиях хроматографирования в хроматомасс-спектрометре 7-металлил- и 7-пропаргилтеофиллины подвергаются термической перегруппировке. В масс-спектрах галогенсодержащих соединений проявляется характерное распределение изотопных пиков молекулярного иона: дублет с соотношением интенсивностей приблизительно 1:1 для соединений с одним атомом брома, триплет пиков в случае наличия двух атомов брома, а также дублет в соотношении 3:1 для хлорсодержащих производных. Во всех масс-спектрах галогенсодержащих соединений эти мультиплеты, как правило, обладают низкой интенсивностью. В случае 7-(2-бромэтил)- и 7-(2,3-дибромпропил)-теофиллинов максимальной интенсивностью обладает пик, обусловленный отрывом бром-радикала. Характерной особенностью всех изученных масс-спектров является элиминирование молекул метилизоцианата, монооксида углерода и цианистого водорода.
Теофиллин, масс-спектрометрия, фрагментация, 3-дибромпропил)-теофиллин, 7-[2-(2-хлорэтокси)этил]теофиллин, 7-[2-(2-гидроксиэтокси)этил]теофиллин, 7-металлилтеофилли
Короткий адрес: https://sciup.org/147233105
IDR: 147233105 | УДК: 547.857.4+ | DOI: 10.14529/chem180402
Текст научной статьи Исследование n-алкильных производных теофиллина методом хроматомасс-спектрометрии
Биологическая активность производных ксантина изучается достаточно широко [1–6]. В частности была обнаружена антимикробная и противовоспалительная активность производных ксантинов [6].
Теофиллин – алкалоид, который содержится в листьях чайного куста, препараты его на основе оказывают на организм диуретическое действие, расслабляют гладкую мускулатуру, оказывают стимулирующее действие на центральную нервную систему [7]. Алкилированием теофиллина получены различные N7-замещенные производные, в том числе 7-аллил- (2a) [8–12], 7-пропаргил- (2c) [10, 13–17], 7-(2-(4-бромфенил)-2-оксоэтил)- (2d) [18], 7-(2-бромэтил)- (2e) [19– 21], 7-(2-гидроксиэтил)теофиллина (2f) [22] и 7,7'-этан-1,2-диилбис(теофиллина) (3) [23], но в литературе отсутствуют данные об их исследовании методом масс-спектрометрии и не рассматривается их фрагментация.
Обсуждение результатов
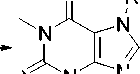
Нами впервые изучено поведение при электронной ионизации (ЭИ) полученных соединений 2a , 2d , 2c , 2e , 2f , 3 , 7-металлил- ( 2b ), 7-[2-(2-хлорэтокси)этил]- ( 2g ), 7-[2-(2-гидроксиэтокси)этил]- ( 2h ) и 7-(2,3-дибромпропил)-теофиллина ( 4 ) (схемы 1–3).
RX
O
O
Br
N
Br2
N 2a 2a-d,f-h
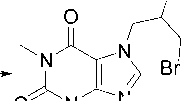
Схема 1. Синтез производных теофиллина 2a R = CH 2 CH=CH 2 , 2b R = CH 2 C(CH 3 )=CH 2 , 2c R = CH 2 C≡CH, 2d R = CH 2 COC 6 H 4 -Br-4, 2f R = CH 2 CH 2 OH; 2g CH 2 CH 2 OCH 2 CH 2 Cl; 2h CH 2 CH 2 OCH 2 CH 2 OH 2a,c-e X = Br, 2b,f,g,h X = Cl
Соединения 2b , 2g , 2h и 4 были синтезированы впервые (схема 1). Дибромаллилтеофиллин 4 получен взаимодействием аллилтеофиллина 2а с бромом. Металлилтеофиллин 2b синтезирован алкилированием теофиллина металлилхлоридом при нагревании в ДМФА в присутствии безводного карбоната калия.
O
BrCH 2 CH 2 Br
I 3
O
N
O
Br
BrCH 2 CH 2 Br
2e
Схема 2. Взаимодействие теофиллина с 1,2-дибромэтаном
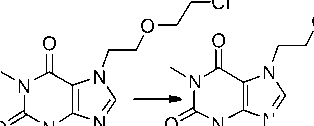
Производные 2g и 2h получены при взаимодействии теофиллина с 2,2’-дихлордиэтиловым эфиром в ДМФА. Очевидно, что эфир 2h является продуктом гидролиза соединения 2g (схема 3).
O
I 1
(ClCH 2 CH 2 ) 2 O
K2C O3, DMF
I 2g
N
2h
OH
Схема 3. Взаимодействие теофиллина с 2,2’-дихлордиэтиловым эфиром
В масс-спектрах всех изученных соединений присутствуют пики, характерные для фрагментации теофиллина, которая была опубликована ранее в литературе [24]. Интенсивность пиков молекулярного иона [M]+• соединений 2a - h , 3 , 4 варьируется от 15 % до 100 % (табл. 1). В соединениях 2a-с пик молекулярного иона является максимальным.
Во всех масс-спектрах анализируемых соединений, кроме производных 2c и 2d , присутствует пик с m/z 180 (теофиллин), что свидетельствует об отщепление алкильной группы в результате разрыва связей N–CH 2 .
|
л н й о к о о о cd S |
СП г-н ^ и |
04 |
и |
id rq |
+ ° q 22 и 5 |
ш |
и |
o' 00 |
% ^ и |
00х СП 04 |
и |
Ci |
+ m ^ U |
r? & ID oo |
О и |
СП |
1 |
1 |
q q |
о 04 |
1 |
1 |
|
О q |
ОО |
+ си q О |
Г- |
со я 2 и 5 |
rq |
2 я и |
o' о |
о |
С ID rq |
q C4| Щ и |
ID |
^ к и |
£ |
2 ® и |
oo |
2 q q |
rq |
|||||
|
+о rq И?' 40 q О |
04 |
Ю ^ и |
40 СП |
40 О |
СП |
о rq Пр- rq % и |
G О rq |
СП ип Щ и |
СП |
m? CH |
£ о |
+ СП ID Щ u |
G4 О rq |
+ 04 Z 2 щ о |
oo |
о си ь4? rq q q q |
о СП |
|||||
|
° q 00 ^ |
40 |
00 q и |
ОО |
- о |
СП q id rq |
СП 42 — q и |
£ о |
^ Щ О |
c Ci ID 00 |
q m ^ Щ u |
00 |
40 Щ q |
oi 00 |
+ ID PQ 22 q q |
о rq |
О rq >-^ ID A q q |
rq |
СЧ ч- и |
40 |
|||
|
к СО НН о |
Г- |
^ q и |
СП rq |
04 К |
S 00 |
ос q ^ q и |
g 40 |
г- m 40 О |
o' Ci ID СП |
о СП ^2 40 4a q и |
ID |
40 о |
cc о о |
+ CH Q OO ^. - q q |
о о |
СП § ID Щ q |
40 |
о S q q q |
ос ID |
СП § ID Щ и |
rq |
|
|
о О "З |
О |
00 ^ о ^ q и |
id |
m 5 rq CL |
о о о о |
О 40 £ ~ К и |
£ о |
00 ^ О |
5^ cn |
-H К 5 |
ID |
A ^ q |
г? DI |
о СП 04 q q |
04 |
^ q q |
40 |
О о |
^ q и |
^ |
||
|
® 2 rq ±L |
о о |
О rq rq ^ q |
ОО |
+ IT) ^н СП + |
cG МП |
о 2 Z ~ к и |
г- |
04 Щ^ и |
ri rq CH |
- 5 nq ±L |
o' О ID 04 |
J? и |
5? •D |
2 ^ СП ±1 |
ID |
и |
СП |
^ 2 ri ZL |
о |
55 £ |
о |
|
|
^N |
||||||||||||||||||||||
|
о К И о ч о о и |
о |
о и |
q о ^ |
m о S^ к и |
m о 3 z 2 и |
|||||||||||||||||
|
27 H X
о cd 2 |
О СП ГМ А б б |
О1 СМ |
ГМ нн б |
СП |
+ б S б б б |
о о |
40 б б |
СП |
1 |
1 |
40 V б |
Г- |
о мп ^ Щ б |
о мп |
00 ^ о |
см |
1 |
1 |
+о о - б б |
СП |
СП МП Щ б |
|
|
о 40 сп щ б |
40 |
о nt б б |
04 |
б сп v 04 б б |
о |
00 щ б |
'—1 |
б § % к и |
о о |
^ ^ б б |
гм |
°" б б |
40 |
+о 40 ^ и |
04 |
^ б б |
ОО |
|||||
|
о МП б б б |
г- |
мп Щ б |
О |
б о б cq 2 б |
СП СП |
мп б б |
СП |
о СП 04 б и |
+ 00 щ О |
о |
04 ^ ^ б б |
г- |
+ б S б б б |
СП |
00 ^ о |
40 |
||||||
|
б о 00 £ б б |
о о |
^ б б |
см см |
б спб Я у |
см |
о |
ю |
о о Z см 2 б и |
о |
+ МП б б |
40 ГП |
б ГМ гм Щ б |
см см |
СП НН О |
см |
04 Щ б |
СП |
|||||
|
б S б б б |
см см |
00 ^ и |
СП см |
- б МП нн см । |
о |
б СП СМ ^ б б |
ш см |
CM о |
04 |
О сп V см см б и |
г- |
04 б 2 щ о |
б 00 б б |
S |
б см ^ к б |
оо |
+ О н? |
04 СМ |
+ 00 ^ о нн ^ б б |
О |
||
|
® К S |
ОО |
ш ^ ^ б б |
о 40 |
40 ОО ^н ГМ ^ |
о |
О МП б б |
МП |
мп ^ 6l О |
о см |
б О Q МП ^4 ^ к |
40 |
гм ^ б б |
гм |
б о Z см 7 б б |
о о |
^ Щ и |
г- |
о о |
04 5 ^ б б |
см |
||
|
см 5 гм 71 |
МП |
б 2 К и |
гм |
ОО оо 4- г7 |
СП |
о 40 V щ и |
о |
^ щ и |
оо +__ 40 ^н СМ ^ |
+о мп б б б |
мп |
40 ^7 ОО |
40 см |
^ б б |
СП |
^S СП 1----1 |
о см |
m б 2 Щ б |
04 |
|||
|
4м |
^\ |
|||||||||||||||||||||
|
о си и |
б гм 1 б |
б б 0D б гм б б |
б б б |
б СП ^ б б |
б ^ б б б |
|||||||||||||||||
s
к m s о Щ
s
2 к
И S Q. К
X c3
X
m
-x-
Максимальной интенсивностью пик с m/z 180 обладает в случае соединений 2f , 2h и 2g . При фрагментации гидроксиалкилтеофиллина 2f , это, по-видимому, обусловлено характерным для первичных спиртов легким элиминированием воды и ацетилена (схема 4). В случае производных 2h и 2g образование пика с m/z 180 объясняется элиминированием молекул CH2=CH-O-CH 2 CH 2 OH и CH 2 =CH-O-CH 2 CH 2 Cl, соответственно.
|
OH |
+ |
|
+ . O NN |
O NN |
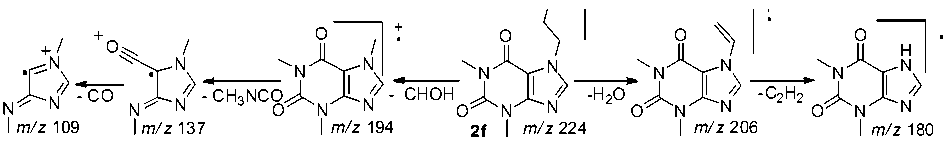
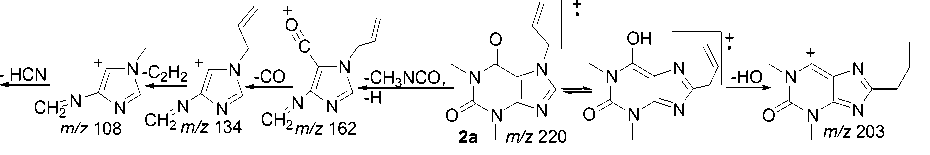
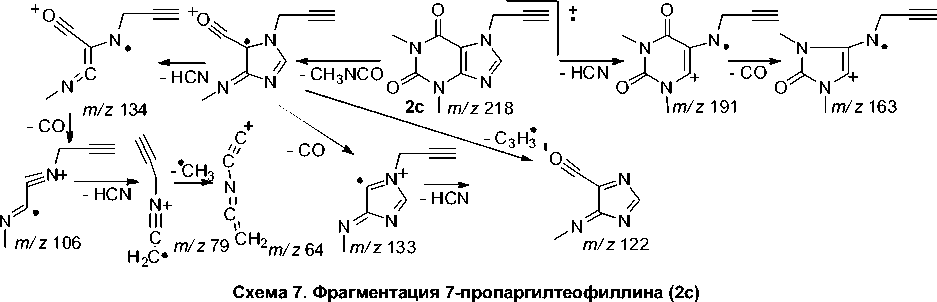
В масс-спектре пропаргилтеофиллина 2c отсутствует пик с m/z 180, что, как и в случае аллила 2а , обусловлено высокой устойчивостью связи N–CH 2 . В масс-спектрах присутствуют пики с m/z 191 и 163, обусловленные отрывом HCN и CO. Одним из интенсивных является пик с m/z 134, обусловленный отрывом метилизоцианата и CO. Пик с m/z 39 свидетельствует об образовании пропаргил-катиона (схема 7).
Аналогично на хроматограмме продукта взаимодействия теофиллина с металлилхлоридом было обнаружено два вещества с m/z 234, хотя на спектре ЯМР 1 Н присутствуют сигналы протонов только одного соединения. На наш взгляд, это обусловлено изомеризацией соединения 2b в условиях съемки масс-спектра (250 ºС).
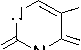
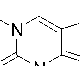
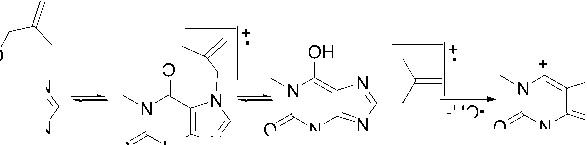
Маленький пик (8 %) с m/z 219 является доказательством отрыва метил-радикала, а интенсивный пик (85–54 %) с m/z 55 – образования металлил-катиона. Как и в случае аллилтеофиллина 2а , в масс-спектре присутствует пик с m/z 193, обусловленный разрывом С–С связи в N-алкильном фрагменте. Наличие пика с m/z 162 свидетельствует о перегруппировке металлильного заместителя с атома азота на атом кислорода карбонильной группы. Катион-радикал с m/z 107 образуется в результате элиминирования молекул HCN и CO от катион-радикала с m/z 162, а пик с m/z 81 – в результате дальнейшего раскрытия цикла и отрыва молекулы ацетилена (схема 8).
H 2 C N
O
N
х) - OC4H7 N m/z 162
N
O
O
N
-HO
N
O
CO
- CH 3 NCO, H
ONN m/z 234 I \
N
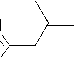
m/z 217
.G<°
O
HC m/z 94
- HCN
I
H 2 C N
C -*----
I - HCN
C+ N m/z 121 CH2
- CO
N
N
N
CH 2
m/z 193
HC

m/z 107
N m/z 148 CH 2 N m/z 176
m/z 206
Схема 8. Фрагментация 7-металлилтеофиллина (2b)
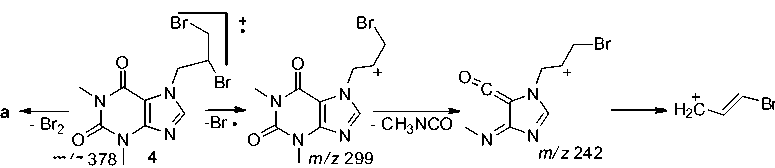
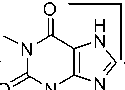
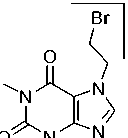
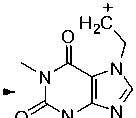
Для бромалкилтеофиллина 2e наблюдается характерное для монобромсодержащих соединений распределение изотопных пиков молекулярного иона – дублет с соотношением интенсивностей приблизительно 1:1. Максимальным является пик, соответствующий катиону, образующемуся при отрыве радикала Br·(схема 9).
H N
m/z 152
-CO
+ .
+
- CH2=CHBr m/z 180
-Br .
2e m/z 286
m/z 207
Схема 9. Фрагментация 7-(2-бромэтил)теофиллина (2e)
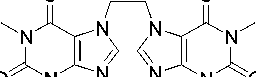
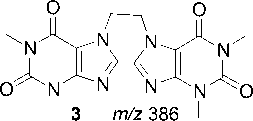
Фрагментация бистеофиллина 3 схожа с фрагментацией теофиллина, имеется пик с m/z 206, обусловленный образованием катион-радикала N-винилтеофиллина (схема 10).
N
NN m/z 109
+
O
-C 7 H 8 N 4 O 2
m/z 206
+
Схема 10. Фрагментация 7,7'-этан-1,2-диилбис(теофиллина) (3)
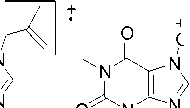
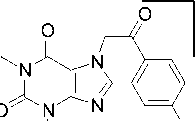
В случае бромфенацилтеофиллина 2d максимальной интенсивностью в масс-спектре обладает пик с m/z 183, который, как и пик молекулярного иона, имеет изотопный пик M+2, что свидетельствует о наличии атома Br в осколочном фрагменте. На наш взгляд, происходит разрыв связи CH2–CO c образованием ацильного катиона, который в дальнейшем разрушается по двум путям: с отрывом молекул HBr или монооксида углерода (пики с m/z 104 и 155, соответственно) (схема 11).
+ .
Rr
2d m/z 376 Br
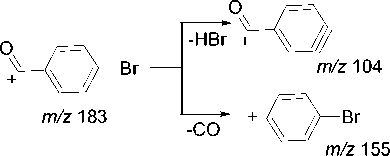
Схема 11. Фрагментация 7-(2-(4-бромфенил)-2-оксоэтил)теофиллина (2d)
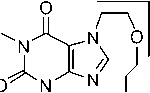
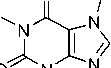
В масс-спектре эфира 2g наблюдается характерное для молекул с одним атомом хлора распределение изотопных пиков молекулярного иона в соотношении 3:1, присутствует пик с m/z 251, обусловленный отрывом хлороводорода. Дальнейшее элиминирование CO приводит к образованию пика с m/z 223, который фрагментируется с отрывом метилизоцианата, CO и образованием катион-радикала с m/z 166, что свидетельствует об устойчивости 2-(винилокси)этильного фрагмента. Об этом также свидетельствует образование катиона с m/z 193 (схема 12).
-HClO
+ .
2g m/z 286Cl
O
O m/z 251
+ .

- CH 3 NCO, H
O
NO
H2C N N CH m/z 193 2
O
CH
CH 2 m/z 223
- CO CH 2
- C 2 H 4 O
m/z 207
+ .
- CH 3 NCO, CO
NN m/z 166
Схема 12. Фрагментация 7-[2-(2-хлорэтокси)этил]теофиллина (2g)
Фрагментация эфира 2h происходит аналогично фрагментации эфира 2g , в спектре присутствует пик с m/z 251, свидетельствующий об элиминировании воды от молекулярного иона. Присутствуют пики с m/z 223 и 207, обусловленные отрывом винильного и О-винильного радикалов, соответственно (схема 13).
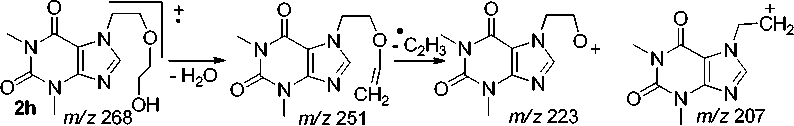
Схема 13. Фрагментация 7-[2-(2-гидроксиэтокси)этил]теофиллина (2h)
Экспериментальная часть
Масс-спектры электронного удара сняты на газовом хромато-масс-спектрометре GCMS-QP2010 UltraShimadzu (ЭУ, 70 эВ).
Спектры ЯМР 1Н растворов веществ в ДМСО-d 6 получены на спектрометре Bruker (400 МГц), внутренний стандарт ТМС.
7-Аллилтеофиллин (2а) . Получен по методу [15].
7-Металлилтеофиллин (2b). В 10 мл ДМФА растворить 0,36 г (0,002 моль) теофиллина и 0,41 г (0,003 моль) безводного карбоната калия при нагревании. Затем добавить 0,20 мл (0,002 моль) аллибромида и нагревать в течение 6 ч на водяной бане с обратным холодильником, охладить раствор, отфильтровать и испарить растворитель. Выход: 70 %. Т пл = 72–74 ºС. Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , м.д., J /Гц): 1,69 (3Н, с, CH 3 ), 3,21 (3Н, с, CH 3 ), 3,43 (3Н, с, CH 3 ), 4,54 (1H, с, =CHH), 4,87 (1Н, с, =CHH), 4,84 (2Н, c NCH 2 ), 8,08 (1Н, c, H–8).
7-Пропаргилтеофиллин (2c). Получен по методу [13].
7-(2-(4-бромфенил)-2-оксоэтил)теофиллин (2d). В 10 мл ДМФА растворить 0,36 г (0,002 моль) теофиллина и 0,41 г (0,003 моль) безводного карбоната калия при нагревании. Затем добавить 0,55 г (0,002 моль) п -Br-фенацилбромида и кипятить в течение 6 ч с обратным холодильником, охладить раствор, отфильтровать и испарить растворитель. Выход: 35 %. Т пл = 200–202 ºC (лит 201–203 ºC)
7-(2-Бромэтил)теофиллин (2е). Получен по методу [19].
7-(2-Гидроксиэтил)-теофиллин (2f). Получен по методу [22].
Взаимодействие теофиллина с 2,2’-дихлордиэтиловым эфиром. В 10 мл ДМФА растворить 0,36 г (0,002 моль) теофиллина и 0,41 г (0,003 моль) безводного карбоната калия при нагревании. Затем добавить 0,23 мл (0,002 моль) 2,2’-дихлордиэтилового эфира и нагревать в течение 8 ч на водяной бане с обратным холодильником, охладить раствор, отфильтровать и испарить растворитель. Остаток обработать ацетонитрилом и отфильтровать. После испарения ацетонитрила остается смесь 7-[2-(2-хлорэтокси)этил]теофиллина (2g) и 7-[2-(2- гидроксиэтокси)этил]теофиллин (2h). Общий выход: 67 %.
-
7,7'-Этан-1,2-диилбис(теофиллин) (3). Получен по методу [23].
7-(2,3-Дибромпропил)-теофиллин (4). В 5 мл ледяной уксусной кислоты растворить 0,22 г (0,001 моль) 7-аллилтеофиллина. В 1 мл ледяной уксусной кислоты растворить 0,10 мл брома (0,002 моль). Влить раствор брома по каплям в раствор теофиллина и оставить на сутки. После испарения уксусной кислоты растворить остаток в ацетоне и отфильтровать, после испарения ацетона остается оранжевое масло. Выход: 62 %.
Выводы
Изучено поведение при электронной ионизации 7-аллил-, 7-пропаргил-, 7-(2-(4-бромфенил)-2-оксоэтил)-, 7-металлил-, 7-(2-бромэтил)-, 7-(2-гидроксиэтил)-, 7-[2-(2-хлорэтокси)этил]-, 7-[2-(2-гидроксиэтокси)этил]-, 7-(2,3-дибромпропил)-теофиллинов и 7,7'-этан-1,2-диилбис(теофиллина). Алкилированием теофиллина впервые синтезированы 7-[2-(2-Хлорэтокси)этил]-, 7-металлил- и 7-[2-(2-гидроксиэтокси)этил]теофиллины. При взаимодействии 7-аллилтеофиллина с бромом получен 7-(2,3-дибромпропил)-теофиллин. В масс-спектрах всех изученных соединений присутствуют пики, характерные для фрагментации теофиллина. Характерной особенностью масс-спектров изученных N-производных теофиллина является элиминирование молекул метилизоцианата, монооксида углерода и цианистого водорода.
Статья выполнена при финансовой поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г., соглашение № 02.A03.21.0011) и в рамках государственного задания (номер 4.9665.2017/8.9).
Список литературы Исследование n-алкильных производных теофиллина методом хроматомасс-спектрометрии
- Synthesis and physicochemical and biological properties of 8-amino-substituted 7-(2-aryl-2-oxoethyl)xanthines / N.I. Romanenko, M.V. Nazarenko, V.I. Kornienko, B.A. Samura // Pharmaceutical Chemistry Journal. - 2014. - V. 48, № 8. - P. 509-512.
- Synthesis and biological activity of 8-benzylidenehydrazino-3-methyl-7-b-methoxyethylxanthines / N.I. Romanenko, O.A. Pakhomova, D.G. Ivanchenko et al. // Pharmaceutical Chemistry Journal. - 2014. - V. 48, № 7. - P. 444-447.
- The synthesis and the biological evaluation of new thiazolidin-4-one derivatives containing a xanthine moiety / F.G. Lupascu, O.M. Dragostin, L. Foia et al. // Molecules. - 2013. - V. 8, № 18. - P. 9684-9703.
- Synthesis and biological activities of novel methyl xanthine derivatives / Ch. Youwei, W. Baolei, G. Yanjun et al. // Chemical Research in Chinese Universities. - 2014. - V. 30, № 1. - P. 98-102.
- Torres, A.C. Design of a new hypoxanthine biosensor: xanthine oxidase modified carbon film and multi-walled carbon nanotube/carbon film electrodes / A.C. Torres, M.E. Ghica, Ch.M.A. Brett // Analytical and Bioanalytical Chemistry. - 2013. - V. 405, № 11. - P. 3813-3822.
- Synthesis and antiaggregant activity of 8-substituted 1-alkyl-3-methyl-7-(1-oxothietan-3-yl)xanthines / Yu.V. Shabalina, F.A. Khaliullin, A.A. Spasov et al. // Pharmaceutical Chemistry Journal. - 2013. - V. 47, № 3. - P. 151-153.
- www.slovar.cc/med/sprav-lek/2519465.html
- Tanabe, T. The N-alkylation of xanthine derivatives with trialkyl phosphates / T. Tanabe, K. Yamauchi, M. Kinoshita // Bulletin of the Chemical Society of Japan. - 1976. - V. 49, № 11. - P. 3224-3226.
- Solid liquid phase transfer catalysis: alkylation of theophylline / G. Bram, Y. Bensaid, C. Combet-Farnoux et al. // Pharmazie. - 1986. - V. 41, № 6. - P. 431-432.
- Daly, J.W. Analogs of caffeine and theophylline: effect of structural alterations on affinity at adenosine receptors / J.W. Daly, W.L. Padgett, M.T. Shamim // Journal of Medicinal Chemistry. - 1986. - V. 29, № 7. - P. 1305-1308.
- Caffeine-Based Gold(I) N-Heterocyclic carbenes as possible anticancer agents: synthesis and biological properties / B. Bertrand, L. Stefan, M. Pirrotta et al. // Inorganic Chemistry. - 2014. - V. 53, № 4. -P. 2296-2303.
- Lysakowska, M. Design, synthesis, antiviral, and cytostatic evaluation of novel isoxazolidine analogs of homonucleotides / M. Lysakowska, J. Balzarini, D.G. Piotrowska // Archiv der Pharmazie. - 2014. -V. 347, № 5. - P. 341-353.
- Design, synthesis, anticancer, antimicrobial activities and molecular docking studies of theophylline containing acetylenes and theophylline containing 1,2,3-triazoles with variant nucleoside derivatives / R.R. Ruddarraju, A.Ch. Murugulla, R. Kotla et al. // European Journal of Medicinal Chemistry. - 2016. - V. 123. - P. 379-396.
- ‘Click Synthesis' of 1H-1,2,3-triazolyl-based oxiconazole (=(1Z)-1-(2,4-dichlorophenyl)-2-(1H-imidazol-1-yl)ethanone O-[(2,4-Dichlorophenyl)methyl]oxime) analogs / S. Rad, M. Navid, A. Zeinab et al. // Helvetica Chimica Acta. - 2011. -V. 94, № 12. - P. 2194-2206.
- Click reaction based synthesis, antimicrobial, and cytotoxic activities of new 1,2,3-triazoles / M.R. Sayed Aly, S. Hosam Ali, M. Mosselhi, A. Mosselhi // Bioorganic and Medicinal Chemistry Letters. - 2015. - V. 25, № 14. - P. 2824-2830.
- 1,4-Dihydroxyanthraquinone-copper(II) nanoparticles immobilized on silica gel: a highly efficient, copper scavenger and recyclable heterogeneous nanocatalyst for a click approach to the three-component synthesis of 1,2,3-triazole derivatives in water / S. Hashem, K. Abbas, D. Mohammad Mahdi, Kh. Reza // Journal of the Iranian Chemical Society. - 2012. - V. 9, № 2. - P. 231-250.
- Copper/graphene/clay nanohybrid: a highly efficient heterogeneous nanocatalyst for the synthesis of novel 1,2,3-triazolyl carboacyclic nucleosidesvia‘click'huisgen1,3-dipolar cycloaddition / N.S.R. Mohammad, B. Somayeh, J. Hoseini et al. // Helvetica Chimica Acta. - 2015. -V. 98, № 9. - P. 1210-1224.
- Reactions of xanthinium N(7)-ylides with olefinic dipolarophiles / M. Hori, T. Kataoka, H. Shimizu et al. // Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry. - 1987. - P. 1211-1220.
- New antihistamines: substituted piperazine and piperidine derivatives as novel H1-antagonists / M. Abou-Gharbia, J.A. Moyer, S.T. Nielsen et al. // Journal of Medicinal Chemistry. - 1995. - V. 38, № 20. - P. 4026-4032.
- Ing-Jun Ch., Cho-Jan L. Theophylline-based soluble guanylyl cyclase activators KMUP-1 analogues enhanced cyclic GMP and K+ channel activities on rabbit corpus cavernosum smooth muscle and intercavernous pressure activities. Patent US, no. 209243; 2005.
- Penny, J. Synthesis and characterization of novel 1,2,3- triazole-linked theophylline and coumarin S-triazines / J. Penny, T. Mohit, R.S. Diwan // Indian Journal of Chemistry - Section B Organic and Medicinal Chemistry. - 2014. - V. 53, № 3. - P. 311-318.
- Bayer, F. Verfahren zur darstellung oxalkylsubstituierter derivate von xanthinbasen. Patent DE, no. 193799, 1906.
- Itahara, T. Preparation and NMR study of 7,7′-(α,ω-alkanediyl)bis[theophylline], 1,1′-(α,ω-alkanediyl)bis[theobromine], and 1,1′-(α,ω-alkanediyl)bis[3-methyluracil] / T. Itahara, K. Imamura // Bulletin of the Chemical Society of Japan. - 1994. - V. 67, № 1. - P. 203-209.
- Chou, Ch.-H. Isolation and identification by mass spectrometry of phytotoxines in coffea Arabica / Ch.-H. Chou, G.R. Waller // Bot. Bull. Academia Sinica. - 1980. - № 21. - P. 25-34.
- Фролова, Т.В. Синтез тиазолопиримидиновых и пиримидотиазиновых систем гетероциклизацией S- и N-производных 2-тиоурацилов: дис. … канд. хим. наук / Т.В. Фролова. - Челябинск, 2016. - 150 с.


