Исследование остеопластических свойств биоминерала костной ткани
Автор: Ирьянов Юрий Михайлович, Ирьянова Татьяна Юрьевна, Дюрягина Ольга Владимировна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2012 года.
Бесплатный доступ
Цель исследования - морфологический анализ остеопластической эффективности биоминерала костной ткани (БКТ), полученного без применения термической и деминерализующей обработки, и изучение механизмов репаративного костеобразования при имплантации БКТ в костные дефекты. Экспериментально-морфологическое исследование выполнено на 30 половозрелых крысах линии Wistar в контрольной и опытной группах, у которых создавали перфорационные дефекты в проксимальной трети диафиза большеберцовой кости. В опытной группе в область дефекта вводили имплантат – гранулированный БКТ. Оперативные вмешательства проводили под общей анестезией. В сроки 1, 2 и 3 недели животных выводили из эксперимента. Оперированные кости фиксировали и заливали в парафин и аралдит. Гистологические срезы окрашивали гематоксилином-эозином и пикрофуксином по Ван Гизону. Химический состав и микрорельеф поверхности гранул БКТ исследовали при помощи электронно-зондового микроанализатора и сканирующего электронного микроскопа, определяли интенсивность костеобразовательного процесса и степень зрелости новообразованной костной ткани в регенерате. Результаты проведенного исследования свидетельствуют, что при имплантации БКТ в костные дефекты обеспечивается интенсивный ранний ангиогенез, происходит активизация репаративного посттравматического костеобразования, ускоряется ремоделирование и органотипическое восстановление поврежденной кости.
Биоминерал кости, имплантат, остеопластика, дефект кости, репаративное костеобразование
Короткий адрес: https://sciup.org/142121603
IDR: 142121603
Текст научной статьи Исследование остеопластических свойств биоминерала костной ткани
Разработка, получение и экспериментальноклиническая апробация остеопластических имплантационных материалов с комплексом заданных свойств (биоактивность, биосовместимость, биорезистентность, остеоиндукция, остеокондук-ция и др.) остается одной из наиболее актуальных проблем современной ортопедии и травматологии [1, 2, 7, 8, 17]. В настоящее время часто используемыми остеопластическими материалами являются деминерализованный костный матрикс, трехмерные матрицы из полимолочных и полигликолевых кислот, коллагеновые криогели, стеклокристаллические материалы – биостекла и биоситаллы, аналоги костного минерала – гидроксиапатит, трикальций фосфат, а также полисахариды природного происхождения [1, 7, 8, 9, 14]. При изучении отдаленных результатов установлено, что имплантаты из биоинертных материалов: керамических структур, оксида циркония, алюминия, гидроксилапати-та и других не остеоинтегрируются, а окружаются фиброзной капсулой, формирующейся на границе «костная ткань – имплантат», вне зависимости от того, использовали плотный или пористый материал [10, 11, 12, 15]. В связи с этим в последнее время предпочтение на рынке медицинских остеопластических биоматериалов отдается имплантатам, полученным из биологических, природных структур – из аллокости и костей крупного рогатого скота [9, 10, 13]. Однако при их изготовлении используется термическая обработка и воздействие агрессивными жидкостями – пергидролем, концентрированными кислотами и щелочами, под действием которых неизбежно нарушается структура, пористость и химический состав минерального матрикса костной ткани, что делает поверхность материала существенно ограничивающей адгезию остеогенных клеток и отрицательно сказывается на клинических результатах имплантации [1, 8, 16].
Цель настоящей работы – морфологический анализ остеопластической эффективности биоминера- ла костной ткани (БКТ), полученного без примене- и изучение особенностей репаративного костеобра- ния термической и деминерализующей обработки, зования при имплантации БКТ в костные дефекты.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на 30 половозрелых крысах линии Wistar массой 340-390 г. Были сформированы 2 группы животных по 15 крыс в каждой – контрольная и опытная. Обе группы животных содержались в одинаковых условиях вивария на стандартном рационе. В условиях операционной с использованием общей анестезии (рометар 8 мг и золетил 4 мг на 1000 г массы тела внутримышечно) в проксимальной трети диафиза обеих большеберцовых костей у животных контрольной и опытной групп осуществляли моделирование несквозных дефектов глубиной 2,5-3 мм с проникновением в костномозговой канал, путем односторонней перфорации кортикального слоя спицей диаметром 1,5 мм. В опытной группе непосредственно после операции в область сформированного дефекта вводили стерильный биоматериал – гранулированный БКТ массой 2 мг. БКТ получали из аллогенных трубчатых костей по оригинальной технологии без применения термической и деминерализующей обработки [5, 6]. С целью более полного заполнения дефектов костей и улучшения процессов репаративного костеобразования проводили измельчение БКТ до порошкообразного состояния. Использовали БКТ в виде пористых гранул, размер которых составлял 50-200 мкм (рис. 1).
Микрорельеф поверхности гранул БКТ исследовали в сканирующем электронном микроскопе.
При помощи метода спектрального рентгеновского электронно-зондового микроанализа в составе гранул БКТ измеряли содержание натрия, магния, фосфора, серы и кальция.
В сроки 2, 5, 7, 14 и 21 сутки животных выводили из эксперимента. Оперированные голени вычленяли в коленных и голеностопных суставах. Большеберцовые кости вместе с параоссаль-ными тканями фиксировали в 2 % растворе параформальдегида и глутаральдегида и заливали в парафин и аралдит. Парафиновые срезы окрашивали гематоксилином-эозином и пикрофуксином по Ван Гизону. Часть материала исследовали при помощи сканирующего электронного микроскопа JSM-840 и электронно-зондового микроанализатора INCA-200. Активность костеобразовательного процесса определяли по содержанию в регенерате мягкотканых (неминерализованных) компонентов и костной ткани. По отношению этих показателей (концентрация костной ткани / концентрация мягкотканых компонентов) рассчитывали индекс компактности. В костной ткани определяли концентрацию остеоида и минерализованного матрикса. Результаты количественных исследований обрабатывали методами вариационной статистики. Эксперименты выполнялись с соблюдением этических норм и правил гуманного обращения с животными в соответствии с требованиями нормативных документов [3].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
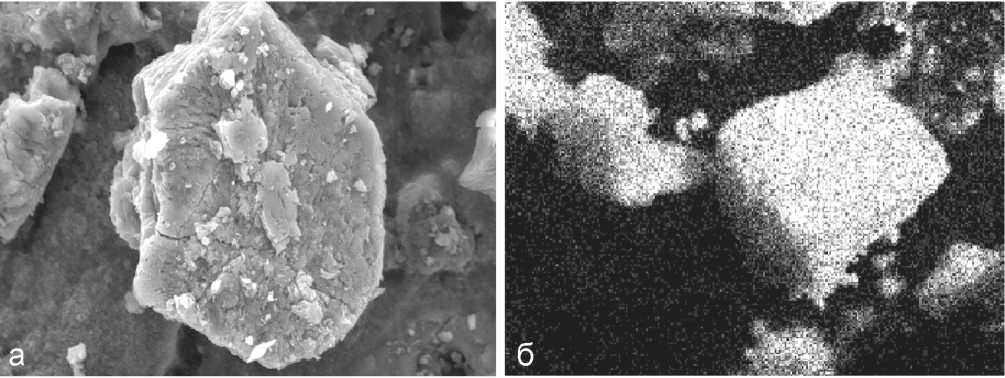
Исследования, выполненные при помощи сканирующей электронной микроскопии, показали, что микрорельеф поверхности гранул БКТ характеризуется резко выраженной шероховатостью и наноструктурированностью, наличием множества макро- и микропор неправильной формы и различного размера, некоторые из которых имеют размеры менее 100 нм. Поры соответствуют местам локализации костных лакун и костных канальцев, из которых клетки и другие органические компоненты были удалены при получении БКТ. Установлено, что имплантируемые гранулы БКТ сохраняют естественную остеоархитектонику (рис. 1, 2).
50мкт
1ООмкт
Рис. 1. Имплантируемые гранулы БКТ: а – изображение во вторичных электронах, сканирующая электронная микроскопия; б – распределение кальция в образце гранул БКТ, изображение в характеристическом рентгеновском излучении кальция, карта электроннозондового микроанализа

Рис. 2. Микрорельеф поверхности гранул БКТ характеризуется наличием шероховатости, наноструктурированности, макро- и микропор. Сохраняется естественная остеоархитектоника. Сканирующая электронная микроскопия
Изучение содержания основных макроэлементов костной ткани в составе гранул БКТ: натрия (0,44±0,02 %), магния (0,35±0,01 %), фосфора (13,59±0,65 %), серы (0,28±0,01 %) и кальция (26,76±1,33 %) показало, что минеральный состав имплантируемых гранул соответствует показателям коркового слоя диафиза большеберцовой кости интактных взрослых крыс [4]. Величина коэффициента Са/Р, отражающая качественный состав апатита в имплантируемых гранулах БКТ - 1,97±0,11, меньше чем у кристаллического гидроксилапатита, что подтверждает литературные данные [8, 10], свидетельствующие, что минерализованный матрикс интактных костей не является аналогом стехиометрического гидроксилапатита – Са10[РО4]6[OH]2, а представляет собой даллит – карбоксигидрок-силапатит – Са5[РО4]х[СO3]3ОН – с лабильной структурой поверхностного слоя аморфного апатита. Наши исследования показали, что образование в биологической среде организма этого поверхностного карбонатапатитного слоя на порах гранул БКТ, обладающего более выраженной, по сравнению с натуральной костью, интенсивностью обмена ионов, обеспечивает аффинитет к костной ткани регенерата, ее врастание и плотный контакт с поверхностью имплантируемых гранул и образование остеоинтегративного соединения.
Гистологические исследования показали, что через 2-5 суток после операции в обеих группах животных в зоне повреждения выявляются альте-ративно-деструктивные изменения, и возникает острая воспалительная реакция. Обнаруживаются очаги организованной гематомы, инфильтрированной сгустками фибрина, малодифференцированными клеточными элементами, нейтрофильными гранулоцитами, макрофагами, тучными клетками и экстравазальными эритроцитами и лимфоцитами. Выявляются лейкоцитарно-некротические массы, содержащие лизированные клетки и пласты фибрина. Клеточные элементы воспаления и осколки кости, образовавшиеся при операции, формируют центрально расположенный очаг воспаления, на месте которого к 7 суткам развертываются восстановительные процессы, наблюдается репаративное костеобразование по типу интрамембранного остеогенеза и формируется регенерат, постепенно заполняющий перфорационную полость (рис. 3). Через 7 суток после операции в регенерате контрольных животных четко выделяются две зоны – периферическая и центральная. В периферической зоне наблюдается новообразование грубоволокнистой костной ткани, которая в контрольной группе образует к этому сроку лишь небольшие костно-остеоидные островки и единичные тонкие трабекулы (рис. 3, а), репаративное костеобразование при этом развивается от периферии к центру (центростремительно). В центральной зоне регенерата в контрольной группе наблюдается малодифференцированная соединительная ткань с признаками отека, содержащая немногочисленные кровеносные сосуды, экссудат и клеточный детрит. В опытной группе животных в периферической зоне регенерата формируется обширная мелкопетлистая сеть утолщенных трабекул, покрытых рядами многочисленных остеобластов, формирующих губчатую кость, тесно спаянную с поверхностью компактного вещества (рис. 3, б), в центральной зоне регенерата выявляются многочисленные костные трабекулы, остеобластические и фибробластические элементы и значительное количество расширенных и заполненных кровью сосудов. У животных опытной группы клеточно-волокнистые элементы воспаления не выявляются, репаративное костеобразование в регенерате формируется по всему поперечнику дефекта и развивается как в центробежном направлении, так и центростремительно. Вокруг гранул БКТ определяются зоны активного аппозиционного костеобразования. В этих участках отсутствуют геморрагии и очаги деструкции, отмечается активная пролиферация фибробластов и преостеобластов, интенсивный неоангиогенез, на поверхности гранул формируется слой остеогенных клеток, остеоидной ткани и костного матрикса. Объем костной ткани (как остеоида, так и минерализованного матрикса) в регенерате животных опытной группы существенно увеличен (Р<0,01) по сравнению с контрольными показателями (рис. 4). Индекс компактности увеличивается с 0,09±0,001 в контрольной группе до 0,21±0,002 в опытной (Р<0,001), что свидетельствует об увеличении степени зрелости новообразованной костной ткани в опыте.
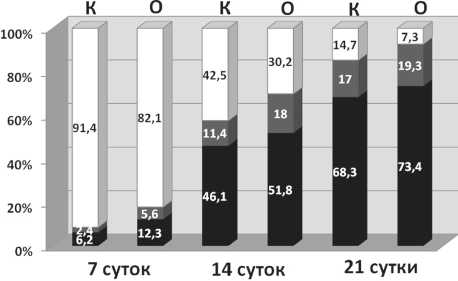
Рис. 4. Доля различных тканевых компонентов в составе регенерата, формирующегося после перфорационной травмы большеберцовой кости крыс, в контроле (К) и опыте (О) через 7, 14 и 21 сутки после операции. Белый цвет – неминерализованные компоненты; темносерый – остеоидная ткань; черный – матрикс костной ткани
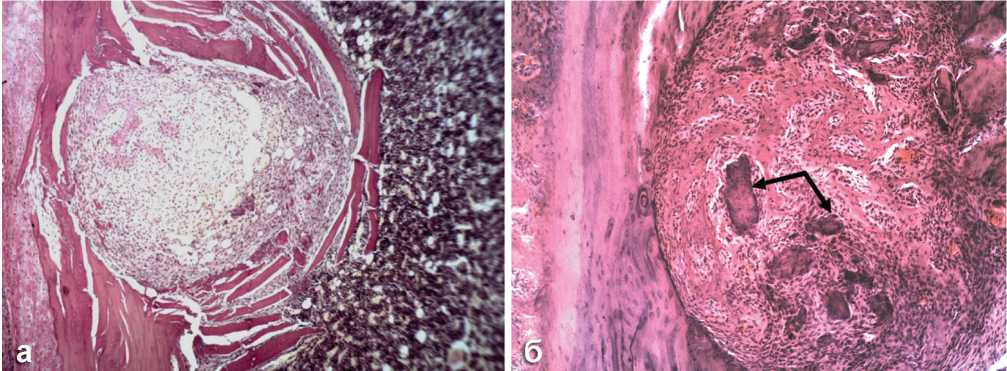
Рис. 3. Регенерат в перфорационной полости большеберцовой кости крыс через 7 суток после операции: а - в контрольной группе костно-остеоидные трабекулы формируются на периферии регенерата, остеогенез развивается от периферии к центру; б - в опытной группе костеобразование идет по всему объему дефекта, костно-остеоидные трабекулы заполняют всю перфорационную полость. Стрелками обозначены гранулы БКТ. Окраска гематоксилином-эозином. Об. 10, ок. 10
Через 14-21 сутки после операции объем костной ткани в регенерате существенно возрастает в обеих группах, но наиболее значительно – в опытной (рис. 4, 5). Индекс компактности в этот период составляет через 14 суток 1,35±0,06 в контроле и 2,31±0,1 – в опыте (Р<0,01); через 21 сутки – 5,8±0,2 в контроле и 12,7±0,5 в опыте (Р<0,001). В регенерате опытной группы животных на этом этапе эксперимента наблюдается фаза органогенеза и ремоделирования, о чем свидетельствует перестройка первичных трабекул в органотипические остеонные структуры и многочисленность спайных линий. По краю дефекта определяются массивные напластования пластинчатой костной ткани и аппозиционный остеогенез (рис. 5, 6). Перфорационное отверстие закрывается новообразованной пластинчатой костной тканью с признаками резорбции. Кровеносные сосуды микроцир-куляторного русла, остеогенные клетки и костные структуры не только прилежат к поверхности гранул БКТ, но и врастают в них (рис. 7), что обеспечивается остеокондуктивными и остеоиндук-тивными свойствами БКТ благодаря локализации в минерализованном матриксе остеоиндукторов – факторов роста и костных морфогенетических белков, выделяющихся при остеокластической резорбции [1, 8]. Благодаря остеоиндукционным свойствам большинство пор гранул БКТ через 14 суток после операции заполняется остеогенными клетками, формирующими костную ткань внутри имплантата по типу интерстициального остеогенеза, что обеспечивает приобретение имплантатом и остеогенных свойств. В регенерате часто обнаруживаются остеоцитарные лакуны характерного строения, одной из стенок которых является поверхность гранул имплантата. Пустые остеоци-тарные лакуны немногочисленны. Среди трабекул пластинчатой костной ткани видны замурованные в костную ткань остатки гранул БКТ. Это свидетельствует, что темп биодеградации имплантата соответствует скорости регенерации кости. В контрольной группе формирование тканевоспецифического костного регенерата в области дефекта происходит медленнее и в более поздние сроки, наблюдается лишь постепенное преобразование балочных структур грубоволокнистой костной ткани в более минерализованные и зрелые.
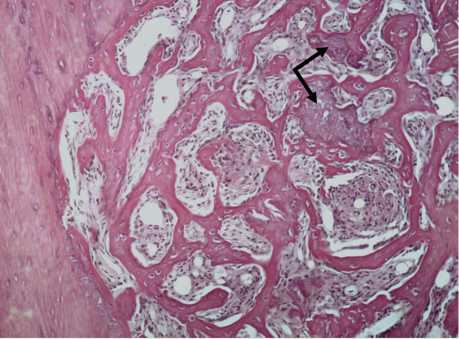
Рис. 5. Регенерат в перфорационной полости большеберцовой кости крысы опытной группы через 14 суток после операции. Костеобразование идет по всему объему дефекта. Аппозиционный рост пластинчатой костной ткани у края дефекта. Гранулы БКТ (стрелки) замурованы в костные структуры. Окраска гематоксили-ном-эозином. Об. 10, ок. 10
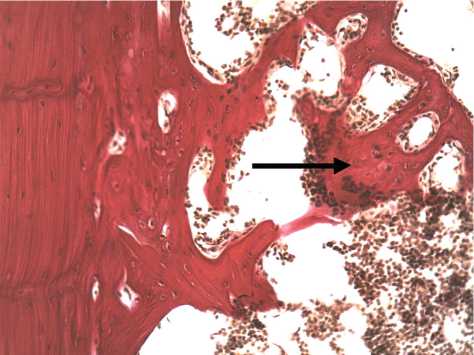
Рис. 6. Участок регенерата животного опытной группы через 21 сутки после операции. Компактизация пластинчатой костной ткани с формирующимися органотипическими структурами (остеонами) и ее слияние с компактным веществом края дефекта. В губчатой кости центральной зоны регенерата образуются очаги гемопоэза. Вокруг гранулы БКТ (стрелка), замурованной в костные структуры, развивается интенсивная клеточно-пролиферативная реакция. Окраска по Ван Гизону. Об. 20, ок. 10
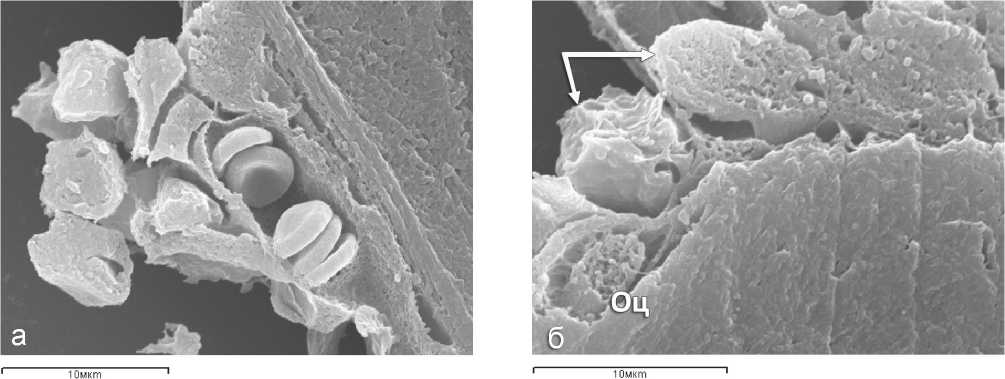
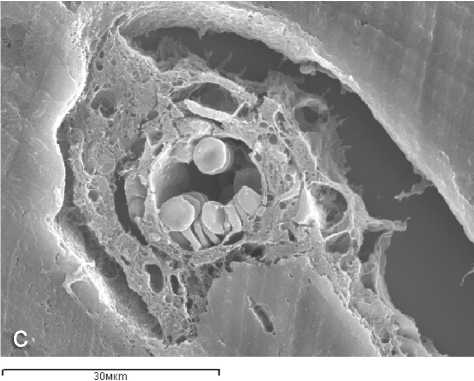
Рис. 7. Взаимодействие имплантируемых гранул БКТ с костно-сосудистыми структурами: а, б – 14 суток, в – 21 сутки после операции; а - адгезия на поверхности гранулы капиллярных почек, периваскулярных остеогенных клеток и остеобластов, формирование слоев остеоида, связанных с материалом имплантата; б – крупные остеобласты (стрелки), активно образующие костный матрикс и матриксные везикулы, часть остеобластов замуровывается и превращается в остеоциты (Оц), локализованные непосредственно на поверхности гранулы БКТ; в – врастание остеогенных и сосудистых элементов в трехмерную пористую структуру имплантата БКТ. Сканирующая электронная микроскопия
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали, что высокопористые матриксы БКТ, полученные без воздействия высоких температур и деминерализующих агентов, имеют трехмерную структуру взаимосвязанных пор, сохраняют естественную остеоархитектонику, химический состав и структуру, аналогичную минеральной фазе кости и обеспечивают аффинитет к костной ткани и наиболее благоприятные условия для функционирования остеогенных клеток. Шероховатость и наноструктурированность поверхности обеспечивает оптимальные отношения между уровнем адгезии, темпами пролиферации и степенью дифференциации остеогенных клеток.
При имплантации в зону дефекта кости гранул БКТ наблюдается пролонгированная активизация репаративного костеобразования, глубокое прорастание костной ткани в имплантат, ускоряется процесс ремоделирования регенерата и сокращаются сроки заживления поврежденной кости. Относительная атравматичность оперативного вмешательства, простота технологии заготовки и консервации имплантационного материала, осте-окондуктивные и остеоиндуктивные свойства, характерный темп биодеградации, соответствующий скорости репаративного костеобразования, отсутствие биологической реакции отторжения ставят исследованный биоматериал в ряд наи- более оптимальных костнопластических материалов, особенно в условиях уменьшения индивидуального остеогенетического потенциала у пациентов зрелого и пожилого возраста. Таким образом, применение БКТ в качестве стимулятора остеогенеза представляется теоретически обоснованным и перспективным.


