Исследование острой токсичности аэрозоля нанодисперсного оксида марганца для прогнозирования опасности здоровью работающих и населения при ингаляционной экспозиции
Автор: Зайцева Н.В., Землянова М.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования для оценки риска в гигиене и эпидемиологии
Статья в выпуске: 1 (21), 2018 года.
Бесплатный доступ
Объектом исследования являлся нанодисперсный оксид марганца, синтезированный при взаимодействии ионов Mn2+ и MnO4- в присутствии нанореакторов - мицелл цетилтриметиламмония бромида, которые не входили в состав конечного продукта. Методами сканирующей электронной микроскопии, рентгенофазового анализа, динамического лазерного светорассеяния, Брунауэра, Эммета, Тейлора и Баррета, Джойнера и Халенды подтверждено, что синтезированное вещество является наноматериалом с размером сечения частиц игольчатой формы преимущественно 13-29 нм (95,6 % от общего количества частиц). Оценка острой ингаляционной токсичности проведена в соответствии с положениями «Методы испытания по воздействию химической продукции на организм человека. Острая ингаляционная токсичность - метод определения класса острой токсичности (метод ATC)» (OECD, Test № 436: 2008, IDT). Показано, что синтезированный нанодисперсный оксид марганца обладает острой токсичностью при ингаляционном поступлении в виде аэрозоля. CL50 при 4-часовой экспозиции для крыс самцов и самок линии Wistar массой тела 190 ± 10 г и составляет 120 мг/м3. Клиническая картина острой интоксикации характеризуется раздражающим, нейротоксическим эффектами действия, угнетением дыхания. По критерию CL50 (>50-500) мг/м3 тестируемое вещество относится к веществам 2-го класса опасности (в соответствии с международной системой классификации и маркировки химических веществ (GHS) и к веществам 1-го класса опасности (в соответствии с ГОСТ 12.1.007.76. Классификация и общие требования безопасности). Полученные параметры острой ингаляционной токсичности нанодисперсного оксида марганца свидетельствуют об опасности его негативного воздействия на здоровье при экспонировании работающих в процессе производства и населения селитебных территорий, а также необходимости разработки мер безопасности.
Нанодисперсный оксид марганца, аэрозоль, ингаляционная экспозиция, концентрация частиц, токсичность, опасность для здоровья
Короткий адрес: https://sciup.org/142212865
IDR: 142212865 | УДК: 615.9, | DOI: 10.21668/health.risk/2018.1.10
Текст научной статьи Исследование острой токсичности аэрозоля нанодисперсного оксида марганца для прогнозирования опасности здоровью работающих и населения при ингаляционной экспозиции
Наноразмерные частицы оксида марганца – перспективный наноматериал для создания высокотехнологичных компонентов, используемых в современных отраслях отечественной промышленности – наноэлектронике, нанооптике, нанохимии. В связи с этим в последнее десятилетие отмечается активный рост производства и потребления продукции, использующей в качестве одного из компонентов нано-дисперсный оксид марганца. Данное вещество широко применяется при производстве полу- проводниковых термисторов [1], солнечных батарей, различных электроприборов, катодных катализаторов, наномагнитных и сорбирующих материалов [2]. Специфичной и перспективной областью применения является создания сенсорных электродов и биосенсоров, для которых могут быть использованы нитевидные частицы оксида марганца [3].
Результаты исследований Hussan, Stefanes-cu, Frick [4–6] позволяют предположить, что в определенных условиях наночастицы оксида
марганца при их ингаляционном поступлении в организм могут вызывать негативные последствия для здоровья, в том числе токсического характера. Имеются данные об усилении после 24-часовой экспозиции каталитической генерации активных форм кислорода (АФК) в альвеолярных эпителиальных клетках человека [6]. Обнаружено увеличение уровня на 30 и 80 % внеклеточной и внутриклеточной окисленной формы глутатина (GSSG) соответственно [4]. Elder et al. и Oberdorster [7, 8] описывают условия, при которых наночастицы оксида марганца размером до 30 нм проявляют способность проникать по обонятельному нерву в нейроноподобные клетки PC-12 головного мозга, а также накапливаться в астроцитах, других клетках головного мозга [8, 9]. В экспериментах исследователи наблюдали незначительное угнетение митохондриальной деятельности с дозозависимым снижением содержания дофамина и его метаболитов: дигидроксифенилуксусной кислоты и гомованилиновой кислоты. Показано, что установленным явлениям сопутствуют значительное увеличение АФК [5, 10], нейродегенератив-ные нарушения уже через 2–3 недели экспозиции [7, 8], активация протеолитического расщепления, опосредованного каспазой-3 и проте-инкиназой Сδ (ферментами, участвующими в процессах апоптоза, некроза и воспалительных процессах). Показана и активация цикла фосфорилирования [10–13]. Crittenden и Filipov [14] описали, что рост концентрации частиц наноксида марганца вызывает линейное увеличение уровня p38 мутагенактивной проте-инкиназы. Последняя, в свою очередь, является пусковым механизмом апоптоза, преждевременной клеточной гибели. Elder et al. [7] указали на факты, свидетельствующие о том, что при воздействии вещества в среднем мозге и полосатом теле, в обонятельной луковице и лобной коре вдвое усиливается экспрессия гена фактора некроза опухоли-α. Установлено, что длительная ингаляционная экспозиция наночастиц оксида марганца формирует активацию белка трансферрина в дофаминергических нервных клетках. Выявлены также структурные изменения в белках Beclin 1 и LC3, что, в свою очередь, может указывать на потенциальную активацию процесса аутофагии [5].
В связи с этим для массового и эффективного внедрения перспективных технологий использования наноразмерного оксида марганца в промышленном производстве вопросы обеспечения безопасности работающих и населения являются актуальным. При этом особую значимость приобретает задача изучения параметров токсичности аэрозоля нанодисперсного оксида марганца при ингаляционном поступлении в организм [15].
Материалы и методы. Эксперимент проводили на водной суспензии нанодисперсного оксида марганца, синтезированной прямым взаимодействием ионов Mn2+ и MnO 4 с применением мицелл цетилтриметиламмония бромида (СТАВ, C 16 H 33 (CH 3 ) 3 NBr) как нанореакторов [16]. Навеску СТАВ растворяли в спирте при комнатной температуре в течение 30 минут при интенсивном перемешивании (CTAB/EtOH = 1:10). В спиртовый раствор CTAB добавляли водный раствор 0,4 М MnSO 4 ⋅ 5H 2 O. Смесь постоянно перемешивали в течение 24 часов и по каплям медленно вводили в нее 0,05 М водный раствор KMnO4. Полученную смесь еще в течение суток перемешивали до завершения реакции. Темно-коричневый осадок промывали дистиллированной водой. Цетилтриметиламмония бромид удаляли экстракцией этанолом. Степень экстракции – не менее 98 %. Остаточную концентрацию цетилтриметиламмония бромида после экстракции определяли методом хромато-масс-спектрометрии с тандемным детектором Agilent. Матриксом суспензии являлась бидистиллированная вода, соответствующая ТУ 6-09-2502-771.
Размер и форму частиц оксида марганца в водной суспензии оценивали методом динамического лазерного светорассеяния на анализаторе Horiba LB-550 (Horiba, Япония) (отдел химико-аналитических методов исследования ФНЦ медико-профилактических технологий управления рисками здоровью населения), методом электронной микроскопии на сканирующем микроскопе высокого разрешения (3–10 нм, максимальное увеличение 300000Х) S-3400N (HITACHI, Япония) с приставкой для рентгеновского энергодисперсионного микроанализа (Bruker, Германия) (кафедра химической технологии ФГБОУ ВО «Пермский национальный исследовательский политехнический университет»).
Текстурные параметры определяли сорбцией азота при температуре -196 ° С на приборе ASAP 2020 (Micromeritics, США) после дегазации исследуемого материала в вакууме в течение 3 часов. Удельную площадь поверхности образцов ( S BET ) рассчитывали по методу, предложенному Брунауэром, Эмметом и Тейлором [17]. Общий объем пор ( Vtot ) рассчитывали из количества азота, адсорбированного при относительном давлении р / р 0 ≈ 0,99. Распределение пор по размерам определяли по изотермам десорбции, используя метод Баррета, Джойнера и Халенды [18]. Структуру образца исследовали методом рентгенофазового анализа на дифрактометре XRD-7000, Shimadzu, в условиях Cu K a -излучения в интервале углов 2а = 1-8 ° .
Массовую концентрацию оксида марганца в суспензии определяли с помощью масс-спектрометрии с индуктивно связанной плазмой (приборное обеспечение – Agilent 7500cx с окто-польной реакционной/столкновительной ячейкой). Газ-реактант – гелий. Перед выполнением измерений с помощью ультразвукового гомогенизатора Sonopuls Hd 3200, фирма Bandelin, проводили диспергирование вещества с целью разрушения агрегатов и агломератов, возможно, образовавшихся в результате старения образца. Равномерного распределения частиц в объеме добивались непрерывной пульсацией в течение 2 минут при комнатной температуре.
Оценку острой токсичности нанодисперс-ного оксида марганца при ингаляционном поступлении в виде аэрозоля проводили в порядке, установленном ГОСТ 32646-20142. Острый эксперимент осуществляли на половозрелых крысах самцах и самках линии Wistar с массой тела 190 ± 10 г. Все животные содержались по две особи в клетках стандартного размера из полипропилена. До начала эксперимента был выдержан 14-дневный карантин. Виварий был оборудован вентиляцией, температура воздуха поддерживалась на уровне 23,0 ± 2,0 °C, влажность – на уровне 60,0 ± 5,0 %. Животные были обеспечены полноценным полусинтети-ческим рационом питания. Доступ к пище и воде не ограничивали. Все исследования и процедуры строго соответствовали принципам и стандартам Европейской конвенции по защите позвоночных животных3, что контролировалось этическим комитетом научного центра, на базе которого проводились исследования.
Ингаляционное поступления наноксида марганца обеспечивали в ингаляционной системе с камерой для всего тела типа TSE Systems GmbH и интегрированным программным модулем. Предотвращение заглатывания частиц примеси с поверхности тела достигалось размещением экспериментальных животных специальных индивидуальных домиках. Экспериментальные животные составили две опытные группы, в каждой их которых было по три самки и три самца. Ингаляционная экспозиция первой опытной группы составила 4 часа при концентрации оксида марганца 0,05 мг/дм3; второй группы также 4 часа, но при концентрации примеси на уровне 0,5 мг/дм3. Приток и отток воздуха в ингаляционную камеру осуществляли со скоростью 10 л/мин. Скорость подачи суспензии в генератор аэрозоля составила 0,014 мл/мин и 0,17 мл/мин соответственно. Это позволяло создать в камере равномерную циркуляцию вещества. Давление внутри камеры поддерживалось на уровне – 0,2 ± 0,2 миллибара. Температуру обеспечивали порядка 22-25 ° С. Уровень содержания кислорода в камере составлял около 19 %, углекислого газа – не более 1 %.
Реально создаваемую концентрацию оксида марганца в ингаляционной камере оценивали методом масс-спектрометрии с индуктивно связанной плазмой на приборе Agilent 7500cx. Отбор проб воздуха проводили со скоростью 0,5 л/мин в течение 5 минут через 2 и 4 часа экспозиции на фильтр АФА-ВГ-10-1 со скоростью 2 л/мин в течение 5 минут. Определение количества наночастиц в камере (концентрации) выполнено с использованием диффузионного аэрозольного спектрометра, произведенного ООО «АэроНаноТех» (Россия).
Корма во время экспозиции экспериментальные животные не получали.
По завершении экспозиции за животными наблюдали в течение четырех дней, принимая во внимание эффекты возможной отложенной токсичности. Класс опасности по критерию средней смертельной концентрации вещества
(CL 50 ) определяли по показателям гибели животных с применением алгоритма, представленного в ГОСТ 32646-20141, а также в соответствии с ГОСТ 12.1.007.764.
Результаты и их обсуждение. Исследование суспензии образца в концентрации 36,0 ± ± 2,3 мг/мл с остаточным содержанием CTAB в суспензии ниже порога определения (0,00001 мг/мл) показало, что распределение частиц по размеру, соответствующего размеру поперечного сечения, имеет следующий вид: 13 нм (1,2 % от общего количества частиц), 15–29 нм (94,3 % от общего количества частиц), 33–87 нм (4,1 % от общего количества частиц). Наибольшая доля в суспензии приходится на частицы размером 19 ± 4 нм (41,2 % от общего количество) (табл. 1).
По результатам сканирующей электронной микроскопии установлено, что визуализируемые частицы (частицы более 20 нм) в основном имеют нитевидную форму (97,8 % от общего количества видимых частиц).
Изотерма адсорбции – десорбции азота соответствует IV типу (изотерма с четко выраженной капиллярной конденсацией). Форма петли гистерезиса принадлежит к Н3-типу с выраженной областью заполнения мезопор в интервале относительных давлений ( р/р 0 ) 0,7–1,0. Заполнение мезопор в области более высоких относительных давлений подтверждает присутствие мезопор крупного диаметра (рис. 2). Удельная площадь поверхности частиц нанодисперсного оксида марганца составила 150,23 м2/г, общий объем пор – 0,676 см3/г. По данным рентгенофазового анализа установлено отсутствие упорядоченной структуры мезопор (рис. 3).

Рис. 1. Изображение частиц нанодисперсного оксида марганца методом сканирующей электронной микроскопии
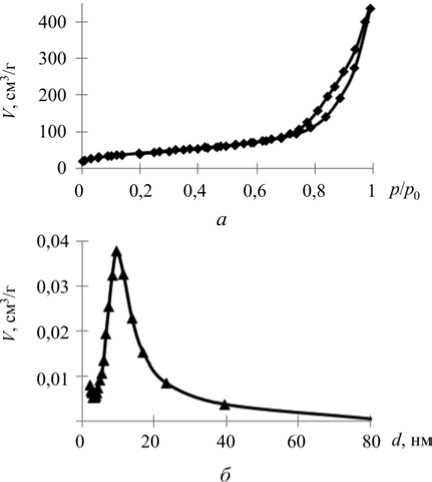
Рис. 2. Изотерма адсорбции – десорбции азота ( а ) и распределение пор по размерам d (нм) ( б ) нанодисперсного оксида марганца
Таблица 1
Дисперсность наночастиц оксида марганца в водной суспензии
|
Размер частиц в суспензии, мкм |
Доля частиц, % |
Размер частиц в суспензии, мкм |
Доля частиц, % |
|
0,0131 |
1,2 |
0,0387 |
0,38 |
|
0,0150 |
9,6 |
0,0443 |
0,64 |
|
0,0171 |
16,4 |
0,0507 |
0,90 |
|
0,0196 |
20,0 |
0,0581 |
0,73 |
|
0,0225 |
21,2 |
0,0666 |
0,42 |
|
0,0257 |
13,9 |
0,0762 |
0,39 |
|
0,0295 |
13,2 |
0,0873 |
0,15 |
|
0,0338 |
0,44 |
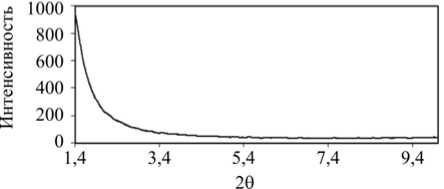
Рис. 3. Рентгенограмма нанодисперсного оксида марганца
Данные по физическим параметрам наночастиц оксида марганца, синтезированных методом темплатного синтеза, соответствовали характеристикам, требуемым для создания сенсорных электродов [3], и корректного моделирования острой ингаляционной экспозиции.
Данные аналитических измерений свидетельствовали, что при задаваемой концентрации оксида марганца 0,05 мг/л в ингаляционной камере формируется фактическая концентрация на уровне 0,029 ± 0,001 мг/дм3, при задаваемой концентрации 0,6 мг/л – 0,472 ± 0,005 мг/л. Результаты измерения количества наночастиц в воздухе камеры показали, что при подаче в камеру нанодисперсная фракция, переходя в аэрозоль, не агломерирует до микрометрового диапазона (табл. 2). Наибольшее количество частиц при исследованных фактических концентрациях через 2 и 4 часа экспозиции не превышало размерности 100 нм.
Клиническая картина эффектов на начальном этапе острой интоксикации аэрозолем на-нодисперсного оксида марганца в фактической концентрации 0,029 ± 0,001 мг/л характеризовалась появлением у всех животных чихания, кашля, прозрачных отделений из носа, что свидетельствовало о раздражением дыхательных путей. С третьего по четвертый час экспозиции у животных регистрировали учащенное дыхание, отдышку. При этом исследователи регистрировали у животных участие в акте дыхания вспомогательной мускулатуры, вынужденную позу (выгибание спины, наклон головы и т.п.). С четвертого часа экспозиции у животных отмечали развитие угнетенного состояния с симптомами заторможенности, отсутствием реакции на звуковые раздражители, нарушением координации движения. В течение 24 часов после экспозиции у экспериментальных животных фиксировали дрожь тела, отсутствие двигательной активности, крайне слабую реакцию на звуковые раздражители, отказ от корма и воды. Через 72 часа после ингаляционного воздействия признаков угнетенного состояния не наблюдалось, животные поедали корм. Однако отмечено, что двигательная активность и реакция на звуковые раздражители были снижена. Гибели животных в эксперименте за период 96 часов наблюдения не зарегистрировано.
Клиническая картина интоксикации животных в условиях воздействия аэрозоля нанодис-персного оксида марганца в фактической концентрации 0,472 ± 0,005 мг/л была несколько иной. Так, дыхательная недостаточность была отмечена уже с 30-й минуты экспозиции, Через 3 часа были отмечены угнетение дыхания и гибель животных. Зафиксировано, что перед принятием бокового положения животные были заторможены, реакция на звуковые раздражители и двигательная активность отсутствовали. 83 % экспонированных животных гибли в период 150–190 минут от начала эксперимента (табл. 3).
Таблица 2
Результаты исследований концентрации и размера частиц нанодисперсного оксида марганца в воздухе ингаляционной камеры
|
Показатель |
Исходный уровень |
Через 2 часа экспозиции |
Через 4 часа экспозиции |
|
Концентрация оксида марганца, мг/дм3 |
0,002 |
0,456 |
0,472 |
|
Концентрация частиц при 0–20 нм, ед./дм3 |
63 |
10421 |
9980 |
|
Концентрация частиц при 20–40 нм, ед./дм3 |
48 |
35 930 |
31 207 |
|
Концентрация частиц при 40–60 нм, ед./дм3 |
42 |
35 602 |
36 783 |
|
Концентрация частиц при 60–80 нм, ед./дм3 |
22 |
26 370 |
25 809 |
|
Концентрация частиц при 80–100 нм, ед./дм3 |
8 |
17 783 |
14 320 |
Таблица 3
Динамика гибели экспериментальных животных при исследовании острой ингаляционной токсичности аэрозоля водной суспензии нанодисперсного оксида марганца
|
Группа животных |
Фактическая концентрация, мг/л |
Число животных в группе, абс. |
Сроки наблюдения в сутках (часах) |
Число погибших животных |
||||
|
1 (1) |
2 (2) |
3 (3) |
4 (6) |
абс. |
% |
|||
|
№ 1 |
0,029 ± 0,001 |
6 |
0/6 |
0/6 |
0/6 |
0/6 |
0 |
0 |
|
№ 2 |
0,472 ± 0,005 |
6 |
0/6 |
0/6 |
5/6 |
6/6 |
6 |
100 |
В соответствии с процедурой оценки параметры острой ингаляционной токсичности CL50 исследованного нанодисперсного оксида марганца приняли на уровне 120 мг/м3. Данная концентрация укладывается в диапазон 50–500 мг/м3, что позволяет отнести исследуемое вещество – наноразмерный оксид марганца – к веществам 2-го класса опасности по Международной системе классификации и маркировки химических веществ (GHS) и к веществам 1-го класса опасности в соответствии с ГОСТ 12.1.007.763.
В процессе производства сенсорных электродов и аккумуляторных батарей применение в качестве активной матрицы нитевидных частиц нанодисперсного оксида марганца рассматривается как высокоперспективное направление. Применение вещества обусловливает его вероятное появление в воздухе рабочей зоны и дальнейшее распространение на прилегающие территории. Это определяет опасность ингаляционной экспозиции работников, занятых на производстве, и населения селитебных территорий.
Полученные в рамках исследования результаты свидетельствуют о способности исследуемых наноразмерных частиц оксида марганца вызывать негативные эффекты: раздражающий, нейротоксический, угнетение дыхания, сочетание которых могло обусловить гибель животных.
Наличие токсического эффекта вещества в отношении клеток нервной системы, развития негативных нейропсихологических эффектов при низкодозовом воздействии доказано как для наночастиц оксида марганца, так и для его микродисперсного аналога [10, 12, 19]. В основе нейротоксического механизма действия может лежать нарушение функций мембран нейронов в результате перекисного окисления мембранных липидов, вызванного прямым цитотоксическим действием наночастиц, установленным для дофаминэргических нейронов [10, 12, 20]. Данный эффект у нанодисперсных частиц может быть более выраженным по сравне- нию с действием микродисперсного аналога в связи с большей удельной площадью поверхности нанодисперсных частиц. Клиническая картина острой интоксикации подтверждает описанный механизм токсического действия нанодисперсных частиц оксида марганца в ранее проведенных исследованиях [21]. Развитие дыхательной недостаточности может быть связано с потенциальной возможностью исследуемых наночастиц вызывать воспалительные изменения с последующим апоптозом альвеолярных эпителиоцитов. При этом, обладая большей резистентностью к мукоцилиарному удалению, наноразмерные частицы оксида марганца более длительно контактируют с клетками дыхательных путей по сравнению с микро-дисперсным аналогом [22]. По величине CL50, равной 120 мг/м3, нанодисперсный оксид марганца относится к веществам 2-го класса опасности в соответствии с Международной классификацией опасности химических соединений [23] и к веществам 1-го класса опасности в соответствии с ГОСТ 12.1.007.763.
Выводы. Нанодисперсный оксид марганца с размером сечения частиц нитевидной формы преимущественно 13–29 нм обладает острой токсичностью при ингаляционном поступлении в виде аэрозоля. CL 50 при 4-часовой экспозиции для крыс линии Wistar составляет 120 мг/м3. Клиническая картина острой ингаляционной экспозиции характеризуется раздражающим, нейротоксическим эффектами действия, угнетением дыхания. Нейротоксический эффект сохраняется у выживших экспериментальных животных через 92 часа после экспозиции. Таким образом, можно отнести нанодисперсный оксид марганца ко 2-му классу опасности (по критерию CL 50 ) в соответствии с Международной классификацией опасности химических соединений (GHS) и к 1-му классу опасности в соответствии с ГОСТ 12.1.007.763.
Список литературы Исследование острой токсичности аэрозоля нанодисперсного оксида марганца для прогнозирования опасности здоровью работающих и населения при ингаляционной экспозиции
- Портативный источник тока: патент Российской Федерации № 2396638/Л.И. Трусов, В.П. Федотов, Л.Б. Красько, В.А. Гринберг, А.М. Скундин. Заявка 2009117282/09 от 07.05.2009; опубликовано 10.08.2010 . -URL: http://bd.patent.su/2396000-2396999/pat/servl/servlet9ef1.html (дата обращения: 10.11.2009).
- Manganese Oxide Nanoparticles/Nanopowder //American Elements. -URL: http://www.americanelements.com/mnoxnp.html (дата обращения: 23.12.2017).
- Донцова Е.А. Сенсорные электроды на основе наночастиц диоксида марганца: дис. … канд. хим. наук. -М., 2011. -170 с.
- Neurotoxicity of manganese oxide nanomaterials/D. Stefanescu, A. Khoshnan, P. Patterson, J. Hering//Journal of Nanoparticle Research. -2009. -Vol. 8, № 11. -P. 1957-1969.
- Hussan S.M. The interaction of manganes nanoparticles with pc-12 cells induces dopamine depletion//Toxicol. Science. -2006. -Vol. 92, № 2. -P. 456-463.
- Comparison of manganese oxide nanoparticles and manganese sulfate with regard to oxidative stress, uptake and apoptosis in alveolar epithelial cells/R. Frick, B. Müller-Edenborn, A. Schlicker, B. Rothen-Rutishauser//Toxicol Lett. -2011. -№ 205. -P. 163-172.
- Translocation of Inhaled Ultrafine Manganese Oxide Particles to the Central Nervous System/A. Elder, R. Gelein, V. Silva, T. Feikert, L. Opanashuk, J. Carter, R. Potter, A. Maynard, Y. Ito, J. Finkelstein, G. Oberdörster//Environ. Health Perspectives. -2006. -№ 114. -P. 1172-1178.
- Oberdorster G., Sharp Z., Atudorei V. Translocation of inhaled ultrafine particles to the brain//Inhal. Toxicol. -2004. -№ 16. -P. 437-445.
- Prise en charge du manganisme d’origine professionnelle: Consensus d’un groupe d’experts: rapport IRSST, № 416/C. Ostiguy, P. Asselin, S. Malo, D. Nadeau//IRSST. -Montreal, 2005. -62 p.
- Expression changes of dopaminergic system-related genes in PC12 cells induced by manganese, silver, or copper nanoparticles/J. Wang, M. Rahman, H. Duhart, G. Newport//NeuroToxicology. -2009. -№ 30. -Р. 926-933.
- General and electrophysiological toxic effects of manganese in rats following subacute administration in dissolved and nanoparticle form /E. Horváth, Z. Máté, S. Takács, P. Pusztai//The Scientific World Journal. -2012. -URL: http://dx.doi.o (дата обращения: 23.12.2017) DOI: rg/10.1100/2012/520632
- Manganese nanoparticle activates mitochondrial dependent apoptotic signaling and autophagy in dopaminergic neuronal cells/N.H. Afeseh, A. Kanthasamy, Y. Gu, N. Fang//Toxicol. Appl. Pharmacol. -2011. -№ 256. -P. 227-240.
- Oberdorster G. Nanotoxicology: Am Emerging Discipline Evolving from Studies of Ultrafine Particles//Environmental Health Perspective. -2005. -№ 7. -P. 823-839.
- Crittenden P.L., Filipov N.M. Manganese-induced potentiation of in vitro proinflammatory cytokine production by activated microglial cells is associated with persistent activation of p38 MAPK//Toxicology in Vitro. -2008. -№ 22. -P. 18-27.
- Исследование острой токсичности нанодисперсного оксида марганца при ингаляционном поступлении/Н.В. Зайцева, М.А. Землянова, В.Н. Звездин, Т.М. Акафьева, Е.В. Саенко//Российские нанотехнологии. -2015. -Т. 10, № 5-6. -С. 117-122
- Meynen V., Cool P., Vansant E.F. Verified syntheses of mesoporous materials//Microporous and mesoporous materials. -2009. -№ 125. -P. 170-223.
- Грег С., Синг К. Адсорбция, удельная поверхность, пористость. -М.: Мир, 1984. -306 с.
- Barrett E.P., Joyner L.G., Halenda P.P. The Determination of Pore Volume and Area Distributions in Porous Substances. I. Computations from Nitrogen Isotherms//J. Am. Chem. Soc. -1951. -Vol. 73. -P. 373-380.
- Neuropsychological Effects of Low-Level Manganese Exposure in Welders/W. Laohaudomchok, X. Lin, R.F. Herrick, Sh.C. Fang, J.M. Cavallari //Neurotoxicology. -2011. -Vol. 32, № 2. -P. 171-179.
- Effects of Nano-MnO2 on Dopaminergic Neurons and the Spatial Learning Capability of Rats/T. Li, T. Shi, X. Li, S. Zeng, L. Yin, Y. Pu//Int. J. Environ. Res. Public Health. -2014. -№ 11. -P. 7918-7930 DOI: 10.3390/ijerph110807918
- Токсиколого-гигиеническая оценка безопасности нано-и микродисперсного оксида марганца (III, IV)/Н.В. Зайцева, М.А. Землянова, В.Н. Звездин, Е.В. Саенко, А.В. Тарантин, Р.Р. Махмудов, О.В. Лебединская, С.В. Мелехин, Т.И. Акафьева//Вопросы питания. -2012. -Т. 81, № 5. -С. 13-19.
- Subacute intratracheal exposure of rats to manganese nanoparticles: behavioral, electrophysiological, and general toxicological effects/L. Sárközi, E. Horváth, Z. Kónya, I. Kiricsi//US National Library of Medicine. -2009. -№ 1. -P. 83-91 DOI: 10.1080/08958370902939406
- Globally Harmonized System of Classification and Labelling of Chemicals (GHS). -New York, Geneva, 2011. -568 p.


