Исследование процесса охлаждения крови крупного рогатого скота
Автор: Антипов С.Т., Овсянников В.Ю., Корчинский А.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Процессы и аппараты пищевых производств
Статья в выпуске: 1 (71), 2017 года.
Бесплатный доступ
Совершенствование техники и технологии по переработки вторичного сырья мясной промышленности является актуальной задачей. Одним из важнейших методов, при переработке крови крупного рогатого скота (КРС) является воздействие низких температур, применяемое как для консервирования крови посредством замораживания, так и ее концентрирование методом вымораживания влаги. В связи с этим в статье рассматривается исследование процесса охлаждения крови КРС, позволяющее наиболее полно произвести оценку процессов и явлений, протекающих в крови под воздействием низкой температуры. Рассмотрены особенности исследования процесса снижения температуры, базирующийся на основных положениях термического анализа. В результате проведения эксперимента получены зависимости, отражающие характер изменения температуры образца крови КРС и эталонного элемента, позволяющие с достаточной точностью регистрировать особенности фазовых явлений, наблюдаемых в указанной биотехнологической среде. Показано, что кристаллизация влаги в крови, являющейся сложным многокомпонентным раствором, обусловливается наличием эвтектических соединений, возникающих при снижении температуры и выделении воды в виде чистого льда. Руководствуясь температурными зависимостями, получили информативные данные о необходимом энергетическом потенциале для реализации процессов охлаждения и замораживания. Объяснены особенности механизма замораживания льда в исследуемой крови с точки зрения молекулярно-кинетической теории движения молекул. Проведенные исследования позволили определить энергию активации процессов кристаллизации влаги в исследуемой крови крупного рогатого скота.
Кровь, охлаждение, энергия активации
Короткий адрес: https://sciup.org/140229710
IDR: 140229710 | DOI: 10.20914/2310-1202-2017-1-11-14
Текст научной статьи Исследование процесса охлаждения крови крупного рогатого скота
Одной из важнейших задач при исследовании физико-химических явлений, происходящих при охлаждении в жидкостях, является проведение термографического анализа, позволяющего регистрировать фазовые превращения по сопровождающим их тепловым эффектам [1, 2].
Метод термографии позволяет изучить химические и физические процессы как обратимые, так и необратимые, сопровождающиеся поглощением или выделением теплоты, фиксируемой на кривой охлаждения в виде эндотермических или экзотермических явлений, в случае их отсутствия дифференциальная кривая выглядит в виде прямой линии, называемой нулевой линией. При регистрации тепловых эффектов общепринято изображать отклонение
кривой охлаждения вниз от нулевой линии в случае эндотермического процесса и вверх при экзотермических [1–3].
Метод дифференциального термического анализа (ДТА) базируется на сравнении тепловых характеристик образца исследуемого вещества и инертного, с точки зрения фазовых переходов, вещества, используемого в качестве эталона. При этом регистрируемым параметром служит разность их температур, измеряемая при охлаждении образца и эталонного вещества с постоянной скоростью. Как правило, изменения температуры образца обусловлены физическими или химическими превращениями, связанными с изменением теплосодержания. При реализации метода, температуры образца и эталона обозначаются соответственно T и T/, а регистрируемыми
параметрами является разность температур T–T/, температура образца и время. При этом в дифференциальном методе регистрирующие термопары соединены встречно, поэтому незначительная разница между T и T/ вызывает возникновение разности потенциалов, которая достаточно точно регистрируется специальными приборами. Высокая чувствительность описанного метода позволяет изучать тепловые превращения, оперируя образцами малого объема, что подчеркивает достоинство указанного метода.
Эвтектические точки сложных растворов при замораживании отличны от эвтектических точек отдельных чистых компонентов раствора [7–10]. Для таких растворов имеется эвтектическая температурная зона, в пределах которой и происходит кристаллизация влаги. Определение таких температурных зон для любых материалов, подвергающихся замораживанию и вымораживанию влаги, крайне необходимо для правильного выбора режимных параметров. Жидкие биотехнологические среды, являющихся сложными биологическими системами, в которых эвтектическая температура так же определяется не однозначно, но может быть представлена в виде совокупности точек фазового превращения [3].
Материалы и методы исследования
Проведено экспериментальное определение эвтектических температурных зон для крови крупного рогатого скота (КРС) и сконцентрированной крови КРС методом дифференциального термического анализа. Эвтектические температурные зоны определялись для исследуемых сред при их замораживании.
В исследуемых образцах крови КРС и сконцентрированной крови КРС рефрактометрическим методом определяли содержание сухих веществ, которые составили: для крови КРС – 19,0%, а для сконцентрированной крови КРС 31,7%. Исследование процесса замораживания проводили в интервале температур 258–298 К. Регистрацию температур осуществляли при помощи универсального микропроцессорного двухканального измерителя-регулятора температур марки ТРМ 202, оснащенного набором хромель-копелевых термопар. Полученные значения температур представлены в графической форме на рисунках 1 –2.
Дифференциально-термический анализ проводили следующим образом. В морозильную камеру холодильной установки, имеющей температуру 247 К, помещали равные мерные объемы (30 мл) исследуемого вещества и эталонного вещества – обезвоженного глицерина, теплофизические характеристики которого близки к характеристикам исследуемых веществ в исследуемом температурном диапазоне.
Полученные результаты и их обсуждение
Процесс замораживания исследуемых веществ характеризуется наличием нескольких резких изменений направления кривой дифференциальной записи температур, отражающих температуры фазовых переходов, обозначенных участками простой записи: а – переохлаждение среды; a - b – образование зародышей кристаллов льда и начало кристаллизации; b - с - d – дальнейшая интенсивная кристаллизация влаги; d - f – охлаждение закристаллизовавшегося эвтектического раствора [4–6].
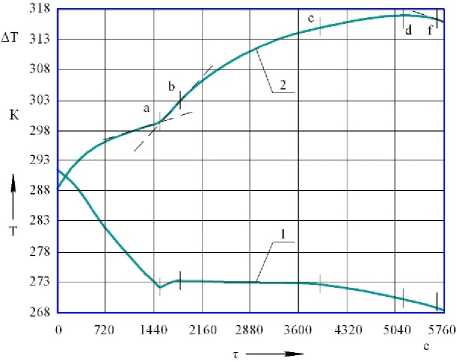
Рисунок 1. Термограмма замораживания крови КРС с содержанием сухих веществ С св = 19,0%: 1 – показания термопары; 2 – показания дифференциальной термопары
-
Figure 1. The thermogram of freezing of blood of cattle with the content of dry substances Ссв = 19,0%: 1 – indication of the thermocouple; 2 – differential thermocouple readings
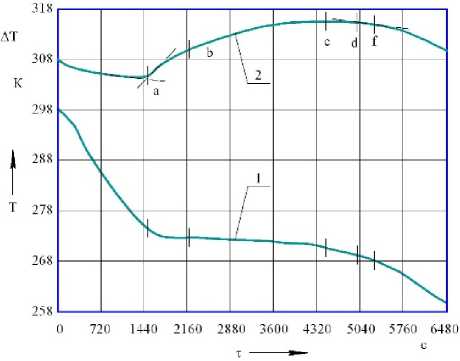
Рисунок 2. Термограмма замораживания сконцентрированной крови КРС с содержанием сухих веществ С св = 31,7%: 1 – показания термопары;
2 – показания дифференциальной термопары
-
Figure 2. Thermogram of freezing of concentrated blood of cattle with dry matter content С св = 31,7%: 1 – indication of thermocouple; 2 – differential thermocouple readings
Значения температур, соответствующие началу и окончанию выделенных интервалов на дифференциальной кривой представлены в таблице 1.
Таблица 1. Значения температур, соответствующие характерным точкам на дифференциальной кривой
Table 1.
The temperature values corresponding to the characteristic points on the differential curve
|
Точка Dot |
Кровь КРС Cattle Blood |
Сконцентрированная кровь КРС Concentrated blood of cattle |
|
a |
272,1 |
270,6 |
|
b |
273,2 |
276,8 |
|
c |
272,6 |
272,9 |
|
d |
270,2 |
270,2 |
|
f |
268,7 |
268,1 |
Проведенный анализ показывает, что дифференциальная термограмма замораживания отражает наиболее полно картину фазовых переходов влаги в исследуемых образцах [7]. При замораживании в связи с переохлаждением полная кристаллизация влаги в биотехнологической среде достигается при температуре значительно более низкой, чем температура эвтектической концентрации. Проведенный термографический анализ для всех исследуемых образцов крови КРС и сконцентрированной крови КРС позволил достаточно точно выявить экзотермические процессы при кристаллизации влаги [8, 9].
Температурные зоны, выявленные посредством метода дифференциального термического анализа, характеризующие определенные фазовые переходы в процессе кристаллизации влаги, показали, что теплофизический характер этого процесса сложный. Процесс замораживания среды в зависимости от ее вида, содержания сухих веществ и химического состава происходит при различных температурах и с различной интенсивностью.
Заключение
Образование кристаллической фазы в жидких биотехнологических средах может быть интерпретирован с точки зрения кинетической теории как процесс упорядочения взаимно ориентированных молекул при понижении температуры. Процесс упорядочения молекул воды и внедрение их в кристаллическую решетку льда принимает замедляющийся характер в процессе вымерзания влаги и постепенного повышения концентрации растворенных веществ. При этом характерно повышение затрат энергии, пропорциональное увеличению степени упорядочения молекул воды и росте кристаллов льда [10].
В начале процесса кристаллизации влаги происходит отклонение дифференциальной кривой. Таким образом, начальный участок отклонения кривой отражает начальную стадию процесса упорядочения молекул и зарождение центров кристаллизации. Температура процесса определяется по началу и концу прямолинейного отклонения дифференциальной записи. Затем процесс кристаллизации ускоряется, достигая наибольшей интенсивности, где постепенно нарастает количество ориентированных молекул, стабилизируется состояние термодинамической устойчивости кристаллической решетки и осуществляется рост кристаллов. Далее процесс изменения разности температур практически полностью замедляется, что отвечает формированию эвтектической концентрации среды, после чего дифференциальная кривая записи температур вновь изменяет свое направление, характерное для процесса охлаждения эвтектической среды [10].
Используя полученные термографические кривые, для всех исследуемых образцов была найдена энергия активации процессов кристаллизации влаги, которая связана со значением дифференциальной температуры в области температур образца от температуры начала отклонения дифференциальной кривой температуры максимума отклонения дифференциальной кривой следующим уравнением:
In A T = C - —, (1) RT где AТ - дифференциальная температура, К; Т -абсолютная температура образца, К; С – постоянная; R = 8,326 Дж/(моль⋅К) – универсальная газовая постоянная; Е – энергия активации процесса, Дж/моль.
Приняв допущения, что кристаллизация влаги наступает в точке переохлаждения, обозначенной на дифференциальной кривой буквой а , уравнение (1) для процессов кристаллизации запишется следующим образом:
E = R ( In ( T c - T Hln ( T c - T, ) ) , (2)
T, ” F fa где Та, Тс и Тf – значения температур, соответствующие характерным точкам на кривой простой записи температуры при кристаллизации влаги в исследуемых биотехнологических средах, К.
При этом характерные точки начала и окончания процессов кристаллизации определялись как точки пересечения нулевых линий термограммы с продолжением прямолинейных участков экзотермических явлений. Абсолютные значения величин энергии активации, процессов кристаллизации влаги в исследуемых образцах, полученные в результате расчетов по формуле (2) составляют: для крови КРС – 342052,6 Дж/моль и сконцентрированной крови КРС – 161507,1 Дж/моль
Список литературы Исследование процесса охлаждения крови крупного рогатого скота
- Антипов С.Т. и др. Термодинамические особенности процесса концентрирования жидких сред вымораживанием//Современные наукоемкие технологии. 2014. № 5-1. С. 159.
- Антипов С. Т., Овсянников В. Ю., Кондратьева Я. И. Кинетика процесса концентрирования вымораживанием вишневого сока//Вестник ВГУИТ. 2014. № 4. С. 44-48.
- Caretta O. Courot F., Davies T. Measurement of salt entparmment during the directional solidification of brine under forced mass convection//J. of Crystal Crowth, 2016, с. 151-155.
- Habib B., Farid M. Heat transfer and operating for freeze concentration in a liquid-solid fluidized bed heat exchanger//Chemical Engineering and processing, 2015, Т. 45 с. 698-710.
- Kitazono Y., Ihara I., Yoshida G., Toyoda K., Umetsu K. Selective degradation of tetracycline antibiotics present in raw milk by electrochemical method.//J. Hazard. Mater. 2015. Т. 243. с. 112-116.
- Caretta O. Courot F., Davies T. Measurement of salt entparmment during the directional solidification of brine under forced mass convection//J. of Crystal Crowth, 2016, с. 151-155.
- Kitazono Y., Ihara I., Yoshida G., Toyoda K., Umetsu K. Selective degradation of tetracycline antibiotics present in raw milk by electrochemical method.//J. Hazard. Mater. 2015. Т. 243. с. 112-116.
- Braddock R. J., Marcy J. E. Quality of freeze concentrated orange juice//J. of Food Science, 2015, 52, с. 159-162.
- Hindmarsh J.С., Russell A. B. Chen X. D. Measuring dendritic growth in undercooled sucrose solution droplets//J. of Crystal Growth, 2015, Т. 285, с. 236-248.
- Okawa S. Ito T. Saito A. Effect of crystal orientation on freeze concentration of solutions//Intern. J. of Refrigerstion, 2016, Т. 32 с. 246-252.


