Исследование производных 8-аминохинолина методом хроматомасс-спектрометрии
Автор: Ким Дмитрий Гымнанович, Бердникова Елена Владимировна, Мосунова Татьяна Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.7, 2015 года.
Бесплатный доступ
Методом хроматомасс-спектрометрии установлено, что 8-аллиламинохинолин и 8-диаллиламинохинолин при нагревании претерпевают амино-перегруппировку Кляйзена с образованием 7-аллил-8 аминохинолина и 7-аллил-8-аллиламинохинолина соответственно. В масс-спектрах производных 8-аминохинолина имеются пики соответствующие молекулярному иону, хинолину и 8-аминохинолину.
8-аминохинолинн, 8-аллиламинохинолин, 8-диаллиламинохинолин, 8-ацетиламинохинолин, 8-аллилацетиламинохинолин, 2-метил-2, 3-дигидро-1h-пирроло[3, 2-h]хинолин, хроматомасс-спектрометрия, перегруппировка кляйзена
Короткий адрес: https://sciup.org/147160302
IDR: 147160302 | УДК: 547.831.6
Текст научной статьи Исследование производных 8-аминохинолина методом хроматомасс-спектрометрии
Производные 8-аминохинолина обладают противомалярийной, антимикробной, цитотоксической активностью [1–3]. В литературе имеются данные о синтезах производных 8-аминохинолина и их спектрах ЯМР. В то же время практически отсутствуют сведения об их масс-спектрах. В базе данных NIST имеется лишь масс-спектр 8-аминохинолина ( 1 ).
Целью данной работы является исследование 8-аллиламинохинолина ( 2 ), 8-диаллиламинохинолина ( 3 ), 8-ацетиламинохинолина ( 4 ), 8-аллилацетиламинохинолина ( 5 ), и 2-метил-2,3-дигидро-1 Н -пирроло[3,2- h ]хинолина ( 6 ) методом хроматомасс-спектрометрии (ХМС).
Обсуждение результатов
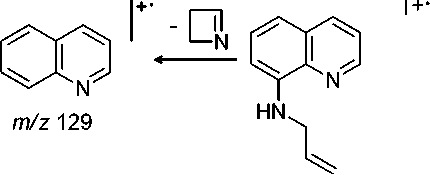
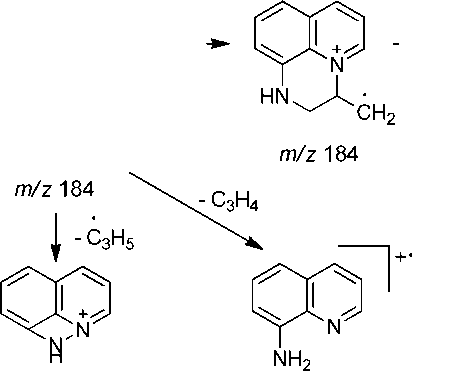
Ранее [4] было показано, что 8-аминохинолин ( 1 ) реагирует с аллилбромидом в присутствии щелочи с образованием смеси 8-аллиламинохинолина ( 2) (М=184) и 8-диаллиламинохинолина ( 3 ) (М=224). В настоящей работе эта смесь была исследована методом ХМС. На хроматограмме имеются 2 пика с m/z 184 и 2 пика c m/z 224. Это обусловлено тем, что при хроматографировании (температура инжектора 200 ° С) соединения 2 и 3 претерпевают частично перегруппировку Кляйзена с образованием 7-аллил-8-аминохинолина и 7-аллил-8-аллиламинохинолина соответственно (схема 1).
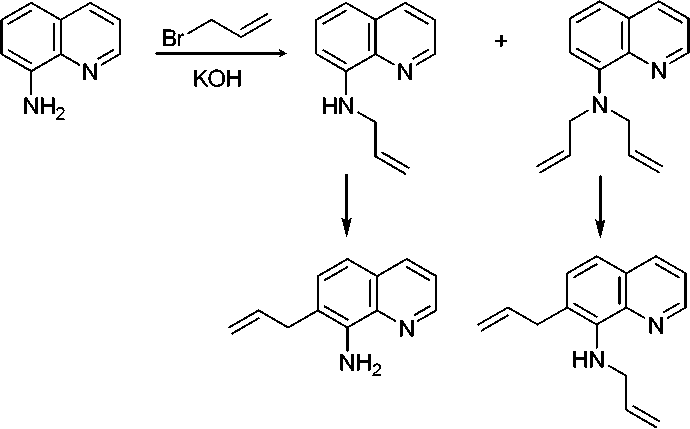
Схема 1. Аллилирование 8-аминохинолина
Известно, что N-метиланилин имеет меньшую температуру кипения, чем 2-метиланилин [5]. Это позволило нам предположить, что аллил 2 и диаллил 3 будут иметь меньшую температуру кипения, чем соответствующие продукты перегруппировки, т. е. меньшее время удерживания на хроматограмме.
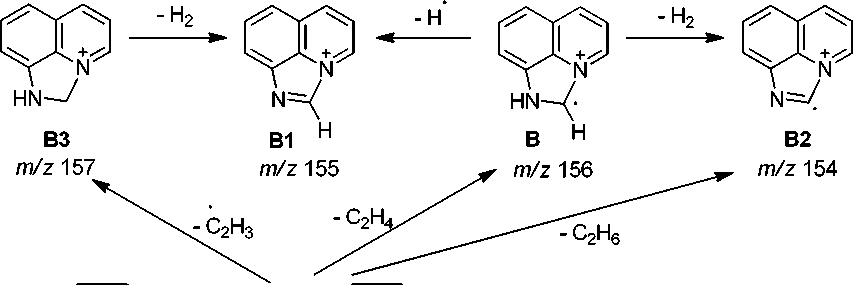
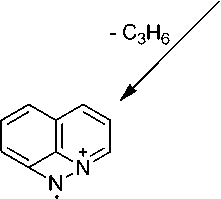
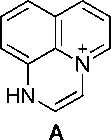
В масс-спектре аллиламина 2 (рис. 1, таблица) имеется пик молекулярного иона (М=184) и пики, соответствующие элиминированию нейтральных молекул этена, этана, пропена, аллена и радикалов метила, винила и аллила. Максимальным является пик [M-CH 3 ] + с m/z 169, соответствующий элиминированию метильного радикала и образованию ароматического катиона пирази-нохинолиния А . Пик с m/z 156 соответствует элиминированию молекулы этилена с образованием катион-радикала дигидроимидазо[5,4,3- ij ]хинолиния B , который в свою очередь при элиминировании атома водорода образует катион имидазохинолиния B1 , а при элиминировании молекулы водорода – катион-радикал имидазохинолиния B2 . При элиминировании винильного радикала образуется катион дигидроимидазо[5,4,3- ij] хинолиния B3 . Пики с m/z 142, 143 и 144 соответствуют элиминированию пропена, аллил-радикала и аллена и образованием катион-радикала[1,2]азетино[4,3,2- ij ]хинолиния, катиона 1 Н -[1,2]азетино[4,3,2- ij ]хинолиния и катион-радикала 8-аминохинолина соответственно (схема 2).
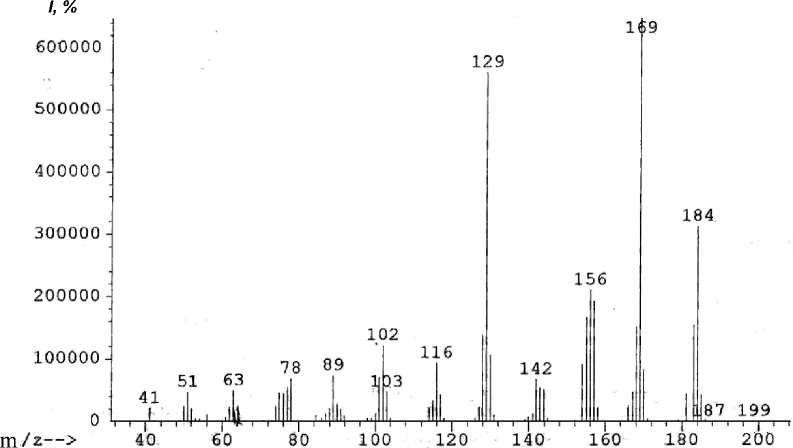
Рис. 1. Масс-спектр 8-аллилаинохинолина
Данные масс-спектров исследованных соединений
|
Соединение |
Характеристики ионов: m/z (I, %) |
|
2 (C 12 H 12 N 2 ) |
184 [M]+• (53), 183 [M–H]+ (28), 181 (8), 170 (13), 169 [M–CH 3 ]+ (100), 168 (25), 167 (8), 157 (30), 156 [M–C 2 H 4 ]+• (33), 155 (28), 154 (15), 144 [M–C 3 H 4 ]+• (9), 143 [M–C 3 H 5 ]+ (10), 142 [M–C 3 H 6 ]+• (13), 130 (18),129 [M–C 3 H 5 N]+• (90), 128 (25), 117 (8), 116 (15), 103 (8), 102 (19), 101 (11), 89 (11), 78 (10), 77 (9), 76 (8), 75 (8), 63 (9), 51 (9) |
|
3 (C 15 H 16 N 2 ) |
224 [M]+• (10), 184 (14), 183 [M–C 3 H 5 ]+ (100), 181 (13), 168 (15), 167 (8) 166 (9), 156 (9), 155 (10), 144 [C 9 H 8 N 2 ]+• (8), 129 [C 9 H 7 N]+• (21), 128 (11), 102 (10), 101 (6) |
|
4 (C 11 H 10 N 2 O) |
186 [M]+• (23), 183 (11), 171 [M–CH 3 ]+ (22), 145 (11), 144 [C 9 H 8 N 2 ]+• (100), 129 [C 9 H 7 N]+• (5), 117 (18), 116 (12), 101 (5), 90 (6), 89 (9), 63 (5), 43 (7) |
|
5 (C 14 H 14 N 2 O) |
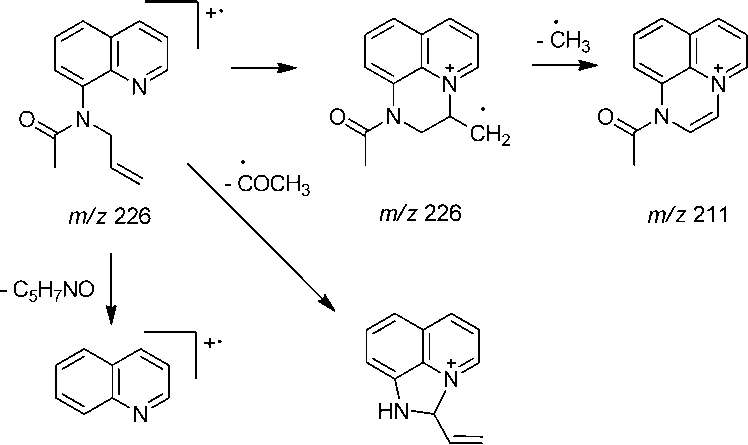
226 [M]+• (< 5), 211 [M–CH 3 ]+ (< 5), 184 (15), 183 [M–C 2 H 3 O]+ (100), 181 (10), 169 (25), 168 (19), 167 (31), 166 (7), 156 (11), 155 (14), 154 (11), 153 (9), 144 [C 9 H 8 N 2 ]+• (9), 142 (8), 130 (6), 129 [C 9 H 7 N]+• (34), 128 (12), 117 (5), 116 (6), 102 (11), 101 (8), 89 (5), 77 (6), 43 (12) |
|
6 (C 12 H 12 N 2 ) |
184 [M]+• (14), 183 [M–H]+ (100), 181 (12), 168 [M–CH 4 ]+• (12), 166 (6), 156 [M–C 2 H 4 ]+• (7), 155 (8), 154 (15), 144 [M–C 3 H 4 ]+• (7), 129 [M–C 3 H 5 N]+• (14), 128 (9), 102 (5), 91 (14) |
Пики с интенсивностью менее 5 % не учитывались.
Органическая химия
m/z 142
m/z 143
m/z 144
m/z 169
Схема 2. Основные процессы фрагментации 8-аллиламинохинолина
В масс-спектре 8-диаллиламинохинолина (рис. 2), в отличие от спектра 8-аминохинолина, максимальным является пик с m/z 183, соответствующий элиминированию аллильного радикала и образованию катиона 1-аллил[1,2]азетино[4,3,2- ij ]хинолиния (схема 3), а пик [M-CH 3 ]+ с m/z 209 составляет менее 5 %.
I, %
1500000 -
1000000 - m
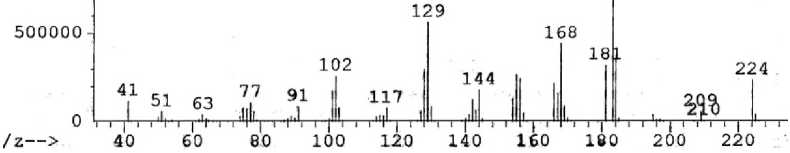
Рис. 2. Масс-спектр 8-диаллиламинохинолина
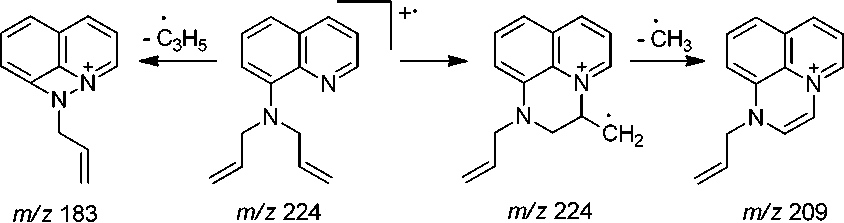
Схема 3. Основные процессы фрагментации 8-диаллиламинохинолина
8-Ацетиламинохинолин ( 4 ) получен ацетилированием 8-аминохинолина уксусным ангидридом. В масс-спектре ацетиламина 4 (рис. 3) максимальным является пик с m/z 144, соответствующий катион-радикалу 8-аминохинолина и образующийся при элиминировании кетена. Имеются пики, соответствующие элиминированию метильного радикала ( m/z 171) и азиридинона ( m/z 129) (схема 4).
I, %
200000 -
150000 -
100000-
50000 -I
m
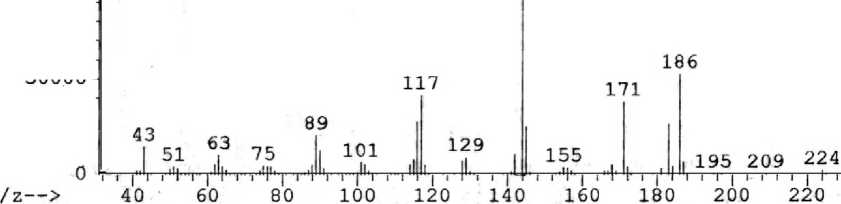
Рис. 3. Масс-спектр 8-ацетиламинохинолина
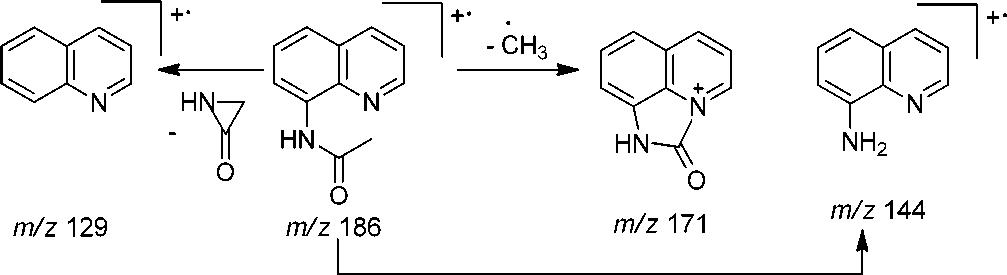
- С2Н2О
Схема 4. Основные процессы фрагментации 8-ацетиламинохинолина
Органическая химия
8-Аллилацетиламинохинолин ( 5 ) получен взаимодействием 8-ацетиламинохинолина с ал-лилбромидом в ДМСО в присутствии щелочи. В масс-спектре его (рис. 4), в отличие от исходного 8-ацетиламинохинолина 4 , более выгодным является элиминирование ацетильного радикала, а соответствующий пик является максимальным ( m/z 183). В масс-спектре нами не обнаружен пик с m/z 186, соответствующий элиминированию аллильного радикала (схема 5). Следует отметить, что в отличие от аллила 2 , при исследовании аллиламина 5 методом ХМС не происходит перегруппировки Кляйзена.
I, %
800000 I
700000 -
600000 -
500000 -
400000 -
200000 -
100000 - m
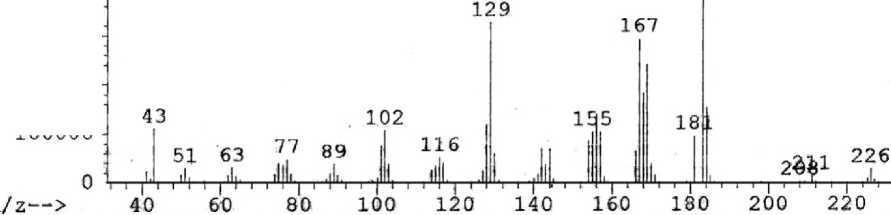
Рис. 4. Масс-спектр 8-аллилацетиламинохинолина
m/z 129
m/z 183
Схема 5. Основные процессы фрагментации 8-аллилацетиламинохинолина
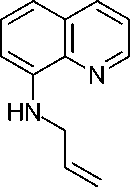
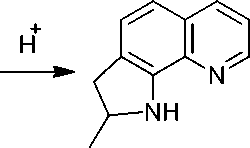
2-Метил-2,3-дигидро-1 Н -пирроло[3,2- h ]хинолин ( 6 ) образуется при действии 15 % соляной кислоты на соединение 5 . По-видимому, вначале происходит гидролиз с образованием 8-аллиламинохинолина, который в кислой среде претерпевает перегруппировку Гофмана– Марциуса [6] с образованием 7-аллил-8-аминохинолина, и который внутримолекулярно циклизуется с образованием конечного продукта 6 (схема 6). Указанная цепь превращений является примером домино-реакции в органическом синтезе [7].
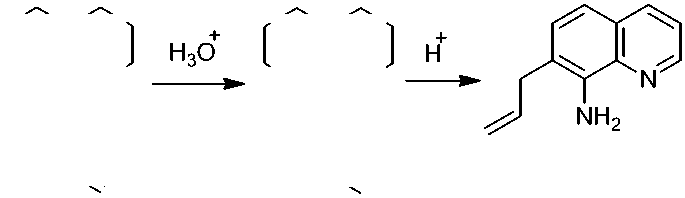
Схема 6. Образование 2-метил-2,3-дигидро-1 Н -пирроло[3,2- h ]хинолина
В масс-спектре (рис. 5) пирролохинолина 6 максимальным является пик [М–Н]+, что обусловлено легкостью отрыва пиррольного атома водорода.
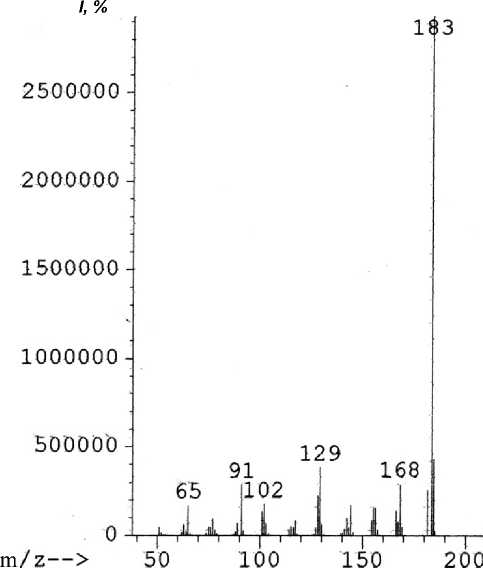
Рис. 5. Масс-спектр 2-метил-2,3-дигидро-1 Н -пирроло[3,2- h ]хинолина
Экспериментальная часть
Масс-спектры электронного удара сняты на хроматомасс-спектрометре ГХ/МС-ЭВМ фирмы Hewlet Packard, газовый хроматограф HP-5890, серия II, масс-селективный детектор MSD-5972 при энергии ионизации 70 эВ. 8-Аминохинолин является продажным реактивом и использовался без перекристаллизации.
8-Аллиламинохинолин и 8-диаллиламинохинолин . Аллилирование 8-аминохинолина ал-лилбромидом проводится в изопропиловом спирте в присутствии изопропилата натрия при кипячении с обратным холодильником в течение 4 ч. Спирт отгоняют, а остаток обрабатывают ди-хлорметаном и исследуют методом ХМС.
Список литературы Исследование производных 8-аминохинолина методом хроматомасс-спектрометрии
- Comprehensive review on synthetic approach for antimalarial agents/A. Kumar, D. Paliwal, D. Saini et al.//European Journal of Medicinal Chemistry. -2014. -V. 85. -P. 147-178.
- Synthesis, antimalarial, antileishmanial, antimicrobial, cytotoxicity, and methemoglobin (MetHB) formation activities of new 8-quinolinamines/K. Kaur, S.R. Patel, P. Patil et al.//Bioorganic & Medicinal Chemistry. -2007. -V. 15. -P. 915-930.
- Солдатенков, А.Т. Основы органической химии лекарственных средств/А.Т. Солдатенков, Н.М. Колядина, И.В. Шендрик. -М.: Мир, 2003. -192 с.
- Синтез и гетероциклизация аллильных производных 8-аминохинолина/Д.В. Воробьев, Ю.В. Тихонова, Д.Г. Ким, А.В. Белик//Химия гетероцикл. соед. -1997. -№ 6. -С. 781-784.
- Свойства органических соединений. Справочник/под ред. А.А. Потехина. -Л.: Химия, 1984. -520 с.
- Ли, Дж.Дж. Именные реакции. Механизмы органических реакций/Дж.Дж. Ли. -М.: Бином, 2006. -456 с.
- Титце, Л. Домино-реакции в органическом синтезе/Л. Титце, Г. Браше, К. Герикс. -М.: Бином, 2010. -671 с.


