Исследование реакции клеточной культуры на изменение температуры методом динамической спекл-интерферометрии
Автор: Михайлова Юлия Александровна, Владимиров Александр Петрович, Бахарев Алексей Анатольевич, Сергеев Александр Григорьевич, Новоселова И.А., Якин Д.И.
Журнал: Российский журнал биомеханики @journal-biomech
Статья в выпуске: 1 (75) т.21, 2017 года.
Бесплатный доступ
В настоящее время биоспеклы успешно применяются для изучения процессов, происходящих на поверхности и внутри различных биологических объектов: фруктов, овощей, зерен, кожи и сетчатки глаза пациента. Ранее были разработаны методика и установка для определения метаболической активности клеточных культур Vero, Л-41 и ЛЭЧ методом динамической спекл-интерферометрии. Параметрами, характеризующими активность клеток, являлись усредненное по времени цифровое значение интенсивности излучения в пикселе телекамеры и коэффициент корреляции двух спекловых изображений η. Получены хорошо воспроизводимые результаты при исследовании клеточных культур, зараженных вирусом простого герпеса первого типа. В данной статье рассмотрена оптическая методика, позволяющая по коэффициенту корреляции фрагмента спекловых изображений определять среднеквадратическое отклонение разности оптических путей волн σ u в малой области отдельной клетки либо в группе клеток. Объектом исследования являлась клеточная культура Л-41 в виде монослоя клеток на стеклянной подложке, помещенной в кювету с питательной средой. Кювету освещали излучением от лазерного модуля через матовый рассеиватель, спекловое изображение клеток формировали с оптическим увеличением, равным 11. Величину σ u использовали в качестве параметра, характеризующего активность физико-химических процессов в клетках. Показано, что в процессе увеличения температуры Т от 26 до 37 °C в течение часа имеют место значительные флуктуации величины σ u в пространстве и во времени. При стабилизации температуры в течение 30 минут флуктуации практически прекращаются, а при изменении температуры на десятые доли градуcов наблюдается хорошая корреляция между σ u и Т.
Спеклы, интерферометрия, клетка, линия л-41, температура, метаболизм, неразрушающий контроль
Короткий адрес: https://sciup.org/146216228
IDR: 146216228 | УДК: 535.41+576/57.085 | DOI: 10.15593/RZhBiomeh/2017.1.06
Текст научной статьи Исследование реакции клеточной культуры на изменение температуры методом динамической спекл-интерферометрии
Неинвазивные методы диагностики, характеризующиеся быстротой и надежностью предоставляемых данных, как известно, представляют перспективное направление в биологии и медицине. Одним из таких методов является метод регистрации динамики спеклов. Спеклы (англ. speckle – крапинка, пятнышко) – случайная интерференционная картина, которая образуется при взаимной интерференции многих когерентных волн, имеющих случайные сдвиги фаз. Со свойствами неподвижных спеклов можно ознакомиться, например, в работах [2, 7, 12].
Хотя в большинстве случаев спеклы являются нежелательным явлением (существуют различные методики фильтрации спекл-шума), доказано, что они несут информацию об объекте исследования: если есть движение в рассеивающем объекте, то картина спеклов меняется – наблюдается динамика спеклов [12].
В настоящее время биоспеклы успешно применяются для изучения активности различных биологических объектов [1, 3, 8, 10–12, 15, 16, 18, 19]. Одним из наиболее успешных примеров использования биоспеклов является разработка подхода, предложенного впервые в работах [13, 17] и доведенного до практического применения в клинических исследованиях. Метод позволяет по контрасту спеклов оценивать скорость потоков крови на сетчатке глаза и вблизи кожных покровов конечности пациента. На данный момент метод достаточно проработан теоретически и экспериментально [14]. Многочисленные ссылки на работы, посвященные применению спеклов для изучения процессов, происходящих в растениях, семенах и фруктах, можно найти в работе [20].
Ранее были разработаны теория метода и методика проведения экспериментов, позволяющие по регистрации динамики спеклов изучать динамику оптических путей волн (показателя преломления) в тонких биологических объектах [4]. Метод динамической спекл-интерферометрии успешно был применен для исследования метаболической активности трех клеточных культур, зараженных вирусом простого герпеса первого типа [6] и в отсутствие вируса [5]. Также с помощью метода была оценена реакция клеточных культур при изменении температуры. Усреднение данных было проведено по сотням клеток [9].
Целью данной работы является подробное изучение реакции малых участков отдельных клеток и группы клеток на изменение температуры. В данной статье приводятся результаты при изменении температуры от 26 до 37 °С.
Краткая теория метода
В работе [4] представлены теория и методика динамической спекл-интерферометрии для усредненных во времени спеклов. Предполагалось, что когерентный источник света освещает неподвижные точечные рассеивающие центры, располагающиеся в тонком прозрачном диффузоре. Вблизи диффузора располагается тонкий прозрачный биологический объект. Линза с линейным разрешением as формирует изображение объекта. Фаза j -й волны изменяется случайным образом из-за изменения оптической длины пути u j в тонком прозрачном объекте.
Было получено выражение для средней по времени интенсивности (1) и для нормированной временной автокорреляционной функции интенсивности излучения (2):
I( с / ) = I 1 + I 2 e" k " 2 cos( к ц + а ), (1)
П 1,2 ( t i , t 2 ) = cos [( x 2) - ( x Дх e 2 " 2 22 12 , (2)
где µ - средняя по области диаметром as и времени оптическая разность хода пар волн A u k ; о2 - дисперсия A u k , x = k ц , I , , I 2, a = const, угловые скобки ^ ) означают усреднение по ансамблю объектов, x 1, x 2 - значения x в моменты времени t 1 и t 2 ; k 11, k 22 - дисперсии величины x в моменты времени t 1 и t 2 ; k 12 - временная автокорреляционная функция величины x .
Auk = uj- um ,
Uj = J[j l)-n0] dl,(4)
l J
Um = j[ nm ( 1 ) — n 0 ] dl, lm где nj(l) - показатель преломления вдоль пути j -й волны; n0 - показатель преломления в отсутствие объекта. Интегрирование ведется вдоль пути волны.
Если процесс изменения фаз волн стационарный, то вместо (2) имеем (6):
П(т) = e - k 11 + k 11 P 12 (t) , (6)
где ρ 12 (τ) - нормированная автокорреляционная функция разности фаз пар волн, * - k,, ^
т = 1 2 - 1 1 . Из формулы (6) ясно, что при т > х- n = e , где о u = — J k 11 .
2π
Отсюда следует, что автокорреляционная функция выходит на постоянный *
уровень η , по значению которого можно найти среднеквадратическое отклонение σ u величин A uk от среднего значения. Именно величина a u была использована нами в качестве параметра, характеризующего активность группы клеток или малого участка в пределах клетки.
Техника и методика эксперимента
Эксперименты проводились на клетках линии Л-41, культивированных на стеклянной подложке. Блок-схема установки представлена на рис. 1. В качестве источника света в установке использовался полупроводниковый лазерный модуль KLM-D 532-20-5 с длиной волны 0,532 мкм. Излучение от модуля попадало на матовый расcеиватель, далее – на стеклянную кювету, внутри которой фиксировали стеклянную подложку со слоем клеток и стеклянный фиксатор в питательном растворе. В опытах использовалась монохромная телекамера типа «Видеоскан» 415/П/К- USB . Камера имела матрицу фотоприемников размером 6,5×4,8 мм, содержащую 780×582 ячеек размером 8,3×8,3 мкм. Частота ввода кадров – до 25 Гц. Время экспонирования телекамеры составляло 9 с. Оптическая система установки находилась в газовом термостате с возможностью изменения температуры. Для контроля температуры в кювете с точностью ±0,1 °С использовали термодатчик DS 1820 ( Dallas Semiconduсtor ). Оптическое увеличение микроскопа равнялось 11.
Запись кадров фильма динамики спеклов в формате . bmp осуществляли с помощью программы Viewer , поставляемой вместе с телекамерой «Видеоскан». Сигналы с телекамеры через USB -порт поступали на ноутбук типа Aspire 3692 WLMi фирмы Acer . Время записи кадров составляло до 3 часов.
Значения коэффициента корреляции двух цифровых изображений η определяли с помощью оригинального программного обеспечения по формуле (7)
η =
m ⋅ n
m - 1 n - 1 ∑∑ [ A i , j i = 0 j = 0
- A ][ В i , j - В ]
m - 1 n - 1
1 ∑∑ [ A i , j
\ m ⋅ n i = 0 j = 0 ,
-
A ]2 ⋅
m - 1 n - 1
^ m ⋅ n
i = 0 j = 0
где A i , j – 8-битное цифровое значение интенсивности I на участке размером m×n пикселей в начальный момент времени; B i , j – 8-битное цифровое значение интенсивности I на этом же участке через время τ ; i, j – номера пикселей участков в направлении осей x и y соответственно; A – средняя величина цифрового значения интенсивности I на участке в начальный момент времени; B – средняя величина цифрового значения интенсивности I на участке через время τ .
Дальнейшая обработка данных проводилась в стандартном пакете Microsoft Excel 2010.
Величина σ u , соответствующая клеткам, определялась по двум зависимостям η(τ) в предположении, что процессы в клетках и в питательном растворе протекают независимо. Первая зависимость соответствовала питательному раствору, вторая -клеткам в питательном растворе.
На рис. 2 показана фотография клеток, полученная в белом свете. По этой фотографии выбирали области, соответствующие малым участкам внутри отдельной клетки, либо область массива клеток для изучения их активности. В частности, для изображения массива клеток был выбран участок, содержащий изображение 120 клеток. Значение σ u находили для τ =18 с.
На рис. 3 приведены типичные графики зависимости η(τ) для питательного раствора и клеток в питательном растворе, по которым определяли величину σ u для клеток.
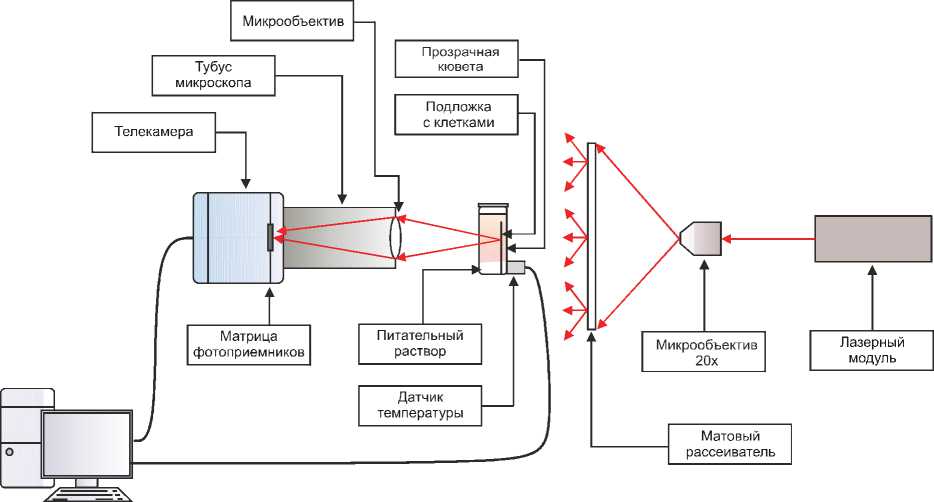
Рис. 1. Блок-схема установки
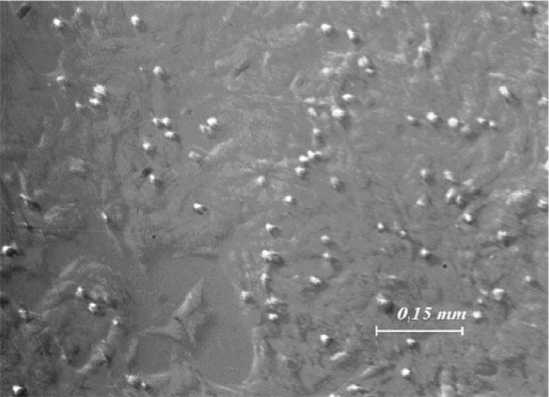
Рис. 2. Изображение клеток в белом свете
η, отн. ед.
1,000 -го
0,995
0,990
0,985
0,980

о
0,975
0,970
0,965 -Ц-0
п------------1-------------1------------1-------------1------------1------------1------------1------------1-------------1------------1 τ, с
Рис. 3. Зависимости коэффициента корреляции от времени: 1 – питательный раствор, 2 – клетки
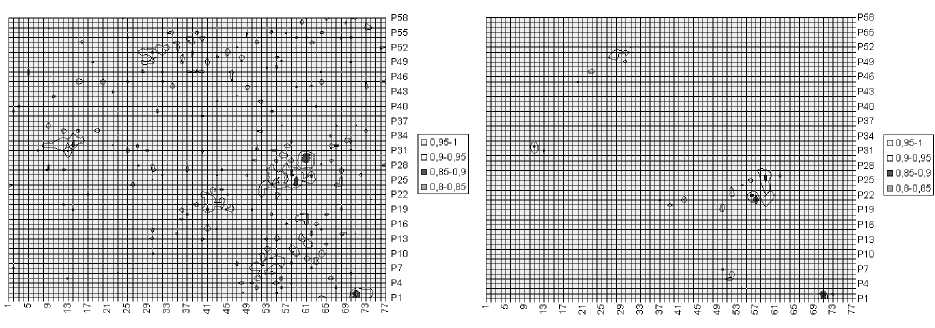
Рис. 4. Изменение в распределении величины η при температуре 25,9 °С, обнаруженное по четырем кадрам, записанным через 18 с: а – по первым двум кадрам, б – по последним двум кадрам
Распределения величины η , найденные по двум кадрам, взятым через 18 с, показаны на рис. 4. Значения η находились на участках размером 10×10 пикселей, что соответствует области размером примерно в половину одиночной клетки.
О и , мкм
0,024
0,022
0,020
0,018
0,016
0,014
0,012
0,010
0,008
0,006
0,004
0,002
0,000
Т , °С
26 27 28 29 30 31 32 33 34 35 36 37
Рис. 5. Зависимость вариаций оптической разности хода от температуры внутриклеточных участков одной клетки: 1 - цитоплазма; 2 - край;
3 - центр
° и , мкм
t , c
Рис. 6. Зависимости вариаций оптической разности хода (■) и температуры (о) от времени
На рис. 5 представлены типичные зависимости величины σ u для малых участков в пределах изображения одной клетки.
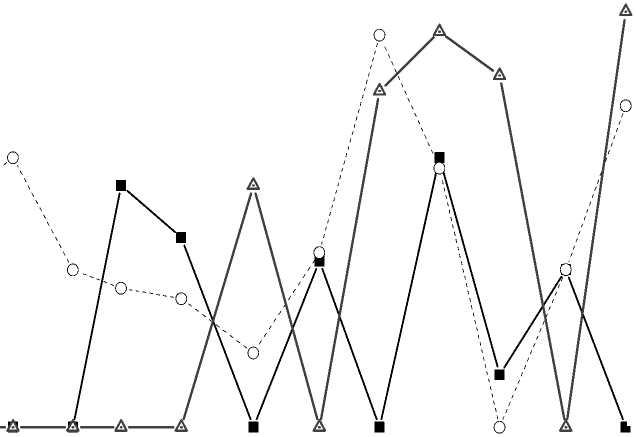
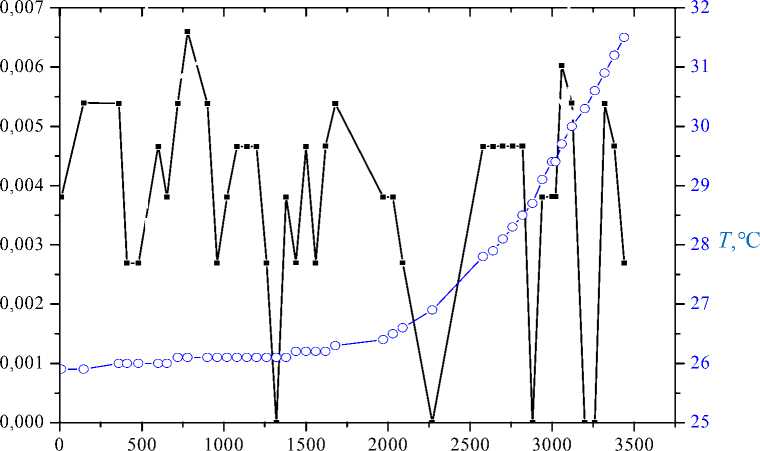
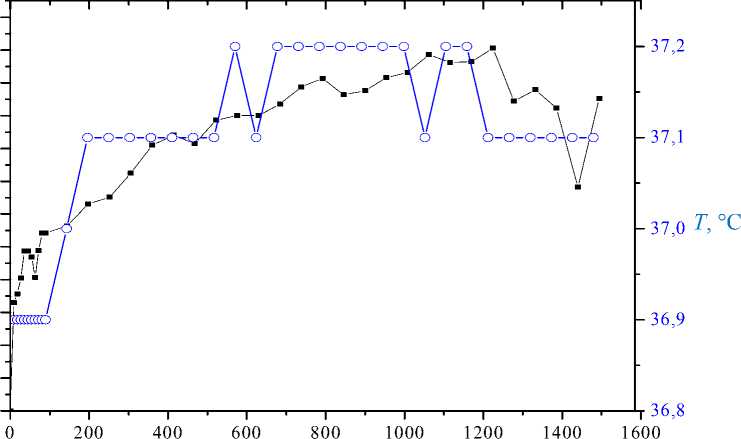
На рис. 6, 7 приведены совмещенные графики зависимостей σ u и температуры ( T ) от времени для массива из 60 клеток.
σ
u
мкм
0,024
0,022
0,020
0,018
0,016
0,014
0,012
0,010
0,008
0,006
0,004
0,002
0,000
t , с
Рис. 7. Зависимости вариаций оптической разности хода (■) и температуры (о) от времени в пределах одного градуса температуры
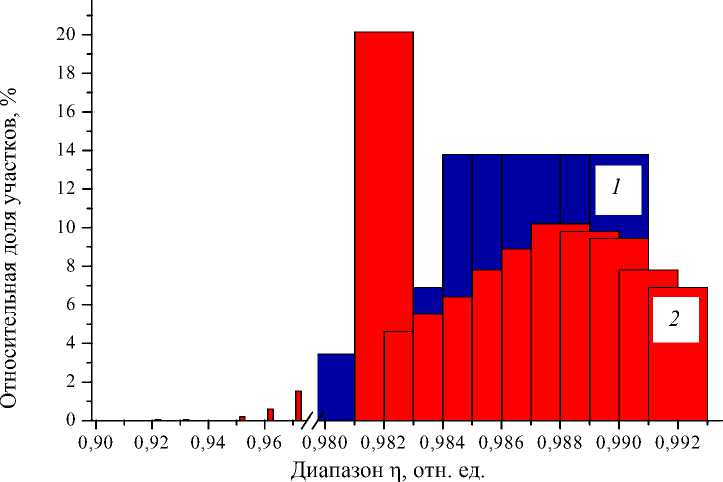
Рис. 8. Распределение величины η : 1 (синий) – для питательного раствора; 2 (красный) – для клеток
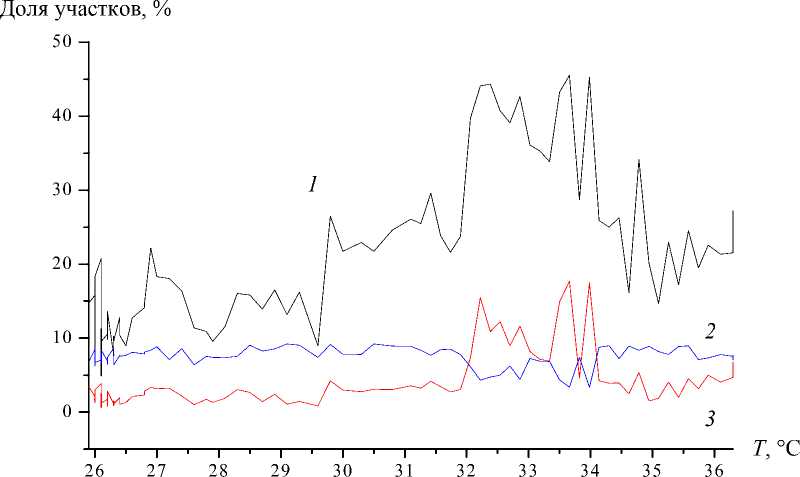
Рис. 9. Изменение относительной доли участков размером 10×10 пикселей с 26 до 36 ºС: 1 (черный) – для клеток с параметром η в диапазоне от 0,971 до 0,981; 2 (синий) – для клеток с параметром η в диапазоне от 0,985 до 0,986;
3 (красный) – для клеток с параметром η в диапазоне от 0,961 до 0,971
Из рис. 6, 7 следует, что при увеличении температуры наблюдаются значительные флуктуации активности клеток в пространстве и во времени.
Если температуру стабилизировать в течение 30 минут, то активность также стабилизируется (см. рис. 7). Коэффициент корреляции массивов σ u и Т , приведенных на рис. 7, равен 0,88.
На рис. 8 показана типичная гистограмма при Т = 34,9 °С, характеризующая относительное число участков размером 10×10 пикселей, значение η которых попадает в заданный интервал.
На следующем рис. 9 представлены зависимости, характеризующие изменение относительной доли числа участков, имеющих различную активность.
Из рис. 9 видно, что увеличение доли активных клеток происходит за счет вовлечения неактивной части популяции. Анализ гистограмм показал, что уменьшение значений зависимостей 1 и 3 после 34 °C может быть вызвано увеличением доли клеток, имеющих высокие показатели активности ( η < 0,960, т.е. σ u > 0,012 мкм).
Выводы
Метод корреляции фрагментов спекловых изображений использован для детального изучения реакции клеток на изменение температуры. В качестве параметра, характеризующего активность малого участка в пределах клетки или группы клеток, использована величина σ u – среднеквадратическое отклонение разности путей волн.
Показано:
-
1. При увеличении в течение одного часа температуры в диапазоне от 26 до 37 ºС наблюдается сильный разброс активности участков в пределах одной клетки и для группы клеток в пространстве и во времени.
-
2. При стабилизации температуры в течение получаса (см. рис. 7) разброс активности существенно уменьшается и появляется хорошая корреляция между изменением температуры и изменением активности.
-
3. Значительный разброс активности единичных клеток, по-видимому, является следствием несинхронности прохождения клеток по циклу.
-
4. Данные, полученные в ходе исследования, могут быть использованы для создания приборов контроля биологической активности, в том числе контроля в реальном времени, в ряде разделов медицины и биологии.
Список литературы Исследование реакции клеточной культуры на изменение температуры методом динамической спекл-интерферометрии
- Беднов А.А., Ульянов С.С., Тучин В.В., Брилль Г.Е., Захарова Е.И. Исследование динамики лимфотока методами спекл-интерферометрии//Известия вузов. Прикладная нелинейная динамика. -1996. -Т. 4, № 6. -C. 45-54.
- Вест Ч. Голографическая интерферометрия: пер. с англ. -М.: Мир, 1982. -504 с.
- Владимиров А.П., Лисин А.Л., Микушин В.И., Кохан М.М., Куклин И.А., Кононенко Е.В. Применение техники счета числа мерцаний спеклов для изучения биологической активности кожи//Письма в журнал технической физики. -2000. -Т. 26. -С. 20-24.
- Владимиров А.П. Динамическая спекл-интерферометрия микроскопических процессов, протекающих в тонких биологических объектах//Известия вузов. Радиофизика. -2014. -T. 57, № 8-9. -С. 632-545.
- Владимиров А.П., Малыгин А.С., Михайлова Ю.А., Бородин Е.М., Бахарев А.А., Порываева А.П. Сравнение метаболической активности разных клеточных культур по динамике спеклов//Известия вузов. Радиофизика. -2014. -T. 57, № 8-9. -С. 654-659.
- Владимиров А.П., Малыгин А.С., Михайлова Ю.А., Бахарев А.А., Порываева А.П. Устройство оценки в режиме реального времени метаболической активности клеточных культур с вирусом герпеса//Медицинская техника. -2014. -№ 4. -С. 8-10.
- Гудмен Дж. Статистическая оптика: пер. с англ. -М.: Мир, 1988. -528 с.
- Зимняков Д.А., Рябухо В.П., Тучин В.В., Ульянов С.С. Лазерные спекл-корреляционные диагностические технологии для машиностроения и медицины//Проблемы машиностроения и надежности машин. -1999. -№ 1. -С. 117-126.
- Малыгин А.С., Бебенина Н.В., Владимиров А.П., Микитась К.Н., Бахарев А.А. Спекл-интерферометрическая установка для изучения биологической активности клеток//Приборы и техника эксперимента. -2012. -№ 3. -C. 124-127.
- Тучин В.В. Оптическая биомедицинская диагностика. -М.: Физматлит, 2007. -Т. 1. -560 с.
- Тычинский В.П. Когерентная фазовая микроскопия внутриклеточных процессов//Успехи физических наук. -2001. -T. 171. -C. 649-662.
- Франсон М. Оптика спеклов/пер. с англ. под ред. Ю.И. Островского. -М.: Мир, 1980. -171 с.
- Briers J.D., Webster S. Laser speckle contrast analysis (LASCA): a nonscanning, full-field technique for monitoring capillary blood flow//Journal of Biomedical Optics. -1996. -Vol. 1, № 2. -P. 174-179.
- Briers J.D. Laser speckle contrast imaging for measuring blood flow//Optica Applicata. -2007. -Vol. XXXVII, № 1-2. -P. 139-152.
- Cardoso R.R., Costa A.G., Nobre C.M.B., Braga Jr. R.A. Frequency signature of water activity by biospeckle laser//Optics Communications. -2011. -Vol. 284, № 8. -P. 2131-2136.
- Choi W., Fang-Yen C., Badizadegan K., Oh S., Lue N., Dasari R.R., Feld M.S. Tomographic phase microscopy//Nature Methods. -2007. -Vol. 4, № 9. -P. 717-719.
- Fercher A.F., Briers J.D. Flow visualization by means of single-exposure speckle photography//Optics Communications. -1981. -Vol. 37, № 5. -P. 326-330.
- Niemz M.H. Laser-Tissue Interactions: Fundamentals and Applications. -Springer, 1996.
- Oulamara A., Tribillon G., Duvernoy J. Biological activity measurement on botanical specimen surfaces using a temporal decorrelation effect of laser speckle//Journal of Modern Optics. -1989. -Vol. 36, № 2. -P. 165-179.
- Rabal H.J., Braga Jr. R.A. Dynamic Laser Speckle and Applications. -New York: CRC Press, 2008.


