Исследование реакций 2-амино-5-трифторметил-1,3,4-тиадиазола в основной среде
Автор: Ильиных Елена Сергеевна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 12 (229), 2011 года.
Бесплатный доступ
Установлено, что в результате реакций 2-амино-5-трифторметил-1,3,4-тиадиазола в основной среде образуются продукт рециклизации, бис(5-трифторметил-1,3,4-тиадиазол-2-ил)амин, и продукт димеризации, 2-(2-амино-5-меркапто-6-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил)-5-трифторметил-1,3,4-тиадиазол, взаимодействием которого с бромистым аллилом синтезированы соответствующие аллильные производные. Структура полученных соединений исследована методами хромато-масс-спектрометрии и спектроскопии ЯМР 1Н.
2-амино-5-трифторметил-1, 4-тиадиазол, рециклизация, димеризация, бис(5-трифторметил-1, 4-тиадиазол-2-ил)амин, 2-(2-амино-5-меркапто-б-трифтор-1, 4-триаза-2, 4-гексадиен-1-ил)-5-трифторметил-1, 2-(1-аллил-2-амино-5-аллилтио-6-трифтор-1, 4-гексадиен-1-ил)-5-трифтор-метил-1, 2-(2-аллиламино-5-аллилтио-6-трифтор-1, хроматомасс-спектрометрия, спектроскопия ямр 1н
Короткий адрес: https://sciup.org/147160183
IDR: 147160183 | УДК: 547.794.3
Текст научной статьи Исследование реакций 2-амино-5-трифторметил-1,3,4-тиадиазола в основной среде
Научный интерес к производным 2-амино-1,3,4-тидиазолов вызван рядом полезных практических свойств данных соединений. Сообщается о биологической активности 5-тиенил- [1] и 5-(2,4-дифтор-4-гидроксибифенил)производных [2] N-замещенных 2-амино-1,3,4-тидиазолов, а также бмс[1,3,4]тиадиазолов [3] и других соединений данного класса [4-6].
Согласно данным [3-9], тиосемикарбазиды в кислой среде образуют тиадиазольный цикл, а в основной - триазольный. Известно также, что 1,3,4-тиадиазолы под действием аминов [10] или при нагревании [11] превращаются в соответствующие 1,2,4-триазол-З-тионы. Для фторсодержащих аналогов подобные реакции не изучены. В связи с этим целью настоящей работы является исследование превращений 2-амино-5-трифторметил-1,3,4-тиадиазол а (1) в основной среде.
Обсуждение результатов
Известен [7] синтез 2-амино-5-трифторметил-1,3,4-тиадиазола (1) на основе реакции тиосемикарбазида с трифторуксусной кислотой в присутствии серной кислоты. В настоящей работе соединение 1 получено нами без использования минеральной кислоты взаимодействием тиосемикарбазида с трехкратным избытком трифторуксусной кислоты.
Ранее в «Письме в Редакцию» [12] нами сообщалось о необычной реакции димеризации соединения 1 под действием изопропилата натрия (z-PrONa), протекающей с раскрытием одного тиадиазольного цикла и образованием 2-(2-амино-5-меркапто-6-трифтор-1,3,4-триаза-2,4-гекса-диен-1-ил)-5-трифторметил-1,3,4-тиадиазола (2), на основе которого синтезированы 2-(2-амино-5-(аллил/металлилтио)-6-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил )-5-трифторметил-1,3,4-тиадиа-золы (За, Ь) (рис. 1).
Следует отметить, что в описанной реакции кроме продукта димеризации 2 образуется также бмс(5-трифторметил-1,3,4-тиадиазол-2-ил)амин (4). В его масс-спектре имеется пик молекулярного иона [М]+" с m/z 321, который является максимальным, а также пики ионов [M-F]+ и [CF3]+. Соединение 4 образуется, по-видимому, по ANRORC-механизму [13], который был открыт в семидесятых годах XX века и включает три основные стадии, давшие ему название - Additional of Nucleophile (присоединение нуклеофила) - Ring Opening (раскрытие кольца) - Ring Closure (закрытие кольца).
В продолжение работы нам представилось интересным исследовать возможные превращения соединения 1 в основной среде. Найдено, что кипячение раствора соединения 1 в изопропиловом спирте в присутствии изопропилата калия в течение 10 ч сопровождается расщеплением тиадиа- зольного цикла и образованием смеси продуктов, среди которых преобладает продукт димеризации 2. Его структура подтверждается реакцией с бромистым аллилом и последующим анализом смеси полученных соединений методом хромато-масс-спектрометрии и спектроскопии ЯМР 'Н.
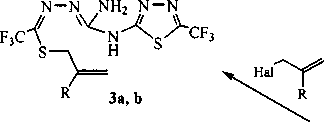
NH
N-N
N-N
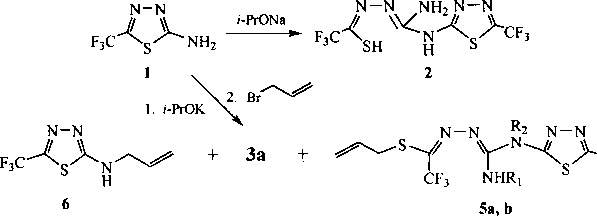
Рис. 1. Реакции 2-амино-5-трифторметил-1,3,4-тиадиазола в основной среде: 3 a R = Н, b R = Me; 5 a R, = Н, R2 = All, b R, = All, R2 = Н
Установлено, что в результате реакции димера 2 с бромистым аллилом образуются полученный нами ранее [12] продукт S-аллилирования (За), а также два изомерных друг другу соединения, содержащие две аллильные группы в структуре и являющиеся продуктами дальнейшего ал-лилирования соединения За (см. рис. 1). Одним из таких соединений, по-видимому, является 2-(2-амино-1 -аллил-5 -аллилтио-6-трифтор-1,3,4-триаза-2,4-гексадиен-1 -ил)-5-трифторметил-1,3,4-тиа диазол (5а). Вторым изомером, вероятно, является 2-(2-аллиламино-5-аллилтио-6-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил)-5-трифторметил-1,3,4-тиадиазол (5Ь). Кроме димеров За, 5а и 5Ь в смеси в небольших количествах присутствует также 2-аллиламино-5-трифторметил-1,3,4-тиадиазол (6), идентифицированный по пику молекулярного иона (m/z 209).
Для установления состава и структуры синтезированных нами соединений За, 5а, 5Ь и 6 использовалась, в частности, информация о фрагментации молекул, полученная на основе анализа и интерпретации масс-спектров. Так, в масс-спектрах всех исследуемых соединений присутствуют пики молекулярного иона [М]+‘, иона [M-F]+, иона [CF3]+, а также пик с m/z 41, соответствующий аллил-катиону. Кроме того, в масс-спектрах соединений За, 5а и 5Ь, содержащих S-аллильный фрагмент, имеется характерный сигнал иона [M-SH]+, что обусловлено образованием катиона пиразиния А:
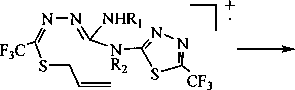
За, 5а, Ь
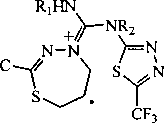
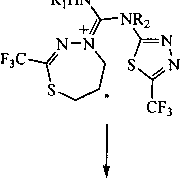
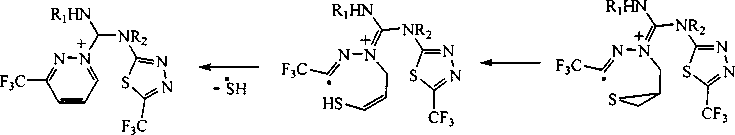
А
3 a Rj = Н, R2 = Н; 5 a Rj = Н, R2 = АП, b R| = All, R2 = Н
В масс-спектрах соединения 6, в котором нет аллилтио-группы, сигнал иона [M-SH]+ отсутствует, но появляются сигналы ионов [M-A11NH]+ и [A11NH]+. Для соединения 5Ь сигнал молекулярного иона имеет небольшую интенсивность (3 %) относительно максимального пика, который
Органическая химия
принадлежит иону [М-А11]+, что объясняется, по-видимому, достаточно легким отщеплением аллильного фрагмента, сопровождающимся образованием устойчивой гетероциклической системы [ 1,2,4]триазоло[3,2-6] [ 1,3,4]тиадиазолия В:
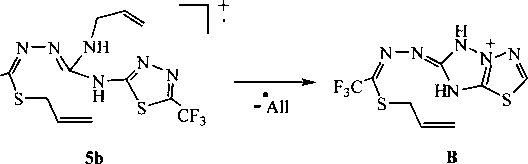
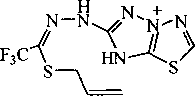
По данным хромато-масс-спектрометрии выдерживание раствора соединения 1 в суперосновной среде (ДМСО-КОН-Н2О) при комнатной температуре с последующим введением в реакционную смесь бромистого аллила приводит к образованию преимущественно двух продуктов -тиадиазолов 5а и 5Ь. Структура соединений 5а и 5Ь подтверждается также данными спектроскопии ЯМР 1Н. В спектре присутствуют характерные сигналы протонов аллильных групп: протоны -СН= проявляются в виде мультиплетов в области 5,80-6,10 м.д., а протоны =СН2 расщепляются на дублеты дублетов и дублеты квинтетов в области 5,00-5,48 м.д. Протоны SCH2-rpynn аллильных фрагментов дают сигналы (дублеты) в области 3,70-3,80 м.д., в то время как сигналы протонов групп NCH2 расположены в более слабом поле (4,90-5,00 м.д.).
Экспериментальная часть
Контроль за составом продуктов реакции осуществляли методом ТСХ на пластинках Silufol UV-254 (2-пропанол-гексан, 3:1), проявление хроматограмм парами иода. Спектры ЯМР ]Н растворов веществ в ДМСО-б/6 записаны на спектрометре Bruker DRX-400 (400 МГц), внутренний стандарт ТМС. Масс-спектры сняты на ГХ/МС-ЭВМ фирмы Agilent Technologies, газовый хроматограф 6890N, масс-селективный детектор 5975.
2 -Амино-5-трифторметил-1,3,4-тиадиазол (1). Смесь 2 г (22 ммоль) тиосемикарбазида и 5 мл (66 ммоль) трифторуксусной кислоты кипятят 1,5 ч, затем выливают в 20 мл воды и охлаждают льдом. Отфильтровывают образовавшийся осадок, промывают водой и сушат. Выход 80 %, т. пл. 220 °C (т. пл. 218 °C [10]).
2-(2-Амино-1-аллил-5-аллилтио-6-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил)-5-трифтор-метил-1,3,4-тиадиазол (5а) и 2-(2-аллиламино-5-аллилтио-б-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил)-5-трифторметил-1,3,4-тиадиазол (5Ь). К раствору 0,112 г (2 ммоль) КОН в 1 мл воды добавляют 5 мл ДМСО и 0,169 г (1 ммоль) соединения 1. Реакционную смесь перемешивают на магнитной мешалке 8 ч, приливают 0,080 мл аллилбромида и перемешивают еще 8 ч, затем выливают в 50 мл воды. Отфильтровывают осадок смеси соединений 5а и 5Ь, промывают водой и сушат.
2-(1 -Аллил-2-амино-5-аллилтио-б-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил)-5-трифтор-метил-1,3,4-тиадиазол (5а). Масс-спектр (ЭУ, 70 эВ), m/z (10ТН, %): 418 [М]+ (13), 399 [M-F]+ (8), 385 [M-SH]+ (37), 235 (100). Спектр ЯМР 'Н, 8, м.д.: 3,75-3,81 (2Н, д, SCH2); 4,94 (2Н, м, NCH2); 5,14-5,22 (2Н, дд, =СН2); 5,22-5,27 (2Н, два дублета квинтетов, =СН2); 5,86 (1Н, м, -СН=); 6,00 (1Н, м, -СН=); 6,87 (2Н, уш. с, NH2).
2-(2-Аллиламино-5-аллилтио-6-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил)-5-трифторметил-1,3,4-тиадиазол (5Ь). Масс-спектр (ЭУ, 70 эВ), m/z (10ТН, %): 418 [М]+ (3), 399 [M-F]+ (5), 385 [M-SH]+ (13), 377 [М-А11]+ (100). Спектр ЯМР *Н, 8, м.д.: 3,75-3,81 (2Н, д, SCH2); 5,04 (2Н, м, СН2); 5,14-5,22 (2Н, дд, =СН2); 5,25-5,31 (2Н, два дублета квинтетов, =СН2); 5,86 (1Н, м, -СН=); 6,00 (1Н, м, -СН=).
Заключение
Установлено, что 2-амино-5-трифторметил-1,3,4-тиадиазол в основной среде претерпевает рециклизацию с образованием бис(5-трифторметил-1,3,4-тиадиазол-2-ил)амина и димеризацию с образованием 2-(2-амино-5-меркапто-6-трифтор-1,3,4-триаза-2,4-гексадиен-1-ил)-5-трифтор-метил-1,3,4-тиадиазола, взаимодействием которого с бромистым аллилом синтезированы соответствующие аллильные производные.
Список литературы Исследование реакций 2-амино-5-трифторметил-1,3,4-тиадиазола в основной среде
- Synthesis, cytotoxicity and effects of some 1,2,4-triazole and 1,3,4-thiadiazole derivatives on immunocompetent cells/A.Ts. Mavrova, D. Wesselinova, Y.A. Tsenov, P. Denkova//European Journal of Medicinal Chemistry. -2009. -Vol. 44. -Issue 1. -P. 63-69.
- Synthesis of some novel heterocyclic compounds derived from diflunisal hydrazide as potential anti-infective and anti-inflammatory agents/Ş.G. Küçükgüzel, I. Küçükgüzel, E. Tatar et al.//European Journal of Medicinal Chemistry. -2007. -Vol. 42. -Issue 7. -P. 893-901.
- Deohate, P.P. Synthesis, Characterization and Antimicrobial Study of Substituted Bis-[1,3,4]-oxadiazole, Bis-[l,3,4]-thiadiazole and Bis-[l,2,4]-triazole Derivatives/P.P. Deohate, B.N. Berad//ChemInform. -2009. -Vol. 40. -Issue 24. -P. 126.
- 1,3,4-Oxadiazole/Thiadiazole and 1,2,4-Triazole Derivatives of Biphenyl-4-yloxy Acetic Acid: Synthesis and Preliminary Evaluation of Biological Properties/H. Kumar, S.A. Javed, S.A. Khan, M. Amir//Chemlnform. -2009. -Vol. 40. -Issue 24. -P. 32.
- Synthesis and anti-HIV Activity of New Chiral 1,2,4-triazoles and 1,3,4-Thiadiazoles/T. Akhtar, S. Hameed, N.A. Al-Masoudi, K.M. Khan//Heteroatom Chemistry. -2007. -Vol. 18, № 3. -P. 316-322.
- Synthesis and Antibacterial Activity of Substituted Thiosemicarbazides and of 1,3,4-Thiadiazole or 1,2,4-Triazole Derivatives/K. Spalińska, H. Foks, A. Kędzia et al.//Phosphorus, Sulfur, and Silicon. -2006. -Vol. 181, № 3. -P. 609-625.
- 2-Amino-5-trifluoromethyl-l,3,4-thiadiazole and a redetermination of 2-amino-1,3,4-thiadiazole, both at 120 K: chains of edge-fused R22(8) and R44(10) rings, and sheets of R22(8) and R66(20) rings/N. Boechat, S.B. Ferreira, С. Glidewell et al.//Acta Crystallographica Section C62. -2006. -P. 42-44.
- Синтез замещенных 1,2,4-триазолов и 1,3,4-тиадиазолов/Т.Р. Овсепян, Э.Р. Диланян, А.П. Енгоян, Р.Г. Мелик-Оганджанян//Химия гетероциклических соединений. -2004. -№ 9. -С. 1377-1381.
- Kurzer, F. Cyclization of 4-substituted 1-amidinothiosemicarbazides to 1,2,4-triazole and 1,3,4-thiadiazole derivatives/F. Kurzer, J. Canelle//Tetrahedron. -1963. -Vol. 19. -P. 1603-1610.
- 1,2,4-Triazoles: synthetic approaches and pharmacological importance (review)/A. Al-Masoudi, Y.A. Al-Soud, N.J. Al-Salihi, N.A. Al-Masoudi//Химия гетероциклических соединений. -2006. -№ П.-С. 1605-1634.
- Synthesis, ring transformations, IR-, NMR and DFT study of heterocycles with two ferrocenyl units/B. Fábián, A. Csámpai, T.Zs. Nagy et al.//Journal of Organometallic Chemistry. -2009. -Vol. 694. -Issue 23. -P. 3732-3741.
- Ким, Д.Г. О необычной реакции димеризации 2-амино-5-трифторметил-1,3,4-тиадиазола/Д.Г. Ким, Е.С. Ильиных//Химия гетероциклических соединений. -2010. -№ 9. -С. 1425-1427.
- Пожарский, А.Ф. Теоретические основы химии гетероциклов/А.Ф. Пожарский. -М.: Химия, 1985. -С. 212-213.


