Исследование S-производных 2-тиоурацилов методом ЯМР 1H
Автор: Фролова Татьяна Владимировна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 12 (229), 2011 года.
Бесплатный доступ
Проанализированы спектры ЯМР 1Н S-аллильных, -пропаргильных, -бутенильных производных 6-метил-, 6-метил-5-этил-, 6-трифторметил- и 6-амино-2-тиоурацилов.
Спектры ямр 1н, 2-алкенил- и 2-пропаргилтио-6-метил-, -6-метил-5-этил-, -6-трифторметил- и 6-амино-4(зн)-пиримидинонов
Короткий адрес: https://sciup.org/147160185
IDR: 147160185 | УДК: 547.759.32
Текст научной статьи Исследование S-производных 2-тиоурацилов методом ЯМР 1H
Метод ЯМР является одним из современных методов анализа строения вещества и открывает возможности более глубокого исследования структуры и внутримолекулярных процессов. Производные 2-тиоурацилов являются интересными объектами исследования благодаря проявляемой ими биологической активности [1-5], поэтому синтез и исследование новых представителей этого ряда является актуальной задачей. В продолжение работ по исследованию синтеза и спектральных характеристик соединений, содержащих фрагмент 2-тиоурацила, проведен анализ сигналов спектров протонного магнитного резонанса S-производных 2-тиоурацилов.
Обсуяедение результатов
Нами проанализированы спектры ЯМР 'Н 2-аллилтио-(1а-б), 2-металлилтио-(2а-4), 2-(2-бромаллил)тио-(За-с), 2-(3-хлораллил)тио-(4а-с), 2-пренилтио-(5а-с), 2-пропаргилтио-(ба-с), 2-бутенилтио-(7а-с)-6-метил-(а), -6-метил-5-этил-(Ь), -б-трифторметил-(с) и -б-амино-4(3//)-пиримидинонов (d) (рис. 1).
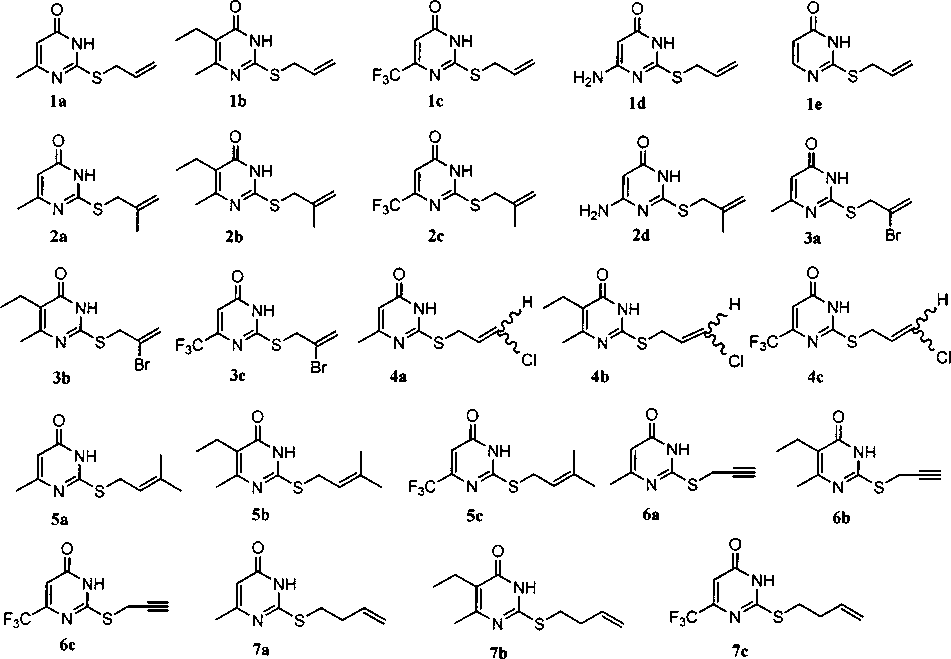
Рис. 1. Структуры анализируемых соединений
Органическая химия
Полученные данные протонного магнитного резонанса сведены в таблицу. Частота спектрометра не оказывает существенного влияния на значения сдвигов сигналов. Более высокая частота прибора, как и следовало ожидать, позволяет фиксировать дальние взаимодействия. Так в соединениях За, 5а, 7а сигналы протонов метильной группы пиримидинового кольца вместо синглета образуют дублет, протон пиримидинового кольца в соединениях За и 7а - образуют уширенный квартет, протоны метильной группы аллильного фрагмента в металлилсульфиде 2с и протоны группы SCH2 в соединениях 2с, За и Зс вместо синглета - мультиплет.
Нами отмечено, что растворитель оказывает небольшое влияние на химсдвиги протонов. Так, сигналы 6-СН3 группы в аллил сульфидах 1а и 1Ь и сигналы этильной группы в соединении 1Ь смещаются в более сильное поле в ДМСО-tik по сравнению с CDCI3 на 0,05-0,15 м.д. Такая же закономерность прослеживается для остальных производных 6-метил-5-этил-2-тиоурацила: в соединениях 3b, 4Ь и 5Ь, спектры которых сняты в CDCI3, сигналы СН2 этильной группы наблюдаются в области 2,51-2,52 м.д., а в соединениях 2b, 6Ь и 7Ь, спектры которых сняты в ДМСО-^е -в области 2,36—2,38 м.д.
В спектре бутенилсульфида 7Ь происходит наложение сигналов СН2-групп этильной группы кольца и -СН2СН=СН2-группы, что приводит к образованию сложного мультиплета в области 2,48-2,51 м.д."
Результаты спектров ЯМР 1Н S-производных 2-тиоурацилов
|
Соединение |
Спектр ЯМР 'Н, 8, м.д. |
Растворитель / Рабочая частота |
|
1 |
2 |
3 |
|
1а |
2,28 (ЗН, с, СН3), 3,85 (2Н, д, SCH2, J=6,96 Гц), 5,15-5,18 (Ш, д, =СНН, Vti$=10,03 Гц), 5,30 и 5,35 (1Н, дд, =СНН, 2Jgem=l,02, 4^=16,92 Гц), 5,92 (1Н, м, =СН), 6,07 (1Н, с, 5-Н) |
CDCh / 400 МГц |
|
2,20 (ЗН, с, СНз), 3,80 (2Н, д, SCH2, J=6,90 Гц), 5,12 (1Н, д, =СНН, Х=10,01 Гц), 5,30 и 5,34 (1Н, дд, =СНН, 2Jgem=l,36, Vzmro=16,97 Гц), 5.91 (1Н, м, =СН), 6,07 (1Н, с, 5-Н) |
ДМСО-б76 / 400 МГц |
|
|
1b |
1,09 (ЗН, т, СНз-СН2, V=7,50 Гц), 2,29 (ЗН, с, СН3-6), 2,51 (2Н, к, СН3-СН2, V=7,50 Гц), 3,85 (2Н, д, SCH2,3J=6,96 Гц), 5,13 и 5,16 (1Н, дд, =СНН, Vgem=l,20, 3Л»=9,97 Гц), 5,29 и 5,33 (1Н, дд, =СНН, ^=1,20, 3Jlrcms=\6,95 Гц), 5,93 (1Н, м, =СН) |
CDCh / 400 МГц |
|
0,97 (ЗН, т, СНз-СН2,V=7,44 Гц), 2,23 (ЗН, с, СН3-6), 2,36 (2Н, к, СН3-СН2, V=7,40 Гц), 3,78 (2Н, д, SCH2, J=6,92 Гц), 5,11 и 5,13 (1Н, д, =СНН, Х=10,00 Гц), 5,28 и 5,33 (1Н, дд, =СНН, 2Jgem=l,58,3J,ra™=16,97 Гц), 5,90 (1Н, м, =СН) |
ДМСО-б/6 / 400 МГц |
|
|
1с |
3,89 (2Н, д, SCH2, jJ=7,08 Гц), 5,20 и 5,22 (1Н, дд, =СНН, 2^т=1,15, 3Jcis=9,99 Гц), 5,35 и 5,39 (Ш, дд, =СНН, Vgem=l,15, 4^=16,92 Гц), 5,92 (1Н, м, =СН), 6,56 (Ш, с, Н-5) |
CDCh / 400 МГц |
|
Id |
3,65 (2Н, д, SCH2, V=6,58 Гц), 4,95 (1Н, с, 5-Н), 5,20 и 5,41 (2Н, м, =СН2), 5,90 (1Н, м, =СН), 6,52 (2Н, с, NH2), 11,42 (1Н, уш. с, NH) |
ДМСО-^6 / 80 МГц |
|
1е |
3,86 (2Н, д, SCH2, 3J=6,6 Гц), 5,23 (2Н, м, =СН2), 5,91 (1Н, м, =СН), 6,10 (1Н, д, Н-5,2J=6,6 Гц), 7,86 (1Н, д, Н-6,2J=6,6 Гц) |
ДМСО-б/6 / 100 МГц |
|
2а |
1,78 (ЗН, с, СНз), 2,26 (ЗН, с, 6-СН3), 3,87 (2Н, с, SCH2), 4,89 (1Н, м, =СНН), 5,06 (1Н, с, =СНН), 6,21 (1Н, с, Н-5) |
ДМСО-^6 / 400 МГц |
|
2Ь |
0,98 (ЗН, т, СНз-СН2, V=7,44 Гц), 1,77 (ЗН, с, СН3), 2,26 (ЗН, с, СН3-6), 2,38 (2Н, к, СН3-СН2, V=7,44 Гц), 3,84 (2Н, с, SCH2), 4,87 (1Н, м, =СНН), 5,05 (1Н, с, =СНН) |
ДМСО-6/ 400 МГц |
|
2с |
1,84 (ЗН, м, СНз), 3,91 (2Н, м, SCH2), 4,94 (Ш, м, =СНН), 5,09 (Ш, с, =СНН), 6,57 (1Н, с, Н-5), 12,86 (1Н, с, NH) |
CDCh / 400 МГц |
|
2d |
1,83 (ЗН, с, СНз), 3,78 (2Н, с, SCH2), 4,85 (1Н, с, =СН), 4,91 (Ш, с, =СН), 5,05 (1Н, с, 5-Н), 6,20 (1Н, с, МН2), 11,34 (1Н, уш. с, NH) |
ДМСО-г/6 / 300 МГц |
Окончание таблицы
|
1 |
2 |
3 |
|
За |
2,26 (ЗН, д, СН3-6, V=0,66 Гц), 4,24 (2Н, м, SCH2), 5,56 (Ш, д, =СН, 2J=1,92 Гц), 5,98 (1Н, м, =СН), 6,09 (1Н, м, Н-5) |
CDC13 / 400 МГц |
|
2,19 (ЗН, с, СНз-6), 4,24 (2Н, с, SCH2), 5,58 (Ш, д, =СН, 2J=1,97 Гц), 6,02 (1Н, м, =СН), 6,07 (1Н, с, Н-5) |
дмсоч/ 400 МГц |
|
|
ЗЬ |
1,10 (ЗН, т, СНз-СН2, V=7,50 Гц), 2,29 (ЗН, с, СН3-6), 2,52 (2Н, к, СН3-СН2, 3J=7,48 Гц), 4,22 (2Н, с, SCH2), 5.56 (1Н, д, =СН, 2J =1,85), 5,99 (1Н, м, =СН) |
CDC13 / 400 МГц |
|
Зс |
4,26 (2Н, м, SCH2), 5,59 (1Н, д, =СН, V=2,02 Гц), 6,01 (1Н, м, =СН), 6,59 (1Н, с, Н-5) |
CDC13 / 400 МГц |
|
4а |
г/мс-изомер 2,30 (ЗН, с, СН3-6), 4,01 (2Н, д, SCH2, V=7,45 Гц), 6,04 (1Н, м, =СН), 6,10 (Ш, с, Н-5), 6,20 (Ш, д, =СНС1,3J=7,23 Гц); транс-изомер 2,30 (ЗН, с, СН3-6), 3,85 (2Н, д, SCH2, V=7,71 Гц), 6,04 (Ш, м, =СН), 6,10 (1Н, с, Н-5), 6,30 (1Н, д, =СНС1,3V= 12,80 Гц) |
CDC13 / 400 МГц |
|
4Ь |
щ/оизомер 1,10 (ЗН, т, СНз-СН2, V=7,50 Гц), 2,33 (ЗН, с, СН3-6), 2,52 (2Н, к, СН3-СН2, V=7,61 Гц), 3,99 (2Н, д, SCH2,3J=7,40 Гц), 6,04 (1Н, м, =СН), 6,19 (1Н, д, =СНС1,V=7,05 Гц); трансизомер 1,10 (ЗН, т, Шз-СН2,3J=7,50 Гц), 2,33 (ЗН, с, СН3-6), 2,52 (2Н, к, CH.-CH^3J =7.61 Гц), 3,84 (2Н, д, SCH2, V=7,70 Гц), 6,04 (Ш, м, =СН), 6,33 (1Н, д, =СНС1,37=13,24 Гц) |
CDC13 / 400 МГц |
|
4с |
г/мс-изомер 4,03 (2Н, д, SCH2, 37=7,46 Гц), 6,08 (Ш, м, =СН), 6,26 (1Н, д, =СНС1,3J=7,06 Гц), 6,57 (1Н, с, Н-5); транс-изомер 3,88 (2Н, д, SCH2, 3J=7,86 Гц), 5,99 (1Н, м, =СН), 6,37 (1Н, д, =СНС1, V=13,19 Гц), 6,57 (Ш, 2с, Н-5) |
CDC13/ 400 МГц |
|
5а |
1,72 (6Н, с, две СНз), 2,26 (ЗН, д, СН3-6, V=0,70 Гц), 3,85 (2Н, д, SCH2, V=7,92 Гц), 5,31 (1Н, м, =СН), 6,04 (1Н, м, Н-5) |
CDC13 / 400 МГц |
|
5Ь |
1,06 (ЗН, т, СНз-СН2, <7=7,48 Гц), 1,74 (6Н, с, две СН3), 2,29 (ЗН, с, СН3-6), 2,51 (2Н, к, СН3-СН2, V =7,47 Гц), 3,82 (2Н, д, SCH2,V=7,87 Гц), 5,31 (1Н, м, =СН)~ |
CDC13 / 400 МГц |
|
5с |
1,74 (6Н, с, две СН3), 3,88 (2Н, д, SCH2, <7=7,84 Гц), 5,31 (1Н, м, =СН), 6,53 (1Н, с, Н-5) |
CDC13 / 400 МГц |
|
6а [6] |
2,11 (ЗН, с, СН3), 3,19 (1Н, т, CH, <7=2,2 Гц), 3,99 (2Н, д, SCH2, /=2,2 Гц), 6,07 (1Н, с, 5-Н), 12,49 (1Н, с, NH) |
ДМСО-б/6/ 300 МГц |
|
6Ь |
0,98 (ЗН, т, СНз-СН2, <7=7,43 Гц), 2,22 (ЗН, с, СН3-6), 2,38 (2Н, к, СН3-СН2, <7=14,78 Гц), 3,17 (1Н, т, CH, <7=2,60 Гц), 3,96 (2Н, д, SCH2, <7=2,63 Гц) |
ДМСО-е/б / 400 МГц |
|
6с |
3,21 (1Н, т, CH V=2,61 Гц), 3,99 (2Н, д, SCH2, V=2,62 Гц), 6,68 (1Н, с, 5-Н) |
CDC13 / 400 МГц |
|
7а |
2,27 (ЗН, д, СН3, V=0,77 Гц), 2,48 (2Н, м, СН2), 3,26 (2Н, т, SCH2, V=7,30 Гц), 5,14 (2Н, м, =СН2), 5,84 (1Н, м, =СН), 6,05 (1Н, м, Н-5) |
CDC13 / 400 МГц |
|
7Ь |
0,96 (ЗН, т, СНз-СН2, jJ=7,44 Гц), 2,19 (ЗН, с, СН3), 2,32-2,42 (4Н, м, СНз-СНг и СН2), 3,15 (2Н, т, SCH2, V =7,19 Гц), 5,12 (2Н, м, =СН2), 5,83 (1Н, м, =СН), 12,32 (1Н, уш. с, NH2) |
ДМСО-б/6 / 400 МГц |
|
7с |
2,51 (2Н, м, СН2), 3,31 (2Н, т, SCH2, 3J=7,23 Гц), 5,16 (2Н, м, =СН2), 5,81 (1Н, м, =СН), 6,55 (1Н, с, Н-5) |
CDC13/ 400 МГц |
Сигнал протона 5-Н в случае незамещенного аллилсульфида 1е образует дублет при 6,10 м.д., наличие соседней метильной группы 6-СН3 в аллилсульфиде 1а не оказывает существенного влияния на сдвиг сигнала протона 5-Н, который образует синглет при 6,07 м.д. Наличие электронодонорной амино-группы в соединении Id смещает сигнал протона 5-Н в более сильное поле на
Органическая химия
1,15 м.д., а наличие электроноакцепторной трифторметильной группы в соединении 1 с - в более слабое поле на 0,46 м.д. Такая же закономерность прослеживается для остальных производных 6-трифторметил-2-тиоурацила (2с-7с), в спектрах которых смещение сигнала ароматического протона в 5-Н составляет 0,50 м.д. в слабое поле по сравнению с производными 6-метил-2-тиоурацилов (а).
Соединения 4а-с представляют собой смесь цис- и т/?анс-изомеров. Поэтому в спектре ПМР сигналы групп находятся в виде двойного набора (рис. 2). Известно, что константа спин-спинового взаимодействия г/мс-изомера меньше, чем транс-изомера [7, 8], что позволило точно идентифицировать сигналы изомеров. Следует отметить, что сигнал группы SCH2 /и/^анс-изомера находится в более сильном поле (3.84-3.88 м.д.) с константой 7,70-7,86 Гц, чем сигнал цис изомера (3,99^1,03) с константой 7,40-7,46 Гц.
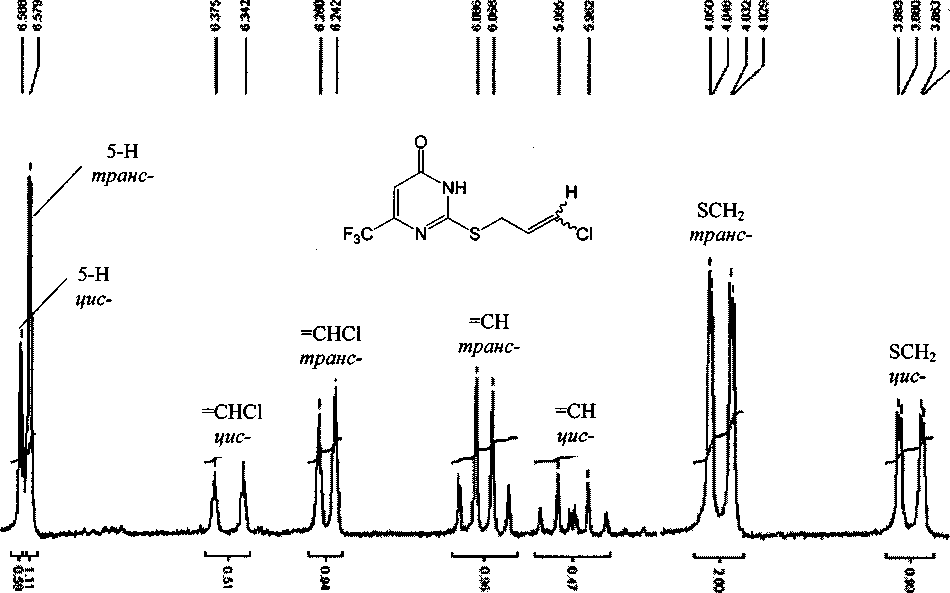
Рис. 2. Спектр ЯМР 1Н соединения 4с
Сигналы группы SCH2 аллилсульфидов (la-е) наблюдаются в области 3,65-3,89 м.д. В зависимости от окружения группа SCH2 образуют синглет (2a-d, За-с), дублет (la-d, 4а-с, 5а-с, ба-с) или триплет (7а-с). Наличие электроотрицательного атома, например, брома в соединениях За-с или хлора в соединениях 4а-с, смещает сигнал SCH2 группы в более слабое поле 4,01-4,26 м.д., а наличие соседней группы -СН2СН=СН2 в бутенилсульфидах (7а-с), наоборот, смещает сигнал в более сильное поле и сигнал находится в области 3,15-3,31 м.д. Наличие электронодонорной метильной группы в аллильном фрагменте металлилсульфидов (2a-d) не приводит к заметному смещению (0,01-0,03 м.д.) сигнала SCH2.
Сигналы геминальных протонов винильной группы в аллилсульфидах la-е дают дублеты дублетов в области 5,13-5,22 и 5,29—5,39 м.д. Наличие метильной группы в аллильном фрагменте соединений 2a-d смещает сигналы геминальных протонов в сильное поле, которые находятся в области 4,85-4,94 и 4,91-5,09 м.д. соответственно.
Соседство с метильной группой в аллильном фрагменте меняет мультиплетность геминальных протонов C=CHXHY, которым соответствует спиновая система XY, поэтому в спектре без дополнительных дальних взаимодействий должны наблюдаться два дублета одинаковой интенсивности. В спектрах соединений 2 а-с данные протоны образуют синглеты, в которых заметно расщепление на квинтет и дублет (рис. 3).
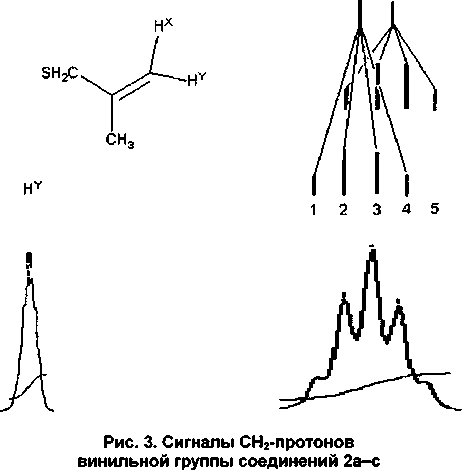
На наш взгляд, это связано с тем, что один дублет от сигнала протона Нх взаимодействует только с протонами группы СН3, расположенной в тиране-положении. Аналогичная константа спин-спинового взаимодействия (КССВ) протона Нх с протонами SH2C в z/wc-положении 4(SH2C-C=C-HX) очень маленькая, поэтому каждый сигнал дублета Нх расщеплён на квартет с дальней константой КССВ 4(Н3С-С=С-НХ). Квартет полностью симметричен, поскольку протоны метильной группы эквивалентны. По-видимому, в данном случае значение КССВ 4(Н3С-С=С-НХ) близко к геминальной КССВ 2J(HXHY), поэтому наложение двух квартетов даёт 5 линий, что и наблюдается в спектре. Возможно, что из-за серы значение дальней КССВ 4(SH2C-C=C-HY) чуть меньше значения 2J(HXHY) и поэтому дублет сигнал протона HY размыт. Можно предположить, что разница КССВ 4(SH2C-C=C-Hy) и 2J(HxHy) проявля ется на всех спектрах как небольшое расщепление центрального пика для протона HY.
Геминальные протоны бутенилсульфидов 7а-с из-за взаимодействия с протонами бутениль-ного фрагмента образуют мультиплеты в области 5,12-5,16 и 5,81-5,84 м.д.
Наличие электроотрицательных атомов брома и хлора в аллильном фрагменте соединений За-с и 4а-с приводит к смещению сигналов протонов при двойной связи в более слабое поле, которые образуют дублет и мультиплет.
В спектре ЯМР *Н аллилсульфидов la-е протон =СН из-за дальних спин-спиновых взаимодействий с протонами двух соседних атомов углерода дает мультиплет при 5,90-5,93 м.д. Наличие электронодонорных метильных групп в пренилсульфидах 5а-с и соседних метиленовых групп в бутенилсульфидах 7а-с смещает сигнал =СН в более сильное поле 5,31 и 5,81-5,84 м.д., а наличие электроноакцепторного хлора в хлораллилах 4а-с - в слабое поле 6,04-6,08 м.д.
В пропаргил сульфидах ба-с протон при тройной связи в спектре ЯМР !Н из-за дальних взаимодействий с протонами группы SCH2 образует триплет при 3,17—3,21 м.д.
Протоны метильной группы, которая не связана с пиримидиновым кольцом, в соединениях 2а—с образуют синглет в области 1,77-1,84 м.д. Метильные группы аллильного фрагмента S-пренильных производных 2-тиоурацилов 5а-с не образуют расщепленные сигналы за счет дальнего взаимодействия с протонами =СН группы, а дают шестипротонный синглет при 1,72-1,74 м.д.
Экспериментальная часть
Спектры ЯМР 'Н растворов в ДМСО-с16 и CDC13 соединений la-с, 2а-с, За-с, 4а-с, 5а-с, 6Ь, 6с, 7а-с получены на спектрометре Bruker DRX-400 (400 МГц), соединения 2d - на спектрометре Bruker АМ-3 00 (3 00 МГц), соединения 1е - на спектрометре Tesla (100 МГц), соединения Id - на приборе Tesla (80 МГц), внутренний стандарт ТМС. Контроль за составом продуктов реакции осуществляли методом ТСХ на пластинках Silufol UV-254, элюент: этилацетат - гексан (1:1). Проявляли хроматограммы УФ-светом или парами иода. Соединения Id, 2d и 6а получены по методу [6], соединение 1е - по методу [10], соединения la-с, 2а-с, За-с, 4а-с, 5а-с - по методу [11], соединения 7а-с - по методу [12], соединение 6Ь - по методу [13].
2-Пропаргилтио-6-трифторметил-4(ЗН)-пиримидинон (6с). К раствору 1 ммоль натриевой соли 6-трифторметил-2-тиоурацила в 5 мл диметилформамида (ДМФА) добавляют 1 ммоль бромистого пропаргила и перемешивают на магнитной мешалке 2 ч. Через 24 ч реакционную смесь обрабатывают 30 мл воды и отфильтровывают выпавший белый осадок, который перекристаллизовывают из октана. Выход 0,184 г (79 %), т.пл. 150 С, R/=0,65.
Органическая химия
Заключение
Проведен сравнительный анализ спектров ЯМР *Н ряда S-алкенильных и S-пропаргильных производных 6-метил-, 6-метил-5-этил-, 6-трифторметил- и 6-амино-4(3//)-пиримидинонов, полученных в различных растворителях и на приборах различной рабочей частоты.
Авторы благодарят д-ра хим.наук С.Н. Тандуру (г. Москва, ИОХ РАН) за консультацию при интерпретации спектров ЯМР.
Список литературы Исследование S-производных 2-тиоурацилов методом ЯМР 1H
- Solution-phase parallel synthesis of S-DABO analogues/A. Togninelli, C. Carmi, E. Petricci et al.//Tetrahedron Lett. -2006. -№ 47. -P. 65-67.
- Ondi, L. Brominated 4-(trifluoromethyl)pyrimidines: A Convenient Access to Versatile Intermediates/L. Ondi, O. Lefebire, M. Schlosser//Eur. J. Org. Chem. -2004. -P. 3714-3718.
- Fathalla, O.A. Synthesis of new 2-thiouracil-5-suiphonamide derivatives with antibacterial and antifungal activity/O.A. Fathalla, S.M. Awad, M.S. Mohamed//Arch. Pharm. Res. -2005. -Vol. 28. -№ 11. -P. 1205-1212.
- Palumbo, A. Thiouracil antithyroid drags as a new class of neuronal nitric oxide synthase inhibitors/A. Palumbo, M. dTschia//Biochemical and Biophysical Research Communications. -2001. -№ 282. -P. 793-797.
- Рахимов, А.И. Особенности синтеза 2-алкил(арилалкил)тио-6-метилпиримидин-4(3Н)-онов и 2-алкил(арилаликил)тио-4-алкил(арилалкил)окси-6-метилпиримидинов/А.И. Рахимов, Е.С. Титова//Журн. орган. химии. -2007. -Вып. 43. -№ 1. -С. 92-98.
- Сливка, Н.Ю. Галогенциклизация замещенных 2-(алкенилтио)пиримидин-6-онов/Н.Ю. Сливка, Ю.И. Геваза, В.И. Станинец//Химия гетероциклических соединений. -2004. -№ 5. -С. 776-783.
- Пентин, Ю.А. Основы молекулярной спектроскопии/Ю.А. Пентин, Г.М. Курамшина. -М.: Мир, 2008. -398 с.
- Преч, Э. Определение строения органических соединений/Э. Преч, Ф. Бюльман, К. Аффольтер. -М.: Мир, 2009. -439 с.
- Журавлева, A.B. Исследование производных 3-меркапто-5Н-1,2,4-триазино[5,6-b]индола методом ЯМР 1Н/A.B. Журавлева, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 3. -№ 11. -С. 16-19.
- Ким, Д.Г. Иодциклизация 2-аллилтио-4(ЗН)-пиримидинонов/Д.Г. Ким, В.И. Шмыгарев//Химия гетероциклических соединений. -1995. -№ 2. -С. 211-213.
- Фролова, Т.В. Синтез и исследование S-аллильных производных 2-тиоурацилов/Т.В. Фролова, Д.Г. Ким, П.А. Слепухин//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 3. -№ 11. -С. 9-15.
- Исследование S-производных 2-тиоурацилов методом масс-спектрометрии/Т.В. Фролова, A.A. Анучин, Е.И. Бахтеева, Д.Г. Ким//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 4. -№ 31. -С. 29-34.
- Ким, Д.Г. Исследование 2-пропаргилтио-6-метил-5-этил-4-пиримидинона/Д.Г. Ким, Т.В. Тюрина//Всероссийская конференция «Енамины в органическом синтезе»: тез. докл. IV Всерос. конф., посвященной 90-летию со дня рождения B.C. Шкляева, 22-26 октября 2007 г. -Пермь. -С. 160-163.


