Исследование S-производных 2-тиоурацилов методом масс-спектрометрии
Автор: Фролова Татьяна Владимировна, Анучин Александр Анатольевич, Бахтеева Евгения Игоревна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 31 (207), 2010 года.
Бесплатный доступ
Методом масс-спектрометрии проведен анализ и интерпретация масс-спектров S-производных 2-тиоурацилов, выявлены закономерности фрагментации молекул.
2-алкил- и алкенилтио-4(зн)-пиримидиноны, масс-спектрометрия
Короткий адрес: https://sciup.org/147160170
IDR: 147160170 | УДК: 547.854.1+543.51
Текст обзорной статьи Исследование S-производных 2-тиоурацилов методом масс-спектрометрии
Установление состава и структуры органических соединений методом масс-спектрометрии активно используется исследователями [1, 2]. Результаты, полученные при интерпретации масс-спектров, дают информацию о свойствах новых органических соединений, что является важной задачей в органической химии.
В литературе практически отсутствуют данные об исследовании S-производных 2-тиоурацилов методом масс-спектрометрии. В работе [3] данные масс-спектрометрии используются для идентификации 2-алкенилтио-4(3/7)-пиримидинонов, но не рассматривается их фрагментация.
Обсуждение результатов
Нами впервые изучено поведение при электронной ионизации (ЭИ) 2-метилтио-(1а-с), 2-этилтио-(2а-б), 2-бензилтио-(За, Ь), 2-стириллтио-(4а, с, е), 2-аллилтио-(5а-е), 2-металлилтио-(ба-d), 2-(3-хлораллил)тио-(7а-с) и 2-бутенилтио-4(37/)-пиримидинонов (8а-с):
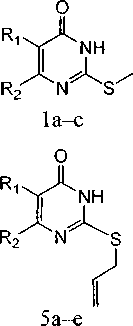
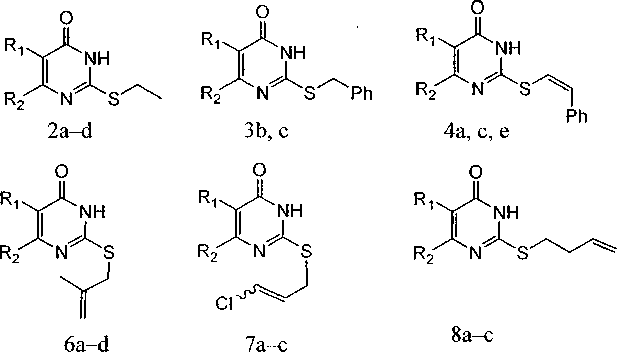
a, b, d R^H, с Ri=C2H5; a R2=CH3, b R2=CF3, R2=CH3, d R2=NH2, e R2=H
В масс-спектрах всех соединений присутствует пик молекулярного иона [М]+" (см. таблицу). В соединениях 1 а-с и 2a-d, в которых при атоме серы имеются метильные или этильные радикалы, пики молекулярных ионов являются максимальными. Для соединений 5а-с, е, ба-с, 7а-с, 8а-с, в которых атом серы связан с аллильной или бутенильной группой, пик [М]+‘ составляют 4^44 % от максимального пика. Наименьший молекулярный пик (4 %) наблюдается в масс-спектре 2-бутенилтио-6-трифторметил-4(ЗД)-пиримидинона (8Ь).
Соединения 7а-с представляют собой смесь иис- и транс-изомеров, масс-спектры которых практически неотличимы. Самым интенсивным является пик [М-С1]+, что характерно для хлор-производных [3].
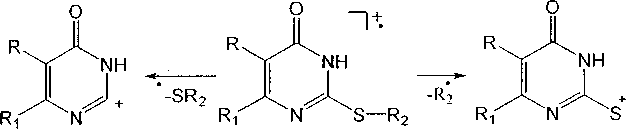
Во всех масс-спектрах анализируемых соединений наблюдается отщепление тиоалкильной группы в результате разрыва связей C-SR, а в соединениях 4а, 4е и 8 ас - отщепление алкильной группы в результате разрыва связи S-R:
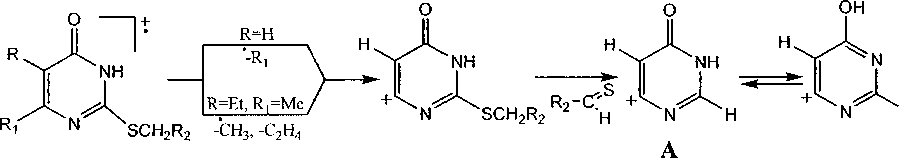
Найдено, что соединения la-c, 2a-d, 4е, 5а-с и 8а-с образуют пик с m/z = 95. На наш взгляд, он принадлежит катиону 4-пиримидинона (A, C4H3N2O), который образуется по следующей схеме:
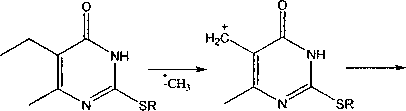
Пик [М-СН3]+ присутствует во всех масс-спектрах исследуемых соединений, кроме 2-стирилтио-4(3//)-пиримидинонов (4а, е). Элиминирование метильной группы в соединениях 1а и 2а может происходить как от серы, так и от пиримидинового кольца.
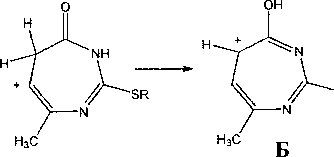
В отличие от соединений la, b и 2а, b в соединениях 1с и 2с пик [М-СН3]+ является максимальным, что на наш взгляд, обусловлено образованием ароматической системы - катиона 2-алкилтио-4-гидрокси-7-метил-1,3-диазепиния (Б):
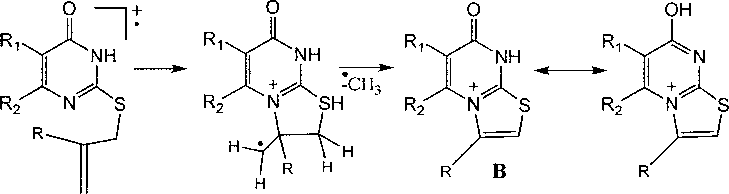
В аллильных производных 5а-с и ба-d пик [М-СН3]+ является максимальным. Это обусловлено тем, что при распаде молекулярного иона образуется устойчивая ароматическая 7-оксотиазоло[3,2-а]пиримидиниевая система (В):
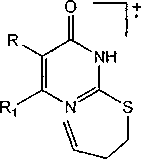
В отличие от аллильных производных 5а-с, е, ба-d в масс-спектрах соединений 8а-с максимальным пиком является не [М-СН3]+, а [М-С4Н7]+, что соответствует отрыву бутенильного радикала. Для соединений 8а-с распад молекулярного иона протекает без образования ароматической системы, поэтому пик [М-СН3]+ не является максимальным:
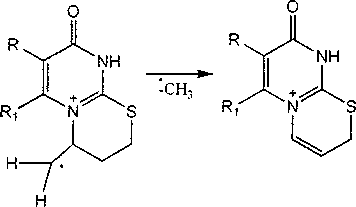
Практически для всех исследуемых соединений имеется пик, соответствующий [M-SH]+. В масс-спектрах этилсульфидов 2a-d пик [M--SH]+ является максимальным, что, на наш взгляд, обусловлено фрагментацией, протекающей по следующей схеме:
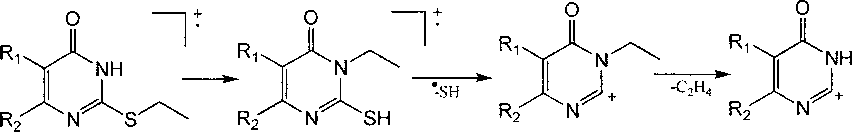
Для соединений 8а-с образование пика [M-SH]+ происходит, по-видимому, по следующей схеме с образованием пиридопиримидиновой системы (Г):
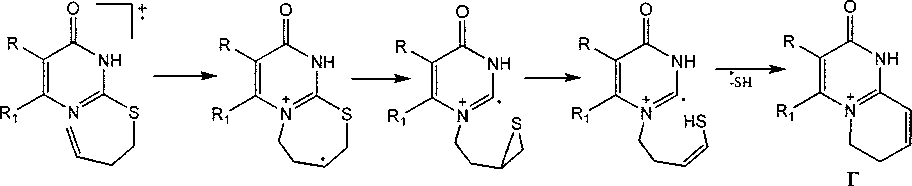
Наличие пика [M-SH]+ также характерно и для аллильных производных 5а-с, е, ба-d, 7а-с, образование которого обусловлено циклизацией с образованием катиона пирролопиримидиния (Д):
Соединения с бензильной группой при электронной ионизации образуют устойчивую тро-пилиевую структуру [3], что и наблюдается в масс-спектрах бензильных производных 2-тиоурацилов (ЗЬ, с).
В масс-спектрах бензильных ЗЬ, с и стирильных 4а, е производных имеется пик с m/z 77, который является фенил-катионом, а в аллильных производных 5а-с, е, ба-с, 7а-с, 8а-с пик с m/z 41, соответствующий аллил-катиону.
Таблица
Результаты масс-спектров S-производных 2-тиоурацилов
|
Соединение |
Масс-спектр |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1а C6H8N2OS |
m/z |
156 [Ml |
141 [M-CH3]+ |
123 [M-SH]+ |
109 [M-SCH3]+ |
95 [C4H3N2O]+ |
47 [SCH3]+ |
- |
- |
|
I, % |
100 |
3 |
3 |
44 |
11 |
16 |
— |
— |
|
|
1b СбН5М2О8Рз |
m/z |
210 [M] |
191 [M-F]+ |
177 [M-SH]+ |
163 [M-SCH3]+ |
141 [M-CF3]+ |
95 [C4H3N2O]+ |
47 [SCH3]+ |
69 rcF3]+ |
|
I, % |
100 |
10 |
2 |
50 |
18 |
6 |
12 |
7 |
|
|
1с C8H12N2OS |
m/z |
184 ГМ] |
169 [M-CH3]+ |
151 [M-SH]+ |
137 [M-SCH3]+ |
95 [C4H3N2O]+ |
47 [SCH3]+ |
- |
- |
|
I, % |
98 |
100 |
22 |
10 |
24 |
7 |
— |
||
|
2а C7H10N2OS |
m/z |
170 [M] |
155 [M-CH3]+ |
142 [M-C2H4]+ |
137 [M-SH]+ |
109 [M-SC2H5]+ |
95 [C4H3N2O]+ |
61 [sc2h5]+ |
- |
|
I, % |
100 |
44 |
49 |
100 |
50 |
4 |
12 |
— |
|
|
2b C7H7N2OSF3 |
m/z |
224 [M] |
209 [М-СНзГ |
196 [M-C2H4]+ |
191 [M-SH]+ |
163 [M-SC2H5]+ |
95 [C4H3N2O]+ |
61 [SC2H5]+ |
69 [CF3]+ |
|
I, % |
100 |
18 |
40 |
80 |
62 |
4 |
15 |
20 |
|
|
2с c9h14n2os |
m/z |
198 (M] |
183 [М-СНзГ |
170 [M-C2H4f |
165 [M-SH]+ |
137 [M-SC2H5]+ |
95 [C4H3N2O]+ |
61 [SC2H5]+ |
- |
|
I, % |
100 |
76 |
36 |
80 |
21 |
47 |
12 |
— |
|
|
2d C6HgN3OS |
m/z |
171 [M] |
156 [M-CH3]+ |
143 [M-C2H4]+ |
138 [M-SH]+ |
110 [M-SC2H5]+ |
95 [C4H3N2O]+ |
61 [SC2H5f |
- |
|
I, % |
100 |
22 |
17 |
60 |
56 |
18 |
8 |
- |
|
Окончание таблицы
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
зь c12h9n2osf3 |
m/z |
286 [M] |
267 [M-Ff |
253 [M-SHf |
209 [M-Ph] |
163 [M-SCH2Ph]+ |
91 [CH2Ph]+ |
77 [Ph]+ |
- |
|
I, % |
44 |
4 |
20 |
3 |
3 |
100 |
20 |
||
|
Зс C!4H16N2OS |
m/z |
260 [M] |
245 [МСН3Г |
227 [M-SH]+ |
183 [M-Ph]+ |
138 [M-SCH2Ph]+ |
91 [CH2Ph]+ |
- |
- |
|
I, % |
50 |
4 |
30 |
4 |
8 |
100 |
— |
||
|
4а C13H12N7OS |
m/z |
244 [M] |
109 [M-SH]+ |
165 [M-Ph]+ |
135 [SSt]+ |
140 [MStr |
109 [M-SSt]+ |
103 [St]+ |
77 [Phf |
|
I, % |
56 |
3 |
78 |
10 |
100 |
11 |
12 |
13 |
|
|
4е C12H9N2OS |
m/z |
230 [Ml |
197 [M-SH]+ |
153 [M-Ph]+ |
135 [SSt]+ |
128 [M-St]+ |
103 [St]+ |
95 [M-SSt]+ |
77 [Phf |
|
I, % |
91 |
4 |
100 |
60 |
98 |
30 |
62 |
22 |
|
|
5а C8HI0N2OS |
m/z |
182 [M] |
167 [M-CH3]+ |
149 [M-SH]+ |
109 [M-SA11]+ |
95 [C4H3N2O]+ |
41 [Allf |
- |
- |
|
I, % |
37 |
100 |
57 |
22 |
4 |
25 |
— |
— |
|
|
5b C8H7N2OSF3 |
m/z |
236 [M] |
221 [M-CH3]+ |
203 [M-SH]+ |
163 [M-SA11]+ |
69 [CF3]+ |
41 [All]+ |
- |
- |
|
I, % |
19 |
100 |
57 |
24 |
27 |
39 |
— |
— |
|
|
5с C10H14N2OS |
m/z |
210 [M] |
195 [M-CH3]+ |
177 [M-SH]+ |
137 [M-SA11]+ |
95 [C4H3N2O]+ |
41 [All]+ |
- |
- |
|
I, % |
44 |
100 |
54 |
15 |
16 |
41 |
— |
||
|
5е C7H8N2OS |
m/z |
168 [M] |
153 [M-CH3]+ |
135 [M-SH]+ |
95 [M—SA11]+ |
95 [C4H3N2O]+ |
41 [All]+ |
- |
- |
|
I, % |
16 |
100 |
6 |
28 |
5 |
10 |
— |
||
|
6а C9H12N2OS |
m/z |
196 [M] |
181 [M-CH3]+ |
163 [M-SH]+ |
155 [M-A11]+ |
109 [M-C4H7S]+ |
55 [C4H7]+ |
41 [Allf |
- |
|
I, % |
15 |
100 |
57 |
8 |
15 |
10 |
9 |
„ |
|
|
6b c9h9n2osf3 |
m/z |
250 [M] |
235 [M-CH3]+ |
217 [M-SH]+ |
- |
163 [M-C4H7S]+ |
55 [c4H7f |
41 [All]+ |
69 [CF3]+ |
|
I, % |
13 |
50 |
100 |
18 |
27 |
2 |
2 |
||
|
6c CnH16N2OS |
m/z |
224 [M] |
209 [M-CH3]+ |
217 [M-SH]+ |
183 [M-A11]+ |
137 [M-C4H7S]+ |
55 [C4H7]+ |
41 [All]+ |
- |
|
I, % |
26 |
100 |
76 |
11 |
8 |
21 |
14 |
||
|
6d C8HnN3OS |
m/z |
197 [M] |
182 [M-CH3]+ |
164 [M-SH]+ |
156 [M-A11]+ |
110 [M-C4H7S]+ |
55 [C4H7]+ |
41 [All]+ |
- |
|
I, % |
34 |
100 |
62 |
6 |
34 |
15 |
8 |
||
|
7a C8H9N2OSC1 |
m/z |
216 [M] |
181 [M-C1]+ |
148 [MSHClf |
109 [C3H7C1S]+ |
77 [C3H7C1]+ |
41 [Allf |
- |
- |
|
I, % |
22 |
100 |
45 |
20 |
15 |
10 |
— |
||
|
7b CsH6N2OSaF3 |
m/z |
270 [M] |
234 [M-C1]+ |
201 [M-SH-C1]+ |
109 [C3H7C1S]+ |
77 [C3H7C1]+ |
41 [All]+ |
- |
- |
|
1,% |
17 |
100 |
37 |
10 |
67 |
34 |
— |
— |
|
|
7c C10H12N2OSC1 |
m/z |
244 [M] |
209 [M-C1]+ |
176 [M-SH-C1]+ |
110 [C3H7C1S]+ |
77 [C3H7C1]+ |
41 [AH]+ |
- |
- |
|
I, % |
26 |
100 |
57 |
8 |
26 |
17 |
|||
|
8a C9H12N2OS |
m/z |
196 [M] |
181 [M-CH3]+ |
163 [M-SH]+ |
142 [M-c4n7r |
109 [M-SC4H7]+ |
95 [C4H3N2O]+ |
55 [C4H7]+ |
41 [Allf |
|
I, % |
15 |
10 |
20 |
100 |
19 |
16 |
15 |
13 |
|
|
8b C9H9N2OSF3 |
m/z |
250 [Ml |
- |
217 [M-SH]+ |
196 [M-C4H7]+ |
163 [M-SC4H7]+ |
95 [C4H3N2O]+ |
55 [C4H7]+ |
41 [Allf |
|
I, % |
4 |
— |
12 |
100 |
34 |
4 |
17 |
13 |
|
|
8c C„H16N2OS |
m/z |
224 [Ml |
209 [M-CH3]+ |
191 [M-SH]+ |
169 [M-C4H7]+ |
137 [M-SC4H7]+ |
95 [C4H3N2O]+ |
55 [C4H7]+ |
- |
|
I, % |
14 |
7 |
10 |
100 |
6 |
4 |
26 |
— |
Примечание. I - интенсивность относительно максимального пика; АП - СН2=СН-СН2;
St C6H5CH-CH.
Экспериментальная часть
Масс-спектры сняты на хроматомасс-спектрометре ГХ/МС-ЭВМ фирмы Agilent Technologies, газовый хроматограф 6890N, масс-селективный детектор 5975. Синтез соединений 4е и 5а-с, 6 a-d, 7а-с описаны в работах [1, 4-6].
Общая методика алкилирования 6-метил-, 6-амино-, 6-метил-5-этил-2-тиоурацилов
К раствору 2 ммоль натриевой соли 2-тиоурацила или 6-метил-, 6-амино-, 6-метил-5-этил-2-тиоурацилов, 2 ммоль NaOH в 5 мл воды прибавляют 20 мг тетрабутиламмоний бромида или несколько капель диметилсульфоксида, 2 ммоль галогеналкена (диметилсульфат, иодистый этил, хлористый бензил, 3-бромпропен или бромистый бутенил) и перемешивают на магнитной мешалке 2 ч. Реакционную смесь нейтрализовывают уксусной кислотой. Выпавший осадок отфильтровывают, промывают водой и перекристаллизовывают из гексана.
2-Метилтио-6-метил-4(3/7)-пиримидинон (1а). Выход 0,240 г (77 %), т. пл. 210 °C, R/=0,60.
2-Метилтио-6-метил-5-этил-4(ЗД)-пиримидинон (1с). Выход 0,295 г (80%), т. пл. 197 °C, R/=0,59.
2-Этилтио-6-метил-4(377)-пиримидинон (2а). Выход 0,245 г (72 %), т. пл. 284 °C.
2-Этилтио-6-метил-5-этил-4(ЗД)-пиримидинон (2с). Выход 0,297 г (75 %), т. пл. 225 °C, R/=0,92.
2-Этилтио-6-амино-4(377)-пиримидинон (2d). Выход 0,230 г (67 %), т. пл. 198 °C, R/=0,06.
2-Бензилтио-6-метил-5-этил-4(3/7)-пиримидинон (Зс). Выход 0,338 г (65 %), т.пл. 135 °C. 2-Стирилтио-6-метил-4(ЗН)-пиримидинон (4а). Выход 0,278 г (57 %), т. пл. 176 °C, R/=0,21. 2-Аллилтио-4(3/7)-пиримидинон (5е). Выход 0,225 г (67 %), т. пл. 117 °C, Ry=0.60.
2-Бутенилтио-6-метил-4(3//)-пиримидинон (8а). Выход0,215 г (55 %), т. пл. 178 °C, R/=0,32.
2-Бутенилтио-6-метил-5-этил-4(377)-пиримидинон (8с). Выход 0,210 г (47 %), т. пл. 80 °C, R/=0,77.
Общая методика алкилирования 6-трифторметил-2-тиоурацилов
К раствору 1 ммоль натриевой соли 6-трифторметил-2-тиоурацила в 5 мл диметилформамида добавляют 1 ммоль галогеналкена и перемешивают на магнитной мешалке 2 ч. К реакционной смеси прибавляют 30 мл воды и отфильтровывают выпавший белый осадок.
2-Метилтио-6-трифторметил-4(ЗД)-пиримидинон (1Ь). Выход 0,231 г (55 %), т. пл. 120 °C, R/=0,42.
2-Этилтио-6-трифторметил-4(3/7)-пиримидинон (2Ь). Выход 0,260 г (58 %), т. пл. 145 °C, R/=0,47.
2-Бензилтио-6-трифторметил-4(3/7)-пиримидинон (ЗЬ). Выход 0,429 г (75 %), т. пл. 100 °C, R^OJO.
2-Бутенилтио-6-трифторметил-4(ЗЯ)-пиримидинон (8Ь). Выход 0,320 г (64 %), т. пл. 95 °C, R/=0,23.
Заключение
Изучено поведение при электронной ионизации 2-метилтио-, 2-этилтио-, 2-бензилтио-, 2-стириллтио-, 2-аллилтио-, 2-металлилтио-, 2-(3-хлораллил)тио- и 2-бутенилтио-4(377)-пирими-динонов. В масс-спектрах 2-алкил- и 2-аллилилтио-6-метил- и 6-метил-5-этил-4(3/7)-пирими-динонов максимальным является пик [М-СН3]+ что обусловлено образованием ароматического катиона 2-алкилтио-4-гидрокси-7-метил-1,3-диазепиния в случае 2-алкилтио-6-метил-5-этил-4(377)-пиримидинонов, а в случае S-аллильных производных 2-тиоурацилов за исключением S-хлораллильных производных - образованием 7-оксотиазоло[3,2-а]пиримидиниевой системы. Найдено, что наличие пика [M-SH]+ в масс-спектрах обусловлено образованием систем: пири-допиримидиния для бутенилсульфидов 8 а-с и пирролопиримидиния для аллилсульфидов 5а-е, ба-d и 7а-с. При электронной ионизации и фрагментации S-производных 2-тиоурацилов образуется катион 4-пиримидинон.
Список литературы Исследование S-производных 2-тиоурацилов методом масс-спектрометрии
- Масс-спектрометрия органических соединений/под ред. Н.С. Вульфсона, В.Г. Заикина, А.И. Микой. -М.: Химия, 1986. -311 с.
- Масс-спектрометрия в органической химии/под ред. А.Т. Лебедева. -М.: Бином Лаборатория знаний, 2003. -496 с.
- Сливка, Н.Ю. Галогенциклизация замещенных 2-(алкенилтио)пиримидин-6-онов/Н.Ю. Сливка, Ю.И. Геваза, В.И. Станинец//Химия гетероциклических соединений. -2004. -№5.-С. 776-783.
- Фролова, Т.В. Синтез и исследование S-аллильных производных 2-тиоурацилов/Т.В. Фролова, Д.Г. Ким, П.А. Слепухин//Вестник ЮУрГУ. Серия «Химия». -2010. -Вып. 3. -№ 11.-С9-15.
- Ким, Д.Г. Синтез и свойства 2-стирилтио-6(1H)-пиримидинонов/Д.Г. Ким, В.И. Шмыгарев//Журнал органической химии. -1997. -Т. 33. -Вып. 9. -С. 1416-1418.
- Ким, Д.Г. Иодциклизация 2-аллилтио-4(ЗН)-пиримидинов/Д.Г. Ким, В.И. Шмыгарев//Химия гетероциклических соединений. -1995. -№ 2. -С. 211-213.


