Исследование сесквитерпеновых лактонов Artemisia kobstanica
Автор: Алескерова Аделя Новруз, Джахангирова Илхама Рафик, Керимли Эльвин Гаджи, Серкеров Сираджеддин Вели
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 10 т.8, 2022 года.
Бесплатный доступ
Впервые исследованы сесквитерпеновые лактоны полыни Artemisia kobstanica Rzazade из флоры Азербайджана. Путем колоночной хроматографии из надземной части выделены 3 сесквитерпеновых лактона C15H18O3, т. пл. 171-172 °C (1), C15H20O4, т. пл. 124-126 °C (2), C15H18O4, т. пл. 202-203 °C (3). Лактоны 1 и 3 на основании физико-химических и спектральных (ИК-, и 1H ЯМР-спектры) данных идентифицированы с α-сантонином и артемизином, соответственно. Вещество 2 оказалось новым, впервые выделенным из исследуемого вида полыни мерезолидом. На основании данных, полученных при интерпретации ИК- и 1H ЯМР-спектров ему предложено строение 3-кето-4,5-эпокси-8β, 7α, 11βН-гермакр-10,15-ен-8,12-олида.
Полынь, лактоны, артемизин
Короткий адрес: https://sciup.org/14126119
IDR: 14126119 | УДК: 582.998.1:547.913.2 | DOI: 10.33619/2414-2948/83/05
Текст научной статьи Исследование сесквитерпеновых лактонов Artemisia kobstanica
Бюллетень науки и практики / Bulletin of Science and Practice Т. 8. №10. 2022
УДК 582.998.1:547.913.2
Многие экстракты, полученные из видов полыни, используются для лечения эпилепсии, депрессии, бессонницы, раздражительности, психоневрозов и стресса [4]. Эти виды обладают широким спектром биологической активности, такой как противомалярийная, антисептическая, антибактериальная, противоопухолевая, гепатопротекторная, спазмолитическая и противоревматическая активность [4–6].
Известно, что род Artemisia содержит много биологически активных соединений, таких как артемизин, который обладает противомалярийным и цитотоксической активностью в отношении опухолевых клеток [7], арглабин — другая биологически активная молекула, используемая для лечения некоторых видов рака в бывшем СССР [8].
Целью исследования явилось изучение сесквитерпеновых лактонов надземной части Artemisia kobstanica Rzazade.
Материалы и методы исследования
Получение суммы экстрактивных веществ . 250 г мелкоизмельченная воздушно-сухая надземная часть Artemisia kobstanica Rzazade, собранная в период бутонизации в окрестностях с. Нариманабад Шемахинского района Азербайджанской Республики, трехкратно (каждый раз в течение 3 дней) экстрагировали ацетоном. Экстракт отфильтровывали, ацетон отгоняли на роторном испарителе. Полученный остаток 11,63 г темно-зеленая смола. Выход составлял 4,65%.
Хроматографирование суммы экстрактивных веществ. 11,60 г смолы растворяли в 50 мл хлороформа и хроматографировали на колонке, заполненной окисью алюминия (нейтральная, III–IV ст. акт. h=45, d=2,50 см). Объем каждой фракции 100 мл.
Элюирование проводили смесью гексана и бензола (в соотношении 2:1; 1:1; 1:2; 1:3; 1:5; 1:7), бензолом, смесью бензола и хлороформа (в соотношении 2:1; 1:1; 1:2; 1:3; 1:5) и хлороформом.
Из фракции 25–27 элюируемой смесью гексана и бензола в соотношении 1:7 выделили кристаллическое вещество (1) состава C 15 H 18 O 3 , т. пл. 171-172°С (из водного этанола). Из фракций 32–34, элюируемой бензолом получили кристаллы (2), которые после перекристаллизации из водного спирта имели состав C 15 H 20 O 4 , т. пл. 124-126°C. Фракция 41– 44, элюируемые хлороформом содержали кристаллическое вещество (3) состава С 15 H 18 O 4 , т. пл. 202–203 °C (из водного спирта).
ИК-спектры снимали на спектрометре UR-20, спектры 1H ЯМР и 13C на спектрометре Bruker 300 с резонансной частотой 300 МГц для 1H, для 13С 75 МГц. Растворитель СdCl 3 . Химические сдвиги даны по δ шкале. Внутренний стандарт ТМС. Индивидуальность выделенных соединений определяли на пластинках Silufol UV 254, температуру плавления — на столике Boetiusa. Вещества 1 и 3 анализируя физико-химические свойства, в основном, путем непосредственного сравнения ИК-спектров с таковыми достоверных образцов α-сантонина и артемизина, соответственно, идентифицировали с α-сантонином и артемизином. Смешанные пробы 1 и 3 с достоверными образцами упомянутых лактонов депрессии температуры плавления не дают.
Результаты и их обсуждение
Впервые исследованы сесквитерпеновые лактоны вида полыни, описанного Р. Я. Рзазаде из флоры Азербайджана [9].
Хроматографированием суммы экстрактивных веществ (11,60 г) на колонке заполненной нейтральной окисью алюминия (III–IV степени активности) и элюированием гексаном, смесью гексана и бензола в различных соотношениях, бензолом, хлороформом выделены 3 сесквитерпеновых лактона С 15 H 18 O 3 , т. пл. 171–172°С (1), С 15 H 18 O 4 , т. пл. 124–126 °С (2), С 15 H 18 O 4 , т. пл. 202–203 °С (3). Лактоны 1 и 3 на основании данных ИК-, и 1Н ЯМР-спектров, а также с непосредственным сравнением ИК-спектров со спектрами достоверных образцов идентифицировали соответственно с α-сантонином и артемизином. Вещество 2, выделенный из фракций 32–34 элюированием хроматографической колонки бензолом оказалось новым С 15 H 20 O 4 , т. пл. 124-126°С (из водного этанола) и названо мерезолидом. В области характеристических частот ИК-спектра соединения обнаружены полосы поглощения карбонильной группы В-лактонного цикла (1795 см-1), карбонила кетона (1705 см-1) и двойной связи (1652 см-1). Интенсивная полоса при 915 см-1, имеющая в ИК-спектре вещества дает возможность характеризовать двойную связь как метиленовую, находящаяся вне конъюгации с карбонильной группой лактонного цикла [10].
В 13С ЯМР-спектре мерезолида, снятой с полным подавлением спин-спинового взаимодействия с протенами проявляются 15 синглетных сигналов (12; 50; 26,00; 29,50; 39,00; 40,00; 48,00; 51,50; 53,00; 55,00; 55,50; 82,00; 110,00; 143,00; 180,00; 206,0 м. д.), которые соответствуют 15 атомам углерода в его элементном составе.
1Н ЯМР-спектр исследуемого соединения имеет сигнал вторичной метильной группы (1,10 м. д., J=7,00 Гц, 3Н, СН 3 -СН<) винилметильной группы (СН 3 -С=) или при окисном цикле метильной (3Н, С, 2,20 м. д.) и экзоциклической метиленовой группы (с 4,82 и 4,95 м. д., 1Н каждый, СН 2 =С<). Другие сигналы, которые могли бы принадлежать к олефиновым протонам, в спектре отсутствуют. В основе мерезолида лежит гермакрановый углеродный скелет и содержит четыре кислородного атома. Из них два атома образует γ-лактонный цикл, один атом находился в виде кетонной группы, четвертый, по-видимому образует окисное кольцо. Высказанное предложение поддерживают данные 1H, 13C и 13C Dept ЯМР-спектров. Так 13C Dept 135 ЯМР-спектр лактона обнаруживает 11 сигналов, принадлежащих к 11 протонированным атомам углерода молекулы мерезолида: 12,50; 26,00; 29,50; 39,00; 40,00; 48,00; 53,00; 55,00; 55,50; 82,00; 110,00, характеризующиеся 2СН 3 , 4СН 2 , 4СН и 1СН 2 = групп структуры мерезолида. Из четырех однопротонных сигналов, обнаруживаемых 1Н ЯМР-спектром в области 2,40–4,00 м. д. сигнал при 2,90 м. д. (1Н, J 1 =3,0; J 2 =12,0 Гц) по значению химического сдвига характерен таковому для протона при окисном цикле [11].
Согласно литературным данным сигнал метильной группы при окисном цикле в ЯМР-спектре проявляется: эстафиатине при 1,53 [10–12], арглабине — 1,34 м. д. [13], арборесцине — 1,33 м. д. [14, 15].
В 1Н ЯМР-спектре мерезолида сигнал метильной группы при окисном цикле обнаруживается при 2,20 м. д. Парамагнитный сдвиг сигнала СН 3 -группы при окисном цикле, по-видимому, вызван электроноакцепторным влиянием карбонилакетонной группы, находящейся в вицинальном положении. Подобный парамагнитный сдвиг обнаружен в ЯМР-спектре бадхызинина. В спектре последнего сигналы метиленовой связи, обычно проявляемые в виде однопротонных синглетов при 4,80–5,00 м. д., из-за вицинального положения к эпокси группе проявляются в интервале 5,40–5,88 м. д., соответсвенно. Аналогичным образом метильная группа при оксином цикле из-за вицинального положения к кетонной группе при С-3, обнаруживается на 0,40 м. д. в слабом магнитном поле спектра [15 , 16] (Таблица).
Бюллетень науки и практики / Bulletin of Science and Practice Т. 8. №10. 2022
Таблица
Данные 1Н ЯМР-спектра мерезолида 300 МГц (CdCl 3 -d6)
|
С атом |
δ н м. д., J/Hz |
С атом |
δ |
|
1 |
1,89 (2Н, t., J 1 =J 2 =11,40 |
9 |
— |
|
2 |
2,29 (2H, t., J 1 =J 2 =11,40 |
10 |
— |
|
— |
11 |
2,48 (1H, m) |
|
|
— |
12 |
— |
|
|
5 (9) |
2,90 (1H, k, J 1 =3,90; J 2 =12,00 |
13 |
1,10 (3H, d. J=7,0) |
|
7 |
2,76 (1H, m) |
14 |
2,22 (3H, s) |
|
8 (6) |
3,83 (1H, sk, J 1 =3,90; J 2 =11,00; J 3 =15,30 |
15 |
4,82 (1H,s); 4,95 (1H,s) |
Обсуждая вопрос о положении экзометиленовой двойной связи, кетонной группы, окисного и лактонного цикла в гермакрановом углеродном скелете следует отметить, что экзометиленовая группа находится при С-10. Это заключение сделано на том основании, что наряду с 1Н ЯМР-спектральным данным в структуре гермакронолидов, выделенных из представителей рода Artemisia L. экзометиленовая группа находится при С-10. Например, в структуре гермакранолидов искендеролида, шоначалина А и С [15] и др. что касается местонахождения кетонной группы и окисного цикла то заметим, что как было отмечено, синглет метильной группы окисного цикла из-за вицинального положения к кетонной группе претерпевает парамагнитный сдвиг на 0,4 м. д. Следует отметить, что у лактонов группы α-сантонина, выделенных из видов Artemisia кетонная группа находится при С-3, а у группы тауремизина кетонная группа (или ОН-группа), в основном, находится при С-1 [16 , 17].
Исходя из данных, полученных при интерпретации 1Н, 13С, 13С Dept 135 ЯМР-спектров исследуемого лактона (мультиплетность, значения констант спин-спинового взаимодействия лактонного протона и эпокси группы, значения химического сдвига метильной группы при окисном цикле (парамагнитный сдвиг на 0,4 м. д.) мерезолиду можно предложить две альтернативные структуры 1 или 2 (Рисунок).
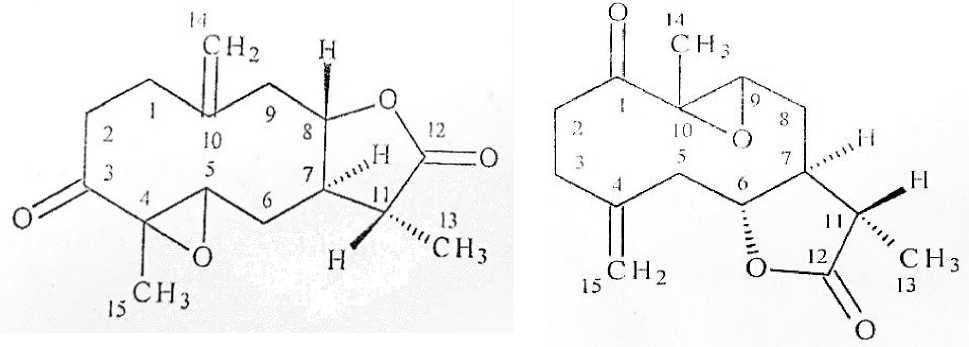
а) б)
Рисунок. Структуры мерезолида (а, б)
Известно, что в процессе биосинтеза происходящие в организме растений образуются вещества с идентичным положением функциональных групп в углеродном скелете и идентичный в отношении стереохимии [18, 19]. Поэтому, из биогенетической точки зрения можно полагать, что, вероятно, мерезолид имеет строение 3-кето-4,5-эпокси-7α,8β,11βН-гермакр-10,15-ен-8,12-олида (Рисунок а).
Список литературы Исследование сесквитерпеновых лактонов Artemisia kobstanica
- Oberprieler C. et al. Tribe Anthemideae Cass. 2009.
- McArthur E. D. Artemisia systematics and phylogeny: cytogenetic and molecular insights // Proceedings RMRS. 1998. №21. P. 67.
- Martin J., Torrell M., Korobkov A. A., Vallès J. Palynological features as a systematic marker in Artemisia L. and related genera (Asteraceae, Anthemideae)-II: implications for Subtribe Artemisiinae delimitation // Plant Biology. 2003. V. 5. №1. P. 85-93. https://doi.org/10.1055/s-2003-37979
- Walter H. L., Memory P. F., Elvin L. Medicinal botany, 2nd. 2003.
- Terra D. A., Amorim L. D. F., Catanho M. T. J. D. A., Fonseca A. D. S. D., Santos-Filho S. D., Brandâo-Neto J., Bernardo-Filho M. Effect of an extract of Artemisia vulgaris L. (Mugwort) on the in vitro labeling of red blood cells and plasma proteins with technetium-99m // Brazilian Archives of Biology and Technology. 2007. V. 50. P. 123-128. https://doi.org/10.1590/S1516-89132007000600015
- Hussain A., Hayat M. Q., Sahreen S., ul Ain Q., Bokhari S. A. Pharmacological Promises of Genus Artemisia (Asteraceae): a Review: Pharmacological Promises of Genus Artemisia // Proceedings of the Pakistan Academy of Sciences: B. Life and Environmental Sciences. 2017. V. 54. №4. P. 265-287-265-287.
- Bilia A. R., de Malgalhaes P. M., Bergonzi M. C., Vincieri F. F. Simultaneous analysis of artemisinin and flavonoids of several extracts of Artemisia annua L. obtained from a commercial sample and a selected cultivar // Phytomedicine. 2006. V. 13. №7. P. 487-493. https://doi.org/10.1016/j.phymed.2006.01.008
- Naqvi S. A. H., Khan M. S. Y., Vohora S. B. Antibacterial, antifungal and anthelmintic studies on Ochrocarpus longifolius // Planta Medica. 1976. V. 29. №1. P. 98-100. https://doi.org/10.1055/s-0028-1097636
- Рзазаде Р. Я. Новые виды, ряды и подроды кавказских полыней // Известия АН Азербайджанской ССР. 1955. С. 17-35.
- Беллами Л. Д. Инфракрасные спектры сложных молекул. М.: Изд-во иностр. лит., 1963. 590 с.
- Кагарлицкий А. Д., Адекенов С. М., Куприянов А. Н. Сесквитерпеновые лактоны растений Центрального Казахстана. Алма-Ата: Наука КазССР, 1987. 237 с.
- Snchez-Viesca F., Romo J. Estafiatin, a new sesquiterpene lactone isolated from Artemisia mexicana (Willd) // Tetrahedron. 1963. V. 19. №8. P. 1285-1291.
- Адекенов С. М., Мухаметжанов К. М., Кагарлицкий А. Д., Куприянов А. Н. Арглабин-новый сесквитерпеновый лактон из Artemisia glabella // Химия природных соединений. 1982. №5. С. 655-656.
- Bates R. B., Cekan Z., Prochazka V., Herout V. The structure of arborescin // Tetrahedron Letters. 1963. V. 4. №17. P. 1127-1130. https://doi.org/10.1016/S0040-4039(01)90788-9
- Серкеров С. В., Мехтиева Н. П. Новый компонент Eupatorium cannabinum L. // Химия природных соединений. 2009. Т. 3. С. 318-320.
- Серкеров С. В. Терпеноиды и фенольные соединения растений семейств Asteraceae и Apiaceae: автореф. дисс. ... д-ра хим. наук. Ташкент, 1991. 52 с.
- Рыбалко К. С. (1978) Природные секвитерпеновые лактоны. М., 320 с.
- Serkerov S. V. Stereochemistry of the eudesmanolides ofFerula oopoda // Chemistry of Natural Compounds. 1980. V. 16. №4. P. 366-367. https://doi.org/10.1007/BF00568369
- Serkerov S. V. Stereochemistry of guaianolides ofFerula oopoda // Chemistry of Natural Compounds. 1980. V 16. №5. P. 448-451. https://doi.org/10.1007/BF00571035


