Исследование строения дикарбоксилатов трис(4-фторфенил) (4-FC6H4)3Sb[OC(O)R]2(R=C6H3F2-2,3, C6H3(NO2)2-3,5, C6H4OMe-2,CF2Br, CH=CHPh,CH3, C?CH)
Автор: Белов Василий Васильевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.13, 2021 года.
Бесплатный доступ
Взаимодействием трис(4-фторфенил)сурьмы с 2,3-дифторбензойной, 3,5-динитробензойной, 2-метоксибензойной, бромдифторуксусной, фенилакриловой, муравьиной и пропиоловой кислотами в присутствии трет-бутилгидропероксида (1:2:1 мольн.) в диэтиловом эфире при комнатной температуре синтезированы дикарбоксилаты трис(4-фторфенил)сурьмы (4-FC6H4)3Sb[OC(O)R]2, где R = C6H3F2-2,3 (1), C6H3(NO2)2-3,5 (2), C6H4OMe-2 (3), CF2Br (4), CH=CHPh (5), CH3 (6), и C≡CH (7). В ИК-спектрах соединений 1-7, снятых на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000-400 см-1, имеются полосы поглощения карбонильных групп, которые смещены в область низкочастотных колебаний по сравнению с ИК-спектрами исходных кислот. Согласно данным РСА, проведенного на дифрактометре D8 QUEST фирмы Bruker, кристаллографические параметры элементарной ячейки соединения 1: пространственная группа Р-1, а = 9,034(4), b = 11,351(8), c = 14,814(9) Å, α = 70,11(3)°, β = 88,60(2)°, γ = 87,03(2)°, V = 1426(15) Å3, ρвыч = 1,679 г/см3, Z = 2. Атом Sb в комплексе 1 имеет координацию тригональной бипирамиды с карбоксилатными лигандами в аксиальных положениях. Аксиальный угол OSbO составляет 176,95(6)º. Длины связей Sb-O и Sb-С равны 2,135(2), 2,121(2) и 2,113(3)-2,116(3) Å. Расстояния Sb···O=С составляют 3,040(2), 2,861(3) Å, что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å). Атом сурьмы выходит из экваториальной плоскости [C3] на 0,038 Å. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2051716; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Триc(4-фторфенил)сурьма, дикарбоксилат, реакция окислительного присоединения, ик-спектр, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147236609
IDR: 147236609 | УДК: 549.242+547.53.024+548.312.2+548.312.5 | DOI: 10.14529/chem210408
Текст научной статьи Исследование строения дикарбоксилатов трис(4-фторфенил) (4-FC6H4)3Sb[OC(O)R]2(R=C6H3F2-2,3, C6H3(NO2)2-3,5, C6H4OMe-2,CF2Br, CH=CHPh,CH3, C?CH)
Дикарбоксилаты трис (4-фторфенил)сурьмы, трис (3-фторфенил)сурьмы и три- пара- толилсурьмы, полученные по реакции окислительного присоединения из триарилсурьмы и карбоновых кислот HX в присутствии пероксида активно изучаются в работах [1–22]. В продолжение исследования особенностей синтеза и строения дикарбоксилатов триарилсурьмы синтезирован ряд дикарбоксилатов трис (4-фторфенил)сурьмы (4-FC 6 H 4 ) 3 Sb[OC(O)R] 2 из трифенилсурьмы и трет -бутилгидропероксида в присутствии 2,3-дифторбензойной, 3,5-динитробензойной, 2-метоксибензойной, бромдифторуксусной, фенилакриловой, муравьиной и пропиоловой кислотами . Данный метод синтеза выделяется одностадийностью, мягкими условиями протекания реакции, высоким выходом и чистотой целевого продукта.
Экспериментальная часть
Синтез бис (2,3 - дифторбензоато)[ трис (4 - фторфенил)сурьмы] (4-FC 6 H 4 ) 3 Sb[OC(O)C 6 H 3 F 2 -2,3] 2 (1)
Смесь 150 мг (0,368 ммоль) трис (4-фторфенил)сурьмы, 115 мг (0,737 ммоль) 2,3-дифторидбензойной кислоты и 48 мг (0,368 ммоль) 70%-ного раствора гидропероксида третичного бутила в 30 мл диэтилового эфира выдерживали при 20 °С в течении 24 ч. После медленного удаления растворителя получили 135 мг (78 %) бесцветных кристаллов, которые после перекристаллизации из смеси бензол–гептан (2:1) имели t пл = 128 °C. ИК-спектр, ν , см - 1: 3167, 3099, 3068,
3045, 2991, 2958, 2927, 2856, 1643, 1631, 1577, 1485, 1423, 1394, 1350, 1307, 1294, 1273, 1226, 1165, 1151, 1064, 1012, 954, 831, 786, 758, 721, 702, 677, 632, 584, 511, 470, 459, 418. Найдено, %: С 53,09; Н 2,57. C 32 H 18 F 7 O 4 Sb. Вычислено, %: С 53,14; Н 2,51.
Соединения 2 – 6 синтезировали по аналогичной методике.
Бис (3,5 - динитробензоато)[ трис (4 - фторфенил)сурьма] (4-FC 6 H 4 ) 3 Sb[OC(O)C 6 H 3 (NO 2 ) 2 -3,5] 2 (2) , бесцветные прозрачные кристаллы, выход 95 %, t пл = 199,0 °С. ИК-спектр, ν , см - 1: 3095, 2976, 2881, 1676, 1627, 1583, 1544, 1492, 1460, 1396, 1346, 1309, 1276, 1232, 1180, 1074, 1010, 921, 833, 785,723, 698, 586, 553, 511, 459, 418. Найдено, %: С 46,29; Н 2,25. C 32 H 18 F 3 N 4 O 12 Sb. Вычислено, %: С 46,34; Н 2,19.
Бис (2 - метоксибензоато)[ трис (4 - фторфенил)сурьма] (4-FC 6 H 4 ) 3 Sb[OC(O)C 6 H 4 OMe-2] 2 (3) , бесцветные прозрачные кристаллы, выход 82 %,t пл = 120,0 °С. ИК-спектр, ν , см - 1: 3099, 3068, 2960, 2933, 2839, 2378, 1606, 1593, 1579, 1560, 1521, 1490, 1465, 1440, 1392, 1367, 1301, 1292, 1276, 1255, 1220, 1182, 1165, 1097, 1051, 1026, 1018, 1012, 875, 837, 829, 806, 754, 704, 669, 582, 555, 513, 459, 443, 418. Найдено, %: С 57,52; Н 3,78. C 34 H 26 F 3 O 6 Sb. Вычислено, %: С 57,57; Н 3,70.
Бис (бромдифторацето)[ трис (4 - фторфенил)сурьма] (4-FC 6 H 4 ) 3 Sb[OC(O)CF 2 Br] 2 (4) , бесцветные прозрачные кристаллы, выход 67 %, t пл = 100,0 °С. ИК-спектр, ν , см - 1: 3074, 3057, 2964, 2929, 2860, 2794, 2657, 1716, 1583, 1494, 1398, 1332, 1309, 1234, 1153, 1130, 1072, 1008, 941, 815, 709, 605, 590, 561, 509, 435, 418. Найдено, %: С 34,81; Н 2,05. C 22 H 12 F 7 O 4 Br 2 Sb. Вычислено, %: С 34,86; Н 1,59.
Дициннамат трис (4 - фторфенил)сурьмы (4-FC 6 H 4 ) 3 Sb[OC(O)CH=CHPh] 2 (5) , бесцветные прозрачные кристаллы, выход 53 %, t пл = 113,7 °С. ИК-спектр, ν , см - 1: 3057, 3024, 2837, 2721, 2611, 2538, 2312, 1687, 1680, 1631, 1579, 1492, 1450, 1423, 1342, 1315, 1442, 1288, 1205, 1176, 1163, 1091, 1066, 985, 972, 937, 871, 825, 765, 705, 675, 592, 584, 542, 507, 480, 457, 441, 418. Найдено, %: С 61,60; Н 3,79. C 36 H 26 F 3 O 4 Sb. Вычислено, %: С 61,65; Н 3,74.
Бис (ацето)[ трис (4 - фторфенил)сурьма] (4-FC 6 H 4 ) 3 Sb[OC(O)CH 3 ] 2 (6) , бесцветные прозрачные кристаллы, выход 93 %, t пл = 193,0 °С. ИК-спектр, ν , см - 1: 3097, 3062, 2968, 2924, 2864, 1585, 1492, 1398, 1311, 1300, 1234, 1161, 1095, 1066, 1010, 947, 906, 871, 823, 702, 682, 617, 590, 563, 513, 509, 459, 416. Найдено, %: С 50,26; Н 3,51. C 22 H 18 F 3 O 4 Sb. Вычислено, %: С 50,31; Н 3,46.
Бис (пропиолато)[ трис (4 - фторфенил)сурьма] (4-FC 6 H 4 ) 3 Sb[OC(O)C≡CH] 2 (7) , бесцветные прозрачные кристаллы, выход 65 %, t пл = 115,0 °С. ИК-спектр, ν , см - 1: 3286, 3209, 3086, 2929, 2856, 2559, 2200, 2115, 2100, 1894, 1637, 1620, 1581, 1490, 1396, 1319, 1294, 1276, 1232, 1165, 1068, 1010, 941, 902, 840, 827, 821, 773, 715, 671. 663, 638, 613, 586, 509, 418. Найдено, %: С 52,82; Н 2,64. C 24 H 14 F 3 O 4 Sb. Вычислено, %: С 52,87; Н 2,59.
ИК-спектры соединений 1 – 7 записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетках KBr в области 4000–400 см–1.
Элементный анализ проведен на приборе Carlo-Erba 1106.
Рентгеноструктурный анализ (РСА) кристалла соединения 1 проводили на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [24], OLEX2 [25]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (для 1 № 2051716; или . Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1
|
Параметр |
1 |
|
Формула |
C 32 H 18 F 7 O 4 Sb |
|
М |
721,21 |
|
Сингония |
Триклинная |
|
Пр. группа |
P -1 |
|
a , Å |
9,034(4) |
|
b , Å |
11,351(8) |
|
c , Å |
14,814(9) |
|
α, град. |
70,11(3) |
|
β, град. |
88,60(2) |
|
γ, град. |
87,03(2) |
|
V , Å3 |
1426,7(15) |
|
Z |
2 |
|
ρ (выч.), г/см3 |
1,679 |
|
µ, мм–1 |
1,050 |
|
F (000) |
712,0 |
|
Размер кристалла, мм |
0,18 × 0,14 × 0,1 |
|
Область сбора данных по 2θ, град. |
7,05–54,28 |
|
Интервалы индексов отражений |
–11 ≤ h ≤ 11, –14 ≤ k ≤ 14, –18 ≤ l ≤ 18 |
|
Измерено отражений |
34707 |
|
Независимых отражений |
6288 ( R int = 0,0329) |
|
Переменных уточнения |
405 |
|
GOOF |
1,077 |
|
R -факторы по I>2σ (I) |
R 1 = 0,0269, wR 2 = 0,0625 |
|
R -факторы по все отражениям |
R 1 = 0,0337, wR 2 = 0,0658 |
|
Остаточная электронная плотность (max/min), e/Å3 |
0,55/–0,46 |
Таблица 2
|
Связь |
d, Å |
Угол |
ω , град |
|
Sb(1)–O(3) |
2,135(2) |
O(1)Sb(1)O(3) |
176,95(6) |
|
Sb(1)–O(1) |
2,121(2) |
C(21)Sb(1)O(3) |
88,67(9) |
|
Sb(1)–C(21) |
2,113(3) |
C(21)Sb(1)O(1) |
91,45(9) |
|
Sb(1)–C(1) |
2,120(2) |
C(21)Sb(1)C(1) |
110,33(10) |
|
Sb(1)–C(11) |
2,116(3) |
C(21)Sb(1)C(11) |
143,98(9) |
|
O(3)–C(47) |
1,305(3) |
C(1)Sb(1)O(3) |
89,00(8) |
|
O(4)–C(47) |
1,223(3) |
C(1)Sb(1)O(1) |
88,10(8) |
|
F(5)–C(4) |
1,361(3) |
C(11)Sb(1)O(3) |
89,29(9) |
|
O(1)–C(37) |
1,276(3) |
C(11)Sb(1)O(1) |
92,41(9) |
|
O(2)–C(37) |
1,224(3) |
C(11)Sb(1)C(1) |
105,58(10) |
|
F(1)–C(32) |
1,331(4) |
C(47)O(3)Sb(1) |
109,96(14) |
|
F(6)–C(14) |
1,358(3) |
C(37)O(1)Sb(1) |
116,44(16) |
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
Основные длины связей ( d ) и валентные углы ( ω ) в структуре 1
Обсуждение результатов
Установлено, что реакции трис (4-фторфенил)сурьмы с такими карбоновыми кислотами, как 2,3-дифторбензойная, 3,5-динитробензойная, 2-метоксибензойная, бромдифторуксусная, фени-лакриловая, муравьиная и пропиоловая в присутствии трет -бутилгидропероксида (мольное соотношение 1:2:1) протекают в эфире с образованием дикарбоксилатов трис (4-фторфенил)сурьмы, выделяемых с выходом 40–90 %.
(4-FC 6 H 4 ) 3 Sb + 2 HOC(O)R + t -BuOOH → (4-FC 6 H 4 ) 3 Sb[OC(O) R ] 2 +H 2 O + t -BuOH,
R = C 6 H 3 F 2 -2,3 ( 1 ), C 6 H 3 (NO 2 ) 2 -3,5 ( 2 ), C 6 H 4 OMe-2 ( 3 ),
CF 2 Br ( 4 ), CH=CHPh ( 5 ), CH 3 ( 6 ), C≡CH ( 7 )
Соединения 1 – 7 представляют собой бесцветные прозрачные кристаллы с четкой температурой плавления, хорошо растворимые в ароматических углеводородах и полярных растворителях. Строение комплексов подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
Инфракрасная спектроскопия
В ИК-спектрах дикарбоксилатов триарилсурьмы 1 - 7 , снятых на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетке KBr присутствуют полосы поглощения при 441–459 см–1, которые можно отнести к валентным колебаниям Sb - O. Кроме этих полос ИК-спектры содержат сильные полосы поглощения при 509–513 см–1, относящиеся к валентным колебаниям Sb - С. В ИК-спектрах дикарбоксилатов триарилсурьмы присутствуют также две полосы поглощения в области 1460 - 1490 см–1, характеризующие фенильные группы. Рассмотрение ИК-спектров дикарбоксилатов триарилсурьмы, снятых в интервале 400–4000 см–1, существенно помогает в ответе на вопрос -есть ли координация карбонильного атома кислорода на центральный атом сурьмы. В ИК-спектрах указанных соединений полосы валентных колебаний С=О (1606–1620 см–1) значительно смещены в низковолновую область по сравнению с ИК-спектрами карбоновых кислот (1662– 1702 см–1) [26] (табл. 3), что указывает на координацию атома сурьмы с атомом карбонильного кислорода.
Таблица 3
ИК-спектры дикарбоксилатов трис (4-фторфенил)сурьмы и карбоновых кислот в области валентных колебаний C=O, см–1
|
R |
|||||||
|
C 6 H 3 F 2 -2,3 |
C 6 H 3 (NO 2 ) 2 -3,5 |
C 6 H 4 OMe-2 |
CF 2 Br |
CH=CHPh |
CH 3 |
C≡CH |
|
|
Ar 3 Sb[OC(O)R) 2 |
1643 |
1627 |
1606 |
1716 |
1631 |
1585 |
1637 |
|
HOC(O)R |
1695 |
1707 |
1688 |
1770 |
1680 |
1727 |
1710 |
В ИК-спектре соединения 7 присутствует полоса, характеризующая тройную связь С ≡ С (2100 см–1). В спектрах соединений 1 , 2 , 3 и 5 , содержатся соответствующие двойной связи C=C колебания, характерные для кислот типа RCH=CHCOOH (1643–1676 см–1). Кроме того, в ИК-спектрах исследуемых соединений наблюдаются интенсивные полосы поглощения валентных колебаний фрагмента SbC 3 в интервале 509–511 см–1 соответственно и полосы валентных колебаний С - Н арильных фрагментов при 2800–3100 см–1, а также целый ряд колебаний разного типа, характерных для функциональных групп и заместителей в арильных кольцах и органическом радикале R карбоновой кислоты [27, 28]. В ИК-спектре соединения 2 , например, присутствуют полосы поглощения нитрогрупп, характеризующие валентные колебания NO 2 -групп (1309 и 1154 см–1 соответственно). Для сравнения, в ИК-спектре кислоты соответствующие полосы находятся при 1291 и 1547 см–1.
По данным РСА, в соединении 1 атомы Sb находятся в экваториальной плоскости и имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях (рис. 1).
В соединении 1 аксиальный угол OSbO составляет 176,95(6)º. Длины связей Sb-O и Sb-С равны 2,135(2), 2,121(2) и 2,113(3)-2,116(3) Å. Сумма экваториальных углов CSbC имеет значение 359,90(9)º. Атом сурьмы выходит из экваториальной плоскости [C 3 ] на 0,038 Å. Расстояния Sb···O=С составляют 3,040(2), 2,861(3) Å, что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å) [29].
Формирование кристаллической структуры соединения 1 обусловлено наличием межмолекулярных водородных связей H∙∙∙O(=C) 2,574 Å и H∙∙∙F 2,622 и 2,560 Å. Данные взаимодействия структурируют молекулы кристалла в слои, расположенные перпендикулярно кристаллографической оси b (рис. 2).
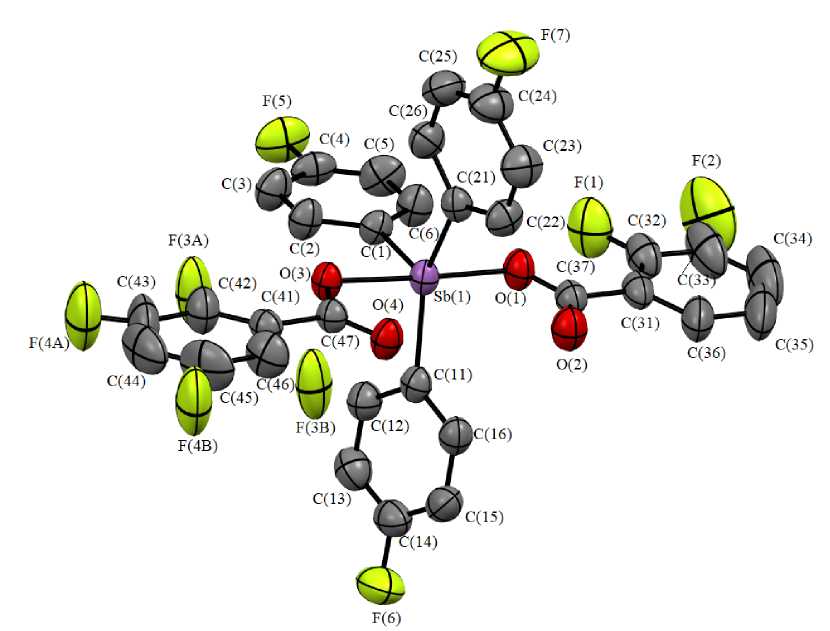
Рис. 1. Общий вид молекулы 1 (атомы водорода не показаны)
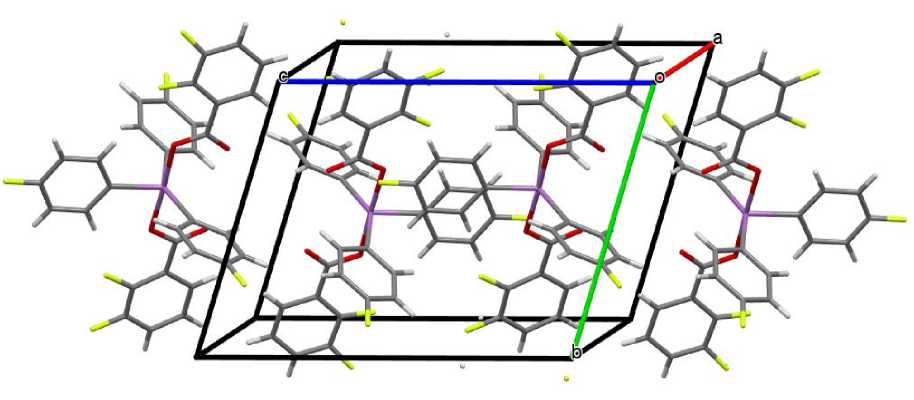
Рис. 2. Упаковка ионов комплекса 1 в кристалле (показан только один слой)
Выводы
Таким образом, в настоящей работе по реакции окислительного присоединения трис(4-фторфенил)сурьмы с 2,3-дифторбензойной, 3,5-динитробензойной, 2-метоксибензойной, бромдифторуксусной, фенилакриловой, муравьиной и пропиоловой кислотами в присутствии трет -бутилгидропероксида (1:2:1 мольн.) в диэтиловом эфире получены семь дикарбоксилатов триа-рилсурьмы типа (Ar)3Sb[OC(O)R]2. В ИК-спектрах полученных соединений наблюдаются полосы поглощения карбонильных групп, которые смещены в область низкочастотных колебаний по сравнению с ИК-спектрами исходных кислот, что указывает на координацию атома сурьмы с атомом карбонильного кислорода. Данные ИК-спектров соединений 1-7 подтверждают данные рентгеноструктурного анализа соединения 1, в котором атомы Sb имеют искаженную тригональ-но-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях, причем расстояния Sb···O=С меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å) и составляют 3,040(2), 2,861(3) Å.
Выражаю благодарность профессору В.В. Шарутину за проведенные рентгеноструктурные исследования.
Список литературы Исследование строения дикарбоксилатов трис(4-фторфенил) (4-FC6H4)3Sb[OC(O)R]2(R=C6H3F2-2,3, C6H3(NO2)2-3,5, C6H4OMe-2,CF2Br, CH=CHPh,CH3, C?CH)
- Improved Methods for the Synthesis of Antimony Triacetate, Triphenylantimonyl Diacetate and Pentaphenylantimoy / T.C. Thepe, R.J. Garascia, M.A. Selvoski et al. // Ohio J. Sci. - 1977. - V. 77, no.3. - P. 134-135.
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / B.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. химия. - 2020. - Т. 46, № 10. - C. 579-648. DOI: 10.31857/S0132344X20100011
- Шарутин, В.В. Синтез и строение фенилпропиолатов тетра- и трифенилсурьмы /
- B.В. Шарутин, О.К. Шарутина, А.Р. Котляров // Журнал неорганической химии. - 2015. - Т. 60, № 4. - С. 525. DOI: 10.7868/S0044457X15040236
- Шарутин, В.В. Синтез и строение фенилацетатов тетра- и трифенилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Журнал неорганической химии. - 2015. - Т. 60, № 9. - C. 1200. DOI: 10.7868/S0044457X15060148
- Шарутин, В.В. Синтез и строение дикарбоксилатов трис(4-фторфенилсурьмы): (4-FC6H4)3Sb[OC(O)R]2, R = CH2I, C6F5 / В.В. Шарутин, О.К. Шарутина // Известия Академии наук. Серия химическая. - 2017. - № 4. - С. 707-710.
- Шарутин, В.В. Синтез и строение дикарбоксилатов трис(4-фторфенил)сурьмы / В.В. Шарутин, О.К. Шарутина // Журнал общей химии. - 2016. - Т. 86, № 8. - С. 1366-1370.
- Synthesis and in vitro Antitumor of Some Triarylantimony Di(N-phenylglycinates) / Yu L., Ma Y-Q., Wang G-C., Li J-S. // Heteroat. Chem. - 2004. - V. 15. - P. 32-36. DÛI:10.1002/hc.10208
- Особенности строения дикарбоксилатов триорганилсурьмы R3Sb[OC(O)R')]2 / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина и др. // Координационная химия. - 2003. - Т. 29, № 11. -С. 843-851.
- Шарутин, В.В. Синтез и строение 4-оксибензоатов тетра- и трифенилсурьмы / В.В. Шару-тин, О.К. Шарутина, В.С. Сенчурин // Журнал неорганической химии. - 2014. - Т. 59, № 9. -С. 1182-1186. DOI: 10.7868/S0044457X14090189
- Шарутин, В.В. Синтез и строение пропиолатов три- и тетрафенилсурьмы / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин // Коорд. химия. - 2014. - Т. 40, № 2. - С. 108-112. DOI: 10.7868/S0132344X14020108
- Синтез и строение диакрилата трифенилсурьмы / А.В. Гущин, Л.К. Прыткова, Д.В. Шашкин и др. // Вестник Нижегородского университета им. Н.И. Лобачевского. - 2010. -№ 1. - С. 95-99.
- Expperimental and Theoretical Distributijn of Electron Density and Thermopolimerization in Crystals of Ph3Sb(O2CCH=CH2)2 Complex / G.K. Fukin, M.A. Samsonov, A.V. Arapova et al. // J. Solid State Chem. - 2017. - V. 254. - P. 32-39. DOI: 10.1016/j.jssc.2017.06.030
- Шарутин, В.В. Дикарбоксилаты трис(4-фторфенил)сурьмы (4-FC6H4)3Sb[OC(O)R]2, R = Q0H15, Q^-цикло) / В.В. Шарутин, О.К. Шарутина, А.Н. Ефремов // Журн. неорган. химии. -2016. - Т. 61, № 1. - С. 46-50. DOI: 10.7868/S0044457X16010232
- Синтез и строение дикарбоксилатов трис(3-фторфенил)сурьмы: (3-FC6H4)3Sb[OC(O)R]2, R = C6H3(NO2)2-3,5, CH2Br, CH2Cl, CH=CHPh) / В.В. Шарутин, О.К. Шарутина, А Н. Ефремов и др. // Коорд. химия. - 2018. - Т. 44, № 5. С. 333-339. DOI: 10.1134/S0132344X18050109
- Синтез и строение дикарбоксилатов трис(3-фторфенил)сурьмы: (3-FC6H4)3Sb[OC(O)R]2 (R = Œ2Cl, Ph, CH2C6H4NO2-4, С10Н5) / В.В. Шарутин, О.К. Шарутина, Р.В. Решетникова и др. // Журн. неорган. химии. - 2017. - Т. 62, № 11. - С. 1457-1463. DOI: 10.7868/S0044457X17110058
- Calorimetric Study of Organic Compounds of Antimony and Bismuth Ph3Sb(O2CCH=CHCH3)2 and Ph3Bi(O2CCH=CHCH3)2 / I.A. Letyanina, A.V. Markin, N N. Smirnova et al. // J. Therm. Anal. Calorim. - 2016. - V. 125, no. 1. - P. 339-349.
- Особенности строения дикарбоксилатов триорганилсурьмы R3Sb[OC(O)R')]2 / В.В. Ша-рутин, О.К. Шарутина, А.П. Пакусина и др. // Координационная химия. - 2003. - Т. 29, № 11. -С. 843-851.
- Синтез и строение бис[(2Е)-3-(2-фурил)проп-2-еноата] трифенилсурьмы Ph3Sb[O2CCH=CH(C4H3O)]2 / О. С. Калистратова, П. В. Андреев, А. В. Гущин и др. // Кристаллография. - 2016. - Т. 61, № 3. - С. 396-399. DOI 10.7868/S0023476116030139
- Comparative Stability, Toxicity and Anti-Leishmanial Activity of Triphenyl Antimony(V) and Bismuth(V) a-Hydroxy Carboxylato Complexes / R.N. Duffin, V.L. Blai, L. Kedzierski et al. // Dalton Trans. - 2018. - V. 47, no. 3. - P. 971-980. DOI: 10.1039/C7DT04171C
- Синтез и молекулярные структуры бис(2-метилкарборанилкарбоксилатов) трифенилсурьмы и трифенилвисмута / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Бутлеровские сообщения. - 2012. - Т. 29, № 3. - С. 51-56.
- Синтез и строение бис(фенилкарборанилкарбоксилата) три(и-толил)сурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Бутлеровские сообщения. - 2011. - Т. 28, № 19. - С. 54-58.
- Synthesis, Characterization and Crustal Structures of Tri- and Tetraphenylantimony(V) Compounds Containing Arylcarbonyloxy Moiety / Li Quan, H. Yin, J. Cui, M. Hong, D. Wang // J. Organo-met. Chem. - 2009. - V. 694. - P. 3708-3717.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341. DOI: 10.1107/S0021889808042726
- https://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi
- Тарасевич, Б.Н. ИК-спектры основных классов органических соединений / Б.Н. Тарасевич. - М.: МГУ, 2012. - 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е В. Гриненко, А О. Щукин и др. - СПб.: СПбГЛТА, 2007. - 54 с.
- Бацанов, С.С. Атомные радиусы элементов / С.С. Бацанов // Журн. неорган. химии. -1991. - Т. 36, № 12. - С. 3015-3037.

![Исследование строения дикарбоксилатов трис(4-фторфенил) (4-FC6H4)3Sb[OC(O)R]2(R=C6H3F2-2,3, C6H3(NO2)2-3,5, C6H4OMe-2,CF2Br, CH=CHPh,CH3, C?CH) Исследование строения дикарбоксилатов трис(4-фторфенил) (4-FC6H4)3Sb[OC(O)R]2(R=C6H3F2-2,3, C6H3(NO2)2-3,5, C6H4OMe-2,CF2Br, CH=CHPh,CH3, C?CH)](/file/cover/147236609/issledovanie-stroenija-dikarboksilatov-tris-4-ftorfenil-4-fc6h4-3sb-oc-o-r-2.png)
