Исследование строения производных трифенилсурьмы(V) и трифенилвисмута(V) с некоторыми непредельными карбоновыми кислотами методом ИК-спектроскопии
Автор: Гущин Алексей Владимирович, Малеева Алевтина Игоревна, Калистратова Ольга Сергеевна, Хамалетдинова Надия Мустафовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 1 т.13, 2021 года.
Бесплатный доступ
Взаимодействием трифенилсурьмы (трифенилвисмута) с карбоновыми кислотами в присутствии пероксидов в эфире или ТГФ синтезированы 14 дикарбоксилатов трифенилсурьмы и трифенилвисмута типа Ph3M(O2CR)2 c кротоновой, коричной, мета-нитрокоричной, пара-метоксикоричной, фурилакриловой, винилуксусной и сорбиновой кислотами. В качестве исходных пероксидов использовались водный раствор пероксида водорода (пергидроль с концентрацией пероксида до 45 %) или эфирный 0,8 М раствор, а также трет -бутилгидропероксид (98 %). Жидкую винилуксусную кислоту брали в трехкратном количестве в расчете на пероксид вместо необходимого двухкратного. Твердые карбоновые кислоты, имели схожую с продуктами реакции растворимость, их отделение являлось более трудной задачей, поэтому их брали стехиометрическом количестве. Выходы продуктов составили 40-90 %. Состав продуктов подтвержден данными элементного анализа, 1Н и 13С ЯМР-спектроскопии. Проанализировано положение характеристических сигналов симметричных и асимметричных валентных колебаний основных функциональных групп в ИК-спектрах и по разности их значений сделаны выводы о монодентатном и бидентатном связывании металлов с карбоксилатными лигандами. Монодентатное связывание зафиксировано у большинства комплексов сурьмы (кротонат, мета -нитроциннамат, пара -метоксициннамат, фурлакрилат, сорбат, винилацетат), а также у ряда комплексов трифенилвисмута ( мета -нитроциннамат, пара -метоксициннамат, фурлакрилат, винилацетат). Бидентатное или пограничное с монодентатным связывание зафиксировано в случае сурьмы только у циннамата, а в случае висмута - для кротоната, циннамата, фурилакрилата, сорбата. Сопоставлено положение пиков валентных колебаний связей С-Н, Sb-C, Bi-C в изученных карбоксилатных производных, а также в молекулах трифенилсурьмы и трифенилвисмута.
Икарбоксилаты трифенилсурьмы, трифенилвисмута, кротоновая, фурилакриловая, коричная, мета-нитрокоричная, пара-метоксикоричная, винилуксусная, сорбиновая кислоты
Короткий адрес: https://sciup.org/147234247
IDR: 147234247 | УДК: 546.864+547.53.024 | DOI: 10.14529/chem210101
Текст научной статьи Исследование строения производных трифенилсурьмы(V) и трифенилвисмута(V) с некоторыми непредельными карбоновыми кислотами методом ИК-спектроскопии
В настоящее время получен и исследован достаточно широкий ряд производных трифенил-сурьмы с непредельными карбоновыми кислотами типа Ph3Sb[OC(O)R]2 и аналогичных производных висмута Ph3Bi[OC(O)R]2 [1, 2]. Интерес к такому типу соединений связан с потенциальными возможностями их применения. Некоторые карбоксилатные комплексы указанных типов проявляют противоопухолевую активность [3–5], используются для лечения лейшманиоза [6–8] или в качестве компонентов высокочувствительных молекулярных органометаллических УФ резистов [9]. Активно развивается химия полимеров, содержащих сурьму. В литературе имеются данные о введении в полиметилметакрилат, в полиакриловую кислоту, в поливинилацетат металлических сурьмы и висмута в коллоидном состоянии [10, 11]. Сурьмаорганические производные могут встраиваться как в основную цепь макромолекул [12, 13], так и в качестве заместителей в боковой цепи. Акрилаты, метакрилаты, винилбензоаты и другие производные сурьмы, способные к полимеризации, уже использованы для синтеза металлосодержащих полимеров на основе метилметакрилата, стирола, винилацетата, акриловой кислоты, проявляющих фунгицидную и биоцидную активность [14, 15]. Добавки таких соединений в полимерные материалы улучшают их термическую [16], радиационную стойкость, а также поглощение рентгеновского излучения [17].
Экспериментальная часть
Дикротонат трифенилсурьмы Ph 3 Sb(O 2 CCH=CHCH 3 ) 2 . К раствору 3,53 г (10 ммоль) Ph 3 Sb в 10 мл диэтилового эфира добавили 2,15 г (25 ммоль) кротоновой кислоты и раствор 1,09 г пергидроля, содержащий 31,2 % Н 2 О 2 (10 ммоль), в 40 мл изопропилового спирта. Смесь выдерживали при комнатной температуре 24 ч, затем выпавшие кристаллы отделяли фильтрованием, сушили. Перекристаллизовывали из системы гексан-хлороформ (4:1). Выход полученных бесцветных кристаллов 69 %, т. пл. 153 °С.
Найдено, %: C 59,71, H 4,79, Sb 21,10. Для C 26 H 25 O 4 Sb вычислено, %: С 59,68, H 4,82, Sb 23,27.
1 Н-ЯМР (CDCl a ): 8,01 (dd, J = 6,5; 3,1 Hz, 6H), 7,56-7,38 (m, 9H), 6,47 (dq, 2H), 5,70 (d, 2H), 1,75 (dd, 6H).
13С-ЯМР (CDCl 3 ): 17,69 (2C, CH 3 ), 125,29 (2C, -CH=CH-), 129,31 (3C, Ph), 130,98 (6C, Ph), 133,98 (6C, Ph), 139,10 (3C, Sb-C), 143,03 (2C, -CH=CH-), 170,71 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3054 (Ph-H), 2971 (CH 3 ), 1664 (C=C), 1590 (СOO); 1481, 1436, 1350 (COO), 1187, 963, 740, 690, 454 (Sb-O), 561 (Sb-C).
Дициннамат трифенилсурьмы Ph3Sb(O2CCH=CHPh]2 синтезировали аналогично дикро-тонату. Получены белые кристаллы, выход 86 %, т. пл. 197 °С.
1 Н-ЯМР (CDCI 3 ) 5 8,10 (dd, J = 6,4; 2,8 Hz, 6H), 7,50 (dd, J = 6,6; 4,6 Hz, 10H), 7,43 (dd, J = 6,6; 2,9 Hz, 5H), 7,35-7,29 (m, 6H), 6,34 (d, J = 15,9 Hz, 2H).
13С-ЯМР (CDCl 3 ): 120,90 (2C, -CH=CH-), 127,85 (4C, Ph-C), 128,69 (4C, Ph-C), 129,66 (8C, Ph-C), 131,02 (3C, Ph-C), 233,87 (6C, Ph-Sb), 134,89 (2C, Ph-C), 138,62 (3C, Sb-C), 143,34 (2C,
-
-CH=CH-), 170,79 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3053 (Ph-Н), 1642 (С=С), 1580 (СOO), 1481, 1435, 1357 (СOO), 970, 747, 691, 459 (Sb-O), 540 (Sb-C).
Ди- мета -нитроциннамат трифенилсурьмы Ph 3 Sb(O 2 CCH=CHC 6 H 4 NO 2 - m ) 2 . К раствору 3,53 г (0,01 моль) Ph 3 Sb в 10 мл ТГФ добавляют 3,58 г (0,02 моль) м -нитрокоричной кислоты. Для полного растворения кислоты добавили еще 25 мл ТГФ. Готовят раствор 1 мл (0,01 моль) Н 2 О 2 в изопропиловом спирте. После выдерживания в холодильнике в течение 2 суток выпадение кристаллов не наблюдается. Отгоняют растворитель при пониженном давлении до объема около 10 мл. Выдерживали в холодильнике в течение 10 ч, полученные кристаллы отделяли на фильтре Шотта, дважды перекристаллизовывали из системы гексан : хлороформ 4:1. Выход 59 %, т. пл. 193 °С.
' H-ЯМР (CDCl a ): 8,28 (s, 2H), 8,17-8,08 (m, 8H), 7,71 (d, J = 7,7 Hz, 2H), 7,55-7,48 (m, 12H), 7,44 (s, 1H), 6,45 (d, J = 15,9 Hz, 2H).
-
13С-ЯМР (CDCl 3 ): 122,26 (2C, -CH=CH-), 123,96 (2C, Ph), 124,18 (2C, Ph), 129,49 (2C, Ph), 129,72 (3C, Ph), 131,32 (6 C, Ph), 133,37 (2C, Ph), 133,83 (6C, Ph), 136,12 (2C, Ph), 137,83 (3C, Ph), 140,43 (2C, -CH=CH-), 148,56 (2C, C-NO 2 ), 169,71 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3069 (Ph-H); 1651 (C=C), 1611 (COO); 1479, 1436, 1355 (COO); 1217, 1162, 984, 735, 686, 459 (Sb-O), 596 (Sb-C).
Ди- пара -метоксициннамат трифенилсурьмы Ph 3 Sb(O 2 CCH=CHC 6 H 4 OMe- п ) 2 синтезировали и перекристаллизовывали аналогично ди- мета- нитроциннамату. Выход продукта 75 %, т. пл. 169 °С.
' H-ЯМР (CDCI 3 ): 8,26 (d, J = 7,9 Hz, 6H), 7,62-7,56 (m, 13H), 7,46 (d, J = 7,3 Hz, 2H), 6,84 (d, J = 7,9 Hz, 4H), 6,27 (d, J = 15,8 Hz, 2H), 3,80 (s, 6H).
ИК-спектр (ν, см–1, таблетка KBr): 3049 (Ph-H); 2937 (CH3), 1687 (C=C); 1643 (COO); 1482, 1436, 1325 (COO); 1257, 1171, 976, 688, 460 (Sb-O); 565 (Sb-C).
Бис -2-фурилакрилат трифенилсурьмы Ph 3 Sb(O 2 CCH=CHC 4 H 3 O) 2 . Получали и очищали аналогично ди- мета -нитроциннамату трифенилсурьмы. Выход желто-оранжевых кристаллов 71 %, т. пл. 197 °С.
-
1H-ЯМР (CDCl 3 ): δ 8,06 (dd, J = 6,3; 2,8 Hz, 6H), 7,54–7,44 (m, 9H), 7,22 (d, J = 15,7 Hz, 2H), 6,48 (d, J = 3,1 Hz, 2H), 6,40 (s, 2H), 6,22 (d, J = 15,7 Hz, 2H).
-
13C-ЯМР (CDCl 3 ): 111,99 (2C, фурил-С), 113,43 (2С, фурил-С), 118,79 (2С, -CH=CH-), 129,28 (6C, Ph), 130,56 (3C, Ph), 130,97 (3C, Sb-C), 133,85 (6C, Ph), 138,62 (2C, -CH=CH-), 144,15 (2C, фурил-С), 151,31 (2C, фурил-С), 170,72 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3063 (Ph-Н), 1648 (С=С), 1604 (СOO), 1481, 1438, 1321 (СOO), 1280, 1226, 1188, 1073, 1014, 883, 734, 690, 461 (Sb-O), 591 (Sb-C).
Дисорбат трифенилсурьмы Ph 3 Sb(O 2 CCH=CHCH=CHCH 3 ) 2 . Получали и очищали аналогично ди- мета -нитроциннамату трифенилсурьмы. Выход продукта 86 %, т. пл. 121 °С.
-
1H-ЯМР (CDCl 3 ): 8,02 (s, 6H), 7,47 (s, 9H), 7,04 (dd, J = 14,8; 10,7 Hz, 2H), 6,20–5,85 (m, 4H), 5,69 (t, J = 26,3 Hz, 2H), 1,79 (d, J = 5,5 Hz, 6H).
-
13C-ЯМР (CDCl 3 ): 18,53 (2C, CH 3 ), 121,76 (2C, -CH=CH-), 129,26 (2C, -CH=CH-), 129,79 (3C, Ph), 130,81 (6C, Ph), 137,64 (6C, Ph), 138,88 (3C, Sb-C),139,03 (2C, -CH=CH-), 143,75 (2C, -CH=CH-), 171,23 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3058 (Ph-Н), 2942, 1650 (С=С), 1632 (СOO), 1481, 1436, 1334 (СOO), 1263, 1150, 993, 736, 694, 461 (Sb-O), 606 (Sb-C).
Дивинилацетат трифенилсурьмы Ph3Bi(O2CCH2CH=CH2)2. Получали и очищали подобно ди- мета -нитроциннамату трифенилсурьмы. Выход продукта 60 %, т. пл. 131 °С.
-
1Н-ЯМР (CDCl 3 ): 7,99 (dd, J = 6,4; 3,1 Hz, 6H), 7,53 – 7,44 (m, 9H), 5,75 (ddt, J = 17,1; 10,2; 6,9 Hz, 2H), 4,95 (t, J = 13,9 Hz, 4H), 2,87 (d, J = 7,0 Hz, 4H).
ИК-спектр (ν, см–1, таблетка KBr): 3054 (Ph-H), 2978 (CH 2 ), 1648 (C=C), 1641 (СOO); 1470, 1439, 1320 (COO), 919, 734, 680, 454 (Sb-O), 573 (Sb-C).
Дикротонат трифенилвисмута Ph 3 Bi(O 2 CCH=CHCH 3 ) 2 . К раствору 2,2 г Ph 3 Bi (5 ммоль) в 20 мл диэтилового эфира добавляли 0,86 г (10 ммоль) кротоновой кислоты и 0,56 мл (5 ммоль) 92,6 % раствора t -BuOOH. Смесь выдерживали при комнатной температуре 24 ч, затем выпавшие кристаллы отделяли фильтрованием, сушили. Получали 1,91 г желтоватых кристаллов. Полученный продукт дважды перекристаллизовывали из системы гексан-хлороформ 4:1. Выход очищенного продукта 73 %, т. пл. полученных кристаллов 153 °С.
-
1H-ЯМР (400 МГц, CDCl 3 ): δ 8,19 (d, J = 7,3 Hz, 6H), 7,57 (t, J = 7,6 Hz, 6H), 7,45 (t, J = 7,3 Hz, 3H), 6,73 (dq, J = 13,7; 6,8 Hz, 2H), 5,72 (d, J = 15,4 Hz, 2H), 1,73 (d, J = 8,4 Hz, 6H).
-
13C-ЯМР (400 МГц, CDCl 3 ): 17,83 (2C, CH 3 ), 125,50 (2C, -CH=CH-), 130,68 (3C, Ar-C), 131,23 (6C, Ph), 142,33 (6C, Ph), 143,07 (2C, -CH=CH-), 161,25 (3C, Bi-C), 173,04 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3057 (Ph-Н), 2988 (СН 3 ), 1662 (С=С), 1558 (СOO-), 1471, 1440, 1355 (СOO-), 740, 694, 449 (Bi-O), 593 (Bi-C).
Дициннамат трифенилвисмута Ph 3 Bi(O 2 CCH=CHPh) 2 . Синтезировали аналогично дикро-тонату трифенилвисмута. Получали белые кристаллы с выходом 90 %, т. пл. 176 °С.
-
1H-ЯМР (400 МГц, CDCl 3 ) 8,23 (d, J = 7,8 Hz, 6H), 7,60 (t, J = 7,6 Hz, 6H), 7,47 (d, J = 7,3 Hz, 3H), 7,39 (s, 2H), 7,36 (s, 2H), 6,47 (s, 2H), 6,39 (s, 2H), 6,24 (d, J = 15,6 Hz, 2H).
-
13С-ЯМР (CDCl 3 ): 121,21 (2C, -CH=CH-), 127,77 (2C, Ph), 128,65 (4C, Ph), 129,45 (4C, Ph), 130,70 (3C, Ph), 231,23 (6C, Ph), 133,96 (6C, Ph), 135,12 (3C, Bi-C), 142,84 (2C, Ph), 160,93 (2C, -CH=CH-), 170,79 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3056 (Ph-H); 2954, 1643 (C=C), 1557 (COO-); 1470, 1437, 1359 (COO-); 1188, 985, 732, 692, 445 (Bi-O); 587 (Bi-C).
Ди- мета -нитроциннамат трифенилвисмута Ph 3 Bi(O 2 CCH=CHC 6 H 4 NO 2 - m ) 2 . К раствору 1,1 г Ph3Bi (2,5 ммоль) в 6 мл ТГФ добавляли 1,24 г (6,25 ммоль) м ета-нитрокоричной кислоты и 0,21 мл (2,5 ммоль) 94,7 % раствора t -BuOOH. Смесь выдерживали при комнатной температуре 24 ч, затем откачивали часть растворителя при пониженном давлении. В результате образовались монокристаллы хорошего качества. Полученный продукт перекристаллизовывали из системы ТГФ-гексан (1:4). Выход продукта 57 %, т. пл. 167 ºС.
-
1H-ЯМР (400 МГц, CDCl 3 ): 8,49–8,07 (m, 10H), 7,91–7,39 (m, 15H), 6,53 (ddd, J = 8,9; 7,2; 2,9 Hz, 2H).
ИК-спектр (ν, см–1, таблетка KBr): 3080 (Ph-Н); 1645 (С=С); 1613 (СOO-); 1530, 1418, 1360 (СOO-), 1329, 985, 716, 664, 486 (Bi-O), 596 (Bi-C).
Ди- пара -метоксициннамат трифенилвисмута Ph 3 Bi(O 2 CCH=CHC 6 H 4 OMe- p ) 2 . Синтезирован аналогично ди- мета- нитроциннамату. Выход продукта 68 %, т. пл. 161 °С.
-
1H-ЯМР (CDCl 3 ): 55,28 (2C, CH 3 ), 114,10 (4C, Ph), 118,76 (2C, -CH=CH-), 129,29 (2C, Ph), 130,59 (7C, Ph), 131,17 (6C, Ph), 133,93 (6C, Ph), 142,51 (2C, -CH=CH-), 160,54 (3C, Bi-C, 2C, Ph), 161,24 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3048 (Ph-H), 1635 (C=C), 1512, 1433, 1351 (COO), 986, 731, 681, 448 (Bi-O), 565, 514 (Bi-C).
Бис -2-фурилакрилат трифенилвисмута Ph 3 Bi(O 2 CCH=CHC 4 H 3 O) 2 . Синтезирован аналогично ди- мета нитроциннамату трифенилвисмута. При этом выпадали красно-коричневые кристаллы, которые перекристаллизовывали из системы ТГФ-гексан (1:4). Выход продукта 68 %, т. пл. 161 °С (с разложением).
1 H ЯМР (400 МГц, CDCI 3 ): 8.23 (d, J = 7,8 Hz, 6H), 7,60 (t, J = 7,6 Hz, 6H), 7,47 (d, J = 7,3 Hz, 3H), 7,39 (s, 2H), 7,36 (s, 2H), 6,47 (s, 2H), 6,39 (s, 2H), 6,24 (d, J = 15,6 Hz, 2H).
-
13С-ЯМР (CDCl 3 ): 111,85 (2C, фурил-С), 112,88 (2С, фурил-С), 119,11 (2C, -CH=CH-), 128,25 (6C, Ph), 130,64 (3C, Ph), 131,17 (3C, Bi-C), 133,68 (6C, Ph), 134,67 (2C, -CH=CH-), 143,85 (2C, фу-рил-С), 151,33 (2C, фурил-С), 172,96 (2C, C=O).
ИК-спектр (ν см–1, таблетка KBr): 3056 (Ph-H); 2954, 1643 (C=C), 1557 (COO-); 1470, 1437, 1359 (COO-); 1188, 985, 732, 692, 448 (Bi-O); 591 (Bi-C).
Дисорбат трифенилвисмута Ph 3 Bi(O 2 CCH=CH-CH=CH-CH 3 ) 2 . Синтезирован подобно ди- пара -метоксициннамату. Выход продукта 43 %, t. пл. 127 °С (с разложением).
-
1Н-ЯМР (400 МГц, CDCI 3 ): 8,19 (d, J = 7,7 Hz, 6H), 7,57 (t, J = 7,5 Hz, 6H), 7,44 (t, J = 7,2 Hz, 3H), 7,11–6,99 (m, 2H), 6,02 (ddd, J = 22,6; 20,7; 11,3 Hz, 4H), 5,67 (d, J = 15,3 Hz, 2H), 1,77 (d, J = 6,2 Hz, 6H).
-
13C-ЯМР (CDCl 3 ): 18,54 (2C, CH 3 ), 122,04 (2C, -CH=CH-), 128,31 (2C, -CH=CH-), 130,10 (3C, Ph), 131,10 (6C, Ph), 133,79 (6C, Ph), 133,91 (3C, Sb-C),137,07 (2C, -CH=CH-), 143,26 (2C, -CH=CH-), 173,37 (2C, C=O).
ИК-спектр (ν см–1, таблетка KBr): 3054 (Ph-H); 2967 (CH3), 1648 (C=C), 1558 (COO-); 1471, 1438,1350 (COO-); 1151, 985, 731, 680, 446 (Bi-O), 581 (Bi-C).
Дивинилацетат трифенилвисмута Ph 3 Bi(O 2 CCH 2 СН=CH 2 ) 2 . Синтезировали аналогично дикротонату трифенилвисмута. Белые кристаллы, выход 60 %, т. пл. 131 °С.
-
1Н-ЯМР (400 МГц, CDCl a ): 8,15 (dd, J = 8,3; 1,0 Hz, 6H), 7,59 (t, J = 7,6 Hz, 6H), 7,46 (dd, J = 11,0; 3,7 Hz, 3H), 5,76 (td, J = 17,1; 6,9 Hz, 2H), 4,96 - 4,86 (m, 4H), 2,86 (dt, J = 6,9; 1,3 Hz, 4H).
-
13C-ЯМР (400 МГц, CDCl 3 ): 40,44 (2C, -CH 2 -), 116,70 (2C, CH 2 =), 130,71 (3C, Ph), 131,13 (6C, Ph), 132,34 (6C, Ph), 133,90 (2C, -CH=CH-), 160,38 (3C, Bi-O), 177,43 (2C, C=O).
ИК-спектр (ν, см–1, таблетка KBr): 3054 (Ph-H), 2978 (CH 2 ), 1600 (C=C), 1599 (СOO); 1471, 1439, 1362 (COO), 919, 734, 680, 454 (Sb-O), 573 (Sb-C).
Физико-химические методы анализа
ИК-спектры записывались на приборе IR Prestige-21, Shimadzu, Япония в диапазоне 4000– 400 см–1 с использованием программы IRsolution V 1.30.
-
1Н-ЯМР снимали в дейтерохлороформе на ЯМР-спектрометре Agilent DD2 400. Для расшифровки и моделирования спектров использовали программу MestReNowa 9.0.2 (демонстрационная версия).
Результаты и обсуждениеСинтез соединений сурьмы и висмута типа Ph3Sb(O2CR)2
Реакция окислительного присоединения – один из самых удобных методов синтеза соединений Sb(V) и Bi(V) типа Ph 3 MX 2 , где M = Sb, Bi; X = карбоксилатный лиганд. В основе метода лежит реакция окисления триарилсурьмы или триарилвисмута различными пероксидами с участием избытка карбоновой кислоты [18, 19]. Реакция протекает по уравнению
Ph3M + ROOH + 2HX → Ph3MX2+ ROH + H2O при комнатной температуре в течение нескольких часов с высокими выходами. В качестве растворителя чаще всего используется диэтиловый эфир и тетрагидрофуран.
Таким методом были синтезированы дикарбоксилатные производные с минеральными и простыми одноосновными карбоновыми кислотами. Реакции с непредельными одноосновными и двухосновными кислотами исследовались мало. Поскольку одной из целей работы было получение металлосодержащих мономеров, наличие кратной связи в карбоксилатном лиганде было важным аспектом работы. Поэтому был выбран ряд непредельных одноосновных карбоновых кислот по следующим критериям: а) наличие кратной C=C связи в α,β-положении у карбоксильной группы может в ходе полимеризации приводить к образованию стабилизированного π-р-сопряжением макрорадикала, что должно облегчать полимеризацию соответствующих карбоксилатов сурьмы и висмута; б) исследование ряда кислот похожего строения с различными заместителями у двойной связи для выявления закономерностей в строении и свойствах исследуемых соединений; в) относительная коммерческая доступность этих кислот, поскольку одна из целей – использование дикарбоксилатных производных в качестве металлосодержащих мономеров.
Карбоновые кислоты, выбранные для синтезов, представлены в табл. 1. Для некоторых из них также известна способность к гомополимеризации и сополимеризации с другими мономерами (кротоновая, коричная, винилуксусная). Все кислоты коммерчески доступны, некоторые из них получали синтетически: м -нитрокоричную кислоту получали синтезом Перкина из м -нитробензальдегида [20], сорбиновую кислоту получали из коммерческого сорбата калия.
Таблица 1
Карбоновые кислоты, используемы в синтезах
|
№ |
Название кислоты |
Структурная формула |
Т. кип./Т. пл., ºС |
|
1 |
Кротоновая |
CH 3 CH=CHCOOH |
72 |
|
2 |
Коричная |
C 6 H 5 CH=CHCOOH |
133–135 |
|
3 |
м -Нитрокоричная |
m -NO 2 -C 6 H 4 CH=CHCOOH |
201–202 |
|
4 |
п -Метоксикоричная |
p -CH 3 O-C 6 H 4 CH=CHCOOH |
170–171 |
|
5 |
3-Фурилакриловая |
С 4 H 3 OCH=CHCOOH |
143 |
|
6 |
Сорбиновая |
CH 3 CH=CHCH=CHCOOH |
134 |
|
7 |
Винилуксусная |
CH 2 =CH-CH 2 COOH |
163 |
Для реакций использовались раствор пероксида водорода (пергидроль с концентрацией пероксида до 45 % или эфирный 0,8 М раствор) и трет -бутилгидропероксид (до 98 % масс.).
Среди выбранных кислот наибольший интерес представляют 1 , 6 , 7 своей доступностью. Кислоты 2–5 были использованы только для получения ранее не изученных соединений типа Ph3MX2, без цели их дальнейшего использования в полимеризации.
В табл. 2 представлены все полученные соединения с условиями их синтезов, выходами и т. пл. Соединения трифенилсурьмы и трифенилвисмута с коричной кислотой были получены ранее [21], однако производное висмута подробно не исследовалось. Остальные исследуемые вещества были получены и описаны впервые.
При синтезе дикарбоксилатов трифенилсурьмы и трифенилвисмута с карбоновыми кислотами, находящимися в жидком агрегатном состоянии (винилуксусная), брали 3-кратное количество кислоты вместо необходимого 2-кратного. Это позволяет получить больший выход основного твердого продукта реакции, и при этом его очистка не осложняется отделением от примесей кислоты, так как жидкие кислоты легко уходят вместе с растворителем при фильтровании после перекристаллизации. Твердые карбоновые кислоты имеют схожую с продуктом реакции растворимость, и их отделение является более трудной задачей, поэтому брали необходимое количество кислоты.
Инфракрасная спектроскопия
Исследование металлорганических соединений методом инфракрасной спектроскопии достаточно трудная задача вследствие наличия большого числа колебаний атомов и групп в молекуле. Поэтому судить о строении таких сложных веществ только по ИК-спектрам нельзя.
Таблица 2
Данные по синтезу дикарбоксилатов трифенилсурьмы и трифенилвисмута Ph 3 M(O 2 CR) 2
|
Название и шифр |
Исходные реагенты |
Выход, % |
Т. пл.,ºС |
|
I Дикротонат трифенилсурьмы |
Ph 3 Sb,CH 3 CH=CHCOOH, H 2 O 2 |
69 |
153 |
|
II Дициннамат трифенилсурьмы |
Ph 3 Sb,C 6 H 5 CH=CHCOOH, H 2 O 2 |
86 |
197 |
|
III Ди- м -нитроциннамат трифе-нилсурьмы |
Ph 3 Sb, m- NO 2 C 6 H 4 CH=CHCOOH, t- BuOOH |
59 |
193 |
|
IV Ди- п -метоксициннамат три-фенилсурьмы |
Ph 3 Sb, p- CH 3 O - C 6 H 4 CH=CHCOOH, t- BuOOH |
75 |
169 |
|
V Бис(3-(2-фурилакрилат)) три-фенилсурьмы |
Ph 3 Sb,C 4 H 3 O-CH=CHCOOH, H 2 O 2 |
71 |
197 |
|
VI Дисорбат трифенилсурьмы |
Ph 3 Sb, CH 3 CH=CHCH=CHCOOH, t- BuOOH |
86 |
121 |
|
VII Дивинилацетат трифенил-сурьмы |
Ph 3 Sb, CH 2 =CHCH 2 COOH, H 2 O 2 |
73 |
99 |
|
VIII Дикротонат трифенилвисмута |
Ph 3 Bi,CH 3 CH=CHCOOH, t- BuOOH |
73 |
153 |
|
IX Дициннамат трифенилвисмута |
Ph 3 Bi,C 6 H 5 CH=CHCOOH, t- BuOOH |
90 |
176 |
|
X Ди- м -нитроциннамат трифенилвисмута |
Ph 3 Bi, m- NO 2 C 6 H 4 CH=CHCOOH, t- BuOOH |
58 |
167 |
|
XI Ди- п -метоксициннамат трифенилвисмута |
Ph 3 Bi,C 4 H 3 O-CH=CHCOOH, t- BuOOH |
80 |
165 (разл) |
|
XII Бис(3-(2-фурилакрилат)) трифенилвисмута |
Ph 3 Bi,C 4 H 3 O-CH=CHCOOH, t- BuOOH |
68 |
161 (разл) |
|
XIII Дисорбат трифенилвисмута |
Ph 3 Bi,CH 3 CH=CHCH=CHCOOH, t- BuOOH |
40 |
127 (разл.) |
|
XIV Дивинилацетат трифенилвисмута |
Ph 3 Bi, CH 2 =CHCH 2 COOH, t- BuOOH |
60 |
131 |
Однако данные ИК-спектроскопии оказываются весьма полезными для подтверждения чистоты получаемых соединений, поскольку частоты колебаний карбоксильных групп в карбоновой кислоте и ее соли значительно отличаются. Помимо этого, данные о полосах поглощения симметричных и асимметричных валентных колебаний однозначно свидетельствуют о характере связывания атома металла с карбоксилатными лигандами (монодентатный или биден-татный) [22].
Симметричные и асимметричные валентные колебания связей – одни из самых важных полос поглощения для данного типа соединений. В чистых карбоновых кислотах есть ковалентные связи С–OH и С=O , и полосы их поглощения обычно находятся в области 1280–1315 и 1700– 1720 см–1 соответственно и могут меняться до 1075–1190 и 1740–1800 см–1 соответственно, если кислота находится в мономерной форме. Однако в мономерной форме карбоновые кислоты находятся очень редко, только в случае очень разбавленных растворов или при повышенной температуре. С другой стороны, соли карбоновых кислот имеют ионное строение и характеризуются, по разным данным, наличием двух полос поглощения высокой интенсивности при 1300–1400 см–1
и 1610–1680 см–1 [23], или 1360–1450 и 1540–1650 см–1 [24], отвечающих симметричному и асимметричному колебаниям двух равноценных связей C=O (рис. 1).
R
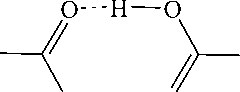
R
O ^^^^^^^HO карбоновая кислота (димерная форма)
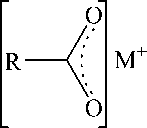
соль карбоновой кислоты
Рис. 1. Различное состояние группы СОО в молекулах кислот и солей
Сопряжение карбонильной группы с кратными связями (как в кислотах, так и в их солях) снижает частоту валентных колебаний на 20–30 см–1; тип заместителя у двойной связи же практически не влияет на сдвиги полос поглощения, только если они не находятся в α-положении к карбонильной группе [23]. При этом происходит также влияние и на положение полос поглощения кратных связей, что будет рассмотрено ниже.
Рассмотрим более подробно смещение полос поглощения для исследуемых карбоновых кислот.
Поскольку все использованые карбоновые кислоты (кроме винилуксусной) имеют сходное строение типа RCH=CHCOOH с сопряжением карбонильной группы с двойной связью С=С, валентные колебания связей С–OH и С=O должны находиться в области 1300–1400 и 1610–1680 см–1 соответственно. Данные ИК-спектров исследуемых кислот хорошо согласуются с нижеприведенными литературными данными [25, табл. 10].
Таблица 3
Валентные колебания связей С–OH и С=O в карбоновых кислотах типа RCH=CНCOOH, см–1
|
Колебание |
R |
|||||
|
CH 3 - |
Ph- |
m- NO2Ph- |
п- MeOPh- |
-C 4 H 3 O* |
MeCH=CH- |
|
|
С–OH |
1318 |
1312 |
1307 |
1317 |
1314 |
1330 |
|
С=O |
1706 |
1686 |
1691 |
1689 |
1701 |
1694 |
*
Фурилакриловая кислота.
Если проводить сравнение ИК-спектров этих кислот и соответствующих им предельных кислот, то можем наблюдать смещение полос поглощения непредельных кислот, что согласуется с литературой (табл. 4).
Таблица 4
Валентные колебания связей С–OH и С=O в карбоновых кислотах типа RCH 2 CН 2 COOH, см–1
|
Колебание |
R |
||||
|
Me- |
Ph- |
п- MeOPh- |
-C 4 H 3 O* |
Pr- |
|
|
С–OH |
1285 |
1304 |
1247 |
1221 |
1292 |
|
С=O |
1712 |
1699 |
1710 |
1700 |
1711 |
По остальным предельным кислотам похожего строения найти данные ИК-спектроскопии не удалось.
В исследуемых соединениях сурьмы и висмута типа Ph3M(O2CR)2 присутствуют две карбоксилатные группы и полосы поглощения симметричных и асимметричных валентных колебаний имеют высокую интенсивность.
Все спектры снимались в таблетках KBr. Как можно наблюдать из табл. 5, асимметричные валентные колебания в соединениях висмута заметно отличаются от аналогичных колебаний у соединений сурьмы, что можно объяснить влиянием атома металла. Как правило, данное колебание у дикарбоксилатов трифенивисмута несколько ниже, что вполне логично, так как атом висмута более тяжелый и колеблется медленнее. У симметричных колебаний такого сдвига практически не наблюдается.
Таблица 5
Симметричные и асимметричные валентные колебания группы СОО в диацилатных производных трифенилсурьмы и трифенилвисмута типа Ph3M(O2CR)2, см–1
|
R |
Sb |
Bi |
||||
|
νs СОО |
νa СОO |
Δν СOO |
νs СOO |
νa СOO |
Δν СOO |
|
|
-CH=CHMe |
1334 |
1632 |
298 |
1355 |
1558 |
203 |
|
-CH=CHPh |
1367 |
1580 |
213 |
1369 |
1546 |
177 |
|
-CH=CHC 6 H 4 NO 2 - m |
1355 |
1611 |
256 |
1360 |
1614 |
256 |
|
-CH=CHC 6 H 4 MeO- p |
1325 |
1601 |
276 |
1341 |
1603 |
262 |
|
-CH=CHC 4 H 3 O* |
1321 |
1603 |
282 |
1340 |
1559 |
219 |
|
-CH=CHCH=CHMe |
1334 |
1632 |
298 |
1354 |
1559 |
205 |
|
-CH 2 -CH=CH 2 |
1320 |
1641 |
321 |
1362 |
1600 |
238 |
*
Фурилакриловая кислота.
Симметричные и асимметричные валентные колебания также могут служить хорошим показателем для определения характера связывания атома металла с карбоксилатными лигандами. Если разница в значениях частот поглощения этих колебаний Δν = νa–νs больше 200 см–1, то характер связывания монодентатный, а если меньше – то бидентатный, что подтверждается данными рентгеноструктурного анализа. Однако не для всех исследуемых соединений получается вырастить монокристалл хорошего качества и провести структурные исследования, поэтому в этих случаях данные ИК-спектроскопии оказываются весьма полезными. Данные по значениям Δν представлены в табл. 5. Следует отметить, что для карбоксилатов, имеющих значения Δν, очень близкие к 200 см–1, однозначно судить о характере связывания сложно, и может наблюдаться как монодентаное, так и бидентатное связывание лигандов с атомом металла или же, что бывает чаще всего, дополнительная координация атома кислорода карбонильной группы на атом сурьмы или висмута.
Основные типы координации лигандов на атом металла, которые могут наблюдаться в диа-цилатных комплексах Ph 3 M(O 2 CR) 2 , показаны на рис. 2. Тип координации 1 – монодентатный, однако во многих исследуемых соединениях соблюдается тип координации 2 , так как расстояние между атомом металла и атомом кислорода карбонильной группы мало (что подтверждается РСА), и он координируется на металл. В этой работе под монодентаным связыванием подразумевается тип 2 . Тип координации 3 – бидентатный, он наблюдается в нескольких исследуемых комплексах.
R
OO
R
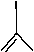
OO
R
OO
Ph M
V Ph
OO
Ph M
Ph M
OO
R
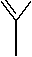
R
R
Рис. 2. Основные типы координации лигандов на атом металла в дикарбоксилатных комплексах Ph 3 M(O 2 CR) 2
Следующий тип валентных колебаний, наблюдаемых в исследуемых соединениях – это колебания кратной связи C=C в карбоксилатном лиганде. Как уже отмечалось выше, сопряжение двойной связи с карбонильной группой влияет на положение полосы ее поглощения по сравнению с несопряженной связью; при этом наблюдается увеличение частоты поглощения. В карбоновых кислотах более высокая частота приписывается колебаниям связи C=O , более низкая – колебаниям связи С=С . Однако в их солях это отношение меняется, и частота колебаний связи С=С становится выше, чем асимметричные колебания С=О , и также при этом примерно на 10 см–1 выше, чем колебания связи С=С в самой кислоте. Это можно объяснить тем, что атом кислорода карбонильной группы координирован на атом металла, что уменьшает частоту колебаний данной связи. В ряде исследуемых лигандов присутствует дополнительное сопряжение с ароматическим кольцом (коричные кислоты) или еще одной кратной связью (сорбиновая кислота), что также влияет на положение валентного колебания кратной связи. Данные по всем отнесенным полосам поглощения представлены в табл. 6, остальные же полосы перечислены в экспериментальной части для каждого исследуемого комплекса. Для удобства сравнения приведены табл. 7 и 8, содержащие основные валентные колебания в молекулах исследуемых карбоновых кислот, а также данные для трифенилсурьмы и трифенилвисмута.
Таблица 6
Основные валентные колебания дикарбоксилатных производных типа Ph 3 M(O 2 CR) 2 , см–1
|
Колебание |
M = Sb |
||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
|
|
ν Sb–O |
454 |
459 |
459 |
460 |
463 |
461 |
454 |
|
ν Sb–C |
561 |
540 |
596 |
565 |
591 |
606 |
573 |
|
νs СOO |
1351 |
1367 |
1355 |
1325 |
1321 |
1334 |
1320 |
|
νa СOO |
1609 |
1580 |
1611 |
1601 |
1603 |
1632 |
1641 |
|
ν С=С |
1664 |
1642 |
1652 |
1643 |
1648 |
1651 |
1648 |
|
ν Ph–H |
3056 |
3053 |
3069 |
3049 |
3061 |
3059 |
3054 |
|
ν C–H |
2974 |
– |
– |
2938 |
– |
2972 |
2978 |
|
s ν NO 2 |
– |
– |
1319 |
– |
– |
– |
– |
|
a ν NO 2 |
– |
– |
1530 |
– |
– |
– |
– |
|
Колебание |
M = Bi |
||||||
|
VIII |
IX |
X |
XI |
XII |
XIII |
XIV |
|
|
ν Bi–O |
449 |
445 |
486 |
448 |
448 |
446 |
451 |
|
ν Bi–C |
593 |
587 |
596 |
514/565 |
591 |
583 |
601 |
|
νs СOO |
1355 |
1369 |
1360 |
1341 |
1340 |
1354 |
1362 |
|
νa СOO |
1558 |
1546 |
1614 |
1603 |
1559 |
1559 |
1600 |
|
ν С=С |
1662 |
1641 |
1645 |
1635 |
1646 |
1649 |
1661 |
|
ν Ph–H |
3050 |
3045 |
3080 |
3048 |
3047 |
3054 |
3054 |
|
ν C–H |
2965 |
– |
– |
2957 |
– |
2967 |
2977 |
|
s ν NO 2 |
– |
– |
1280 |
– |
– |
– |
– |
|
a ν NO 2 |
– |
– |
1537 |
– |
– |
– |
– |
Таблица 7
Основные валентные колебания в исследуемых карбоновых кислотах типа RCH=CHCOOH [25]
|
Колебание |
R |
|||||
|
CH 3 - |
Ph- |
m-NO 2 С 6 H 4 - |
p-MeOС 6 H 4 - |
-C 4 H 3 O |
MeCH=CH- |
|
|
ν С–ОН |
1318 |
1312 |
1307 |
1317 |
1314 |
1330 |
|
ν С=O |
1706 |
1686 |
1691 |
1689 |
1701 |
1694 |
|
ν С=С |
1655 |
1631 |
1691 |
1624 |
1636 |
1638 |
|
ν Ph–H |
– |
3067 |
3092 |
3031 |
– |
– |
|
ν C–H |
2977 |
– |
– |
2973 |
– |
2970 |
|
s ν NO 2 |
– |
– |
1320 |
– |
– |
– |
|
a ν NO 2 |
– |
– |
1524 |
– |
– |
– |
Таблица 8
Основные валентные колебания в молекулах трифенилсурьмы и трифенилвисмута
|
Колебание |
Соединение |
|
|
Ph 3 Sb |
Ph 3 Bi |
|
|
ν Sb–C |
692 |
— |
|
ν Bi–C |
– |
693 |
|
ν Ph–H |
3060 |
3057 |
При интерпретации полученных ИК-спектров возник ряд трудностей, связанных с отнесением полос поглощения к колебаниям связи металл–углерод и металл–кислород, поскольку в разных литературных источниках данные об этих частотах отличаются.
Ранее чаще всего к валентным колебаниям связей M–C и M–O относили полосы поглощения средней интенсивности в области ~465 и ~690 см–1 соответственно. Более низкие колебания связи M–C по сравнению с колебаниями связи M–O можно объяснить тем, что атом углерода входит в достаточно массивную фенильную группу, колеблющуюся с меньшей частотой. Традиционно к валентным колебаниям связи Sb–C и Bi–C относили полосу, находящуюся в области 445–465 см–1 в зависимости от металла и типа лигандов, что оказалось подтверждено многими литературными источниками [26–28]. Однако к валентным колебаниям связи Sb–O и Bi–O обычно приписывали значения 680–697 см–1 [29], что оказалось ошибочным, и правильным будет относить к такому типу колебаний полосу поглощения малой интенсивности в области 515–590 см–1, что также может следовать из литературы [30, 31]. Это также подтверждается тем фактом, что в ИК-спектре трифенилсурьмы Ph 3 Sb и трифенилвисмута Ph 3 Bi отсутствуют полосы поглощения в области 515–590 см–1. Полоса же поглощения 680–697 см–1 может быть отнесена к деформационным колебаниям связи C–C в карбоксилатном лиганде. Данные по колебаниям этих связей для всех исследуемых соединений сведены в табл. 6.
Помимо рассмотренных выше, в молекулах дикарбоксилатов трифенилсурьмы и трифенилвисмута наблюдается еще целый ряд колебаний разного типа. В области высоких частот (2800– 3100 см–1) – валентные колебания связей С–Н средней интенсивности в ароматических и алифатических лигандах, а в области 650–1200 см–1 – деформационные колебания разных связей, отнесение которых здесь не рассматривается. Помимо всего прочего, в некоторых ИК-спектрах в области 1700–2000 см–1 наблюдаются обертоны, характерные для нормальных колебаний однозамещенного ароматического кольца (рис. 3). Однако интенсивность обертона настолько мала, что в спектрах ряда соединений эти полосы практически не видно.
FTIR Measurement 1/cm
Рис. 3. Нормальные колебания однозамещенных фенильных колец
В нескольких исследуемых комплексах присутствуют характерные только для них функциональные группы и заместители. Так, в соединениях III и X присутствует нитрогруппа, присоединенная к ароматическому кольцу, которая также имеет симметричные и асимметричные валентные колебания. Эти колебания находятся в одной области с аналогичными колебаниями связи C=O , однако очень хорошо разделяются, и частоты их поглощения равны 1530 и 1319 см-1 для асимметричных и симметричных валентных колебаний соответственно (1524 и 1320 см–1 в кислоте). В производных фурилакриловой кислоты V и XII присутствует однозамещенное фурановое кольцо, однако оно имеет целый ряд разнообразных колебаний, которые достаточно сложно выделить из спектра.
Отсутствие полос поглощения гидрокси-группы OH карбоновой кислоты является хорошим показателем чистоты исследуемого комплекса. В мономерных карбоновых кислотах эта полоса проявляется в области 3500–3550 см–1, в димерах – в области 2500–3300 см–1, что соответствует валентным колебаниям гидроксильной группы. Для всех исследуемых кислот это колебание наблюдалось в области 2500–2700 см–1, в соответствующих им комплексах сурьмы или висмута этих полос не было, что и свидетельствовало об отсутствии примеси кислоты в продукте реакции.
В некоторых ИК-спектрах также наблюдались полосы поглощения примесных веществ: воды и углекислого газа. Они захватываются из воздуха при изготовлении таблетки KBr. Им соответствуют полосы поглощения в областях 3450 и 2350 см–1 соответственно, что не мешает интерпретации остального спектра.
Типичный ИК-спектр соединения типа Ph3M(O2CR)2 приведен на рис. 4 на примере дикрото-ната трифенилвисмута. ИК-спектры всех исследуемых соединений представлены в экспериментальной части.
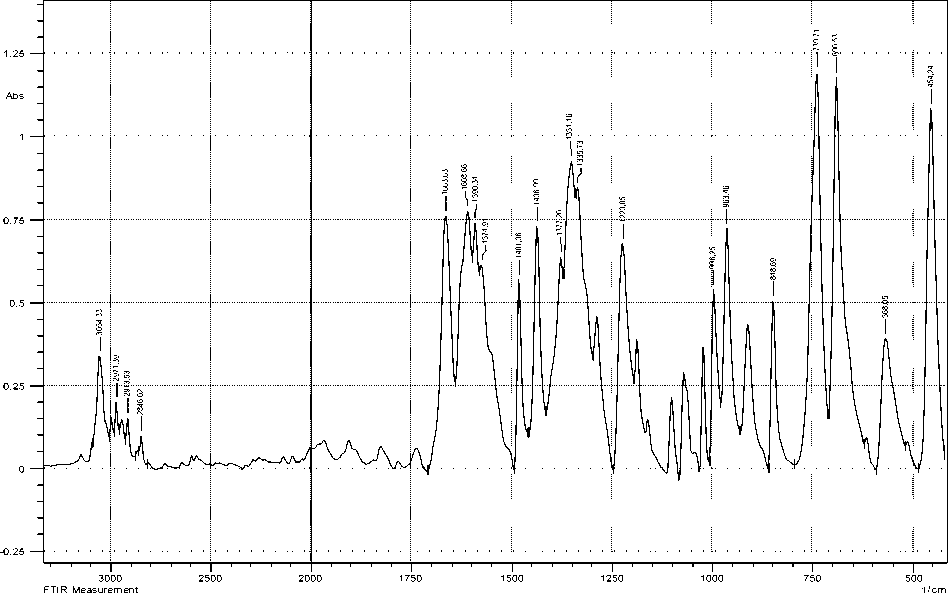
Рис. 4. ИК-спектр дикротоната трифенилвисмута VIII
Выводы
-
1. Взаимодействием трифенилсурьмы с карбоновыми кислотами в присутствии пероксидов в эфире или ТГФ синтезированы 14 дикарбоксилатов трифенилсурьмы и трифенилвисмута типа Ph 3 М(O 2 CR) 2 c кротоновой, коричной, мета-нитрокоричной, пара-метоксикоричной, фурилакри-
- ловой, винилуксусной и сорбиновой кислотами. Состав продуктов подтвержден данными элементного анализа, ЯМР спектроскопии.
-
2. Проанализировано положение характеристических сигналов валентных колебаний основных функциональных групп в ИК-спектрах, и сделаны выводы о монодентатном и бидентатном связывании металлов с карбоксилатными лигандами.
Список литературы Исследование строения производных трифенилсурьмы(V) и трифенилвисмута(V) с некоторыми непредельными карбоновыми кислотами методом ИК-спектроскопии
- Шарутин, В.В. Синтез, реакции и строение арильных соединений пятивалентной сурьмы / B.В. Шарутин, А.И. Поддельский, О.К. Шарутина // Коорд. хим. - 2020. - Т. 46, вып. 10. - C. 579-648. DOI: 10.31857/S0132344X20100011.
- Молекулярные и кристаллические структуры карбоксилатов три- и тетраарилсурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Вестник ЮУрГУ. Серия «Химия». -2011. - Вып. 6. - С. 47-60.
- Synthesis, Structural Characterization and in vitro Antitumour Properties of Triorganoantimo-ny(V) Disalicylates: Crystal and Molecular Structures of [5-Y-2-(ho)-C6H3COO]2SbMe3 (Y = H, Me, MeO) / C. Silvestru, I. Haiduc, R.T. Tiekink et al. // Appl. Organomet. Chem. - 1995. - V. 9, № 7. -P. 597-607. DOI: 10.1002/aoc.590090715.
- Synthesis, Characterization and in vitro Antitumor Activity of Some Arylantimony Ferrocene-carboxylates and Crystal Structures of C5H5FeC5H4CO2SbPh4 and (C5H5FeC5H4CO2)2Sb(4-CH3C6H4)3 / R.C. Liu, Y.Q. Ma, L. Yu et al. // Appl. Organomet. Chem. - 2003. - V. 17, № 9. - P. 662-668. DOI: 10.1002/aoc.491.
- Synthesis, Crystal Structures and in vitro Antitumor Activities of Some Arylantimony Derivatives of Analogues of Demethylcantharimide / G.C. Wang, J. Xiao, L. Yu et al. // J. Organomet. Chem. -2004. - V. 689, № 9. - P. 1631-1638. DOI: 10.1016/j.jorganchem.2004.02.015.
- Mishra, J. Chemotherapy of Leishmaniasis: Past, Present and Future / J. Mishra, A. Saxena, S. Singh // Curr. Med. Chem. - 2007. - V. 14, № 10. - P. 1153-1169. DOI: 10.2174/092986707780362862.
- Novel Triphenylantimony(V) and Triphenylbismuth(V) Complexes with Benzoic Acid Derivatives: Structural Characterization, in vitro Antileishmanial and Antibacterial Activities and Cytotoxicity against Macrophages / A. Islam, J.G. Da Silva, F.M. Berbet et al. // Molecules. - 2014. - V. 19, № 5. -P. 6009-6030. DOI: 10.3390/molecules19056009.
- Anti-leishmanial Activity of Heteroleptic Organometallic Sb(V) Compounds / M.I. Ali, M.K. Rauf, A. Badshah et al. // Dalton Trans. - 2013. - V. 42, № 48. - P. 16733-16741. DOI: 10.1039/c3dt51382c.
- High-Sensitivity Molecular Organometallic Resist for EUV (MORE) / J. Passarelli, M. Murphy, R.D. Re et al. //Adwances in Patterning Materials and Processes XXXII. - 2015. - V. 9425, № 94250T. DOI: 10.1117/12.2086599.
- Cardenas-Trivino, G. Synthesis and Molecular Weights of Metal Poly(methyl methacrylates) / G. Cardenas-Trivino, C. Retamal, K.J. Klabunde // Polym. Bull. (Berlin). - 1991. - V. 25, № 3. -P. 315-318. DOI: 10.1007/BF00316900.
- Cardenas-Trivino, G. Thermogravimetric Studies of Metal Poly(Methylmethacrylates) / G. Cardenas-Trivino, C. Retamal, L.H. Tagle // Thermochim. Acta. - 1991. - V. 176. - P. 233-240. DOI: 10.1016/0040-6031(91)80278-Q.
- Naka, K. Ring-Collapsed Radical Alternating Copolymerization of Phenyl-Substituted Cycloo-ligostibine and Acetylenic Compounds / K. Naka, A. Nakahashi, Y. Chujo // Macromolecules. - 2006. -V. 39, № 24. - P. 8257-8262. DOI: 10.1021/ma061220l.
- Naka, K. Periodic Terpolymerization of Cyclooligoarsine, Cyclooligostibine, and Acetylenic Compound / K. Naka, A. Nakahashi, Y. Chujo // Macromolecules. - 2007. - V. 40, № 5. - P. 13721376. DOI: 10.1021/ma0622332.
- Котон, М.М. О реакционной способности металлоорганических соединений / М.М. Котон // Металлоорганические соединения и радикалы, под ред. М.И. Кабачника - М.: Наука, 1985. - С. 13-22.
- Карраер, Ч. Металлоорганические полимеры / Ч. Карраер, Дж. Шитс, Ч. Питтмен. - М.: Мир, 1981. - 352 с.
- Диакрилаты трифенилвисмута и трифенилсурьмы в синтезе металлосодержащего поли-метилметакрилата / В.А. Додонов, А.В. Гущин, Ю.Л. Кузнецова, В.А Моругова // Вестник ННГУ. Серия химия. - 2004. - Вып. 1(4). - С. 86-94.
- Kensuke, N. Ring-Collapsed Radical Alternating Copolymerization of Phenyl-Substituted Cyclooligostibine and Acetylenic Compounds / N. Kensuke, N. Akiko, C. Yoshiki // Macromolecules. -2006. - V. 39(24). - P. 8257-8262. DOI: 10.1021/ma061220l.
- Brief Note Improved Methods for the Synthesis of Antimony Triacetate, Triphenylantimony Diacetate, and Pentaphenylantimony / T.C. Thepe, R.I. Garascia, M.A. Selvoski, A.N. Pattel // Ohio S. Sci. - 1977. - V. 77, № 3. - P. 134-135.
- Додонов, В.А. Синтез и некоторые реакции диацилатов трифенилвисмута / В.А. Додонов, А.В. Гущин, Т.Г. Брилкина // Журн. общ. химии. - 1985. - Т. 55, № 1. - С. 73.
- Гильман, Г. Синтез органических препаратов. Сборник I / Г. Гильман; пер. с англ. А.Ф. Платэ. - M.: И.Л, 1949. - 604 с.
- Реакции пентаарилсурьмы с дикарбоксилатами триарилсурьмы / В.В. Шарутин, О.К. Шарутина, А.П. Пакусина, В.К. Бельский // Журн. общ. химии. - 1997. - V. 9. - P. 15361541.
- Галогениды и некоторые карбоксилаты тетрафенилсурьмы в каталитической реакции фенилирования метилакрилата / А.В. Гущин, Е.В. Грунова, Д.В. Моисеев и др. // Изв. АН. Сер. хим. - 2003. - № 6. - С. 1302-1305. DOI: 10.1023/A:102488332886.
- Казицина, Л.А. Применение УФ-, ИК- и ЯМР-спектроскопии в органической химии / Л.А. Казицина, Н.Б. Куплетская. - М.: Высшая школа, 1971. - 264 с.
- Смит, А Прикладная ИК-спектроскопия / А. Смит; пер. с англ. к.х.н. Б.Н. Тарасевича. -М.: Мир, 2001. - 327 с.
- https://sdbs.db.aist.go.jp/sdbs/cgi-bin/direct_frame_top.cgi.
- Synthesis and Characterization of Some Triphenylantimony(V) Derivatives of N, О and S Containing Monofunctional Bidentate Ligands / P.K. Sharma, R.K. Sharma, A.K. Rai, Y.P. Singh // Main Group Metal Chemistry. - 2011. - V. 27, Is. 1. - P. 51-57. DOI: 10.1515/MGMC.2004.27.1.51.
- Yadav, R.N.P. Triarylantimony (V) Dicarboxylates: Synthesis, Characterisation and Reactions / R.N.P. Yadav // Global Journal of Science Frontier Research: B Chemistry. - 2015. - V. 15, is. 3. -P.35-39.
- Singal, K.S. Synthesis, Characterization, and In Vitro Antimicrobial and Antitumor Activities of Some Tetraphenylstibonium (V) Carboxylates / K.S. Singal // Heteroatom Chemistry. - 2008. -V. 19. - P. 688-693. DOI: 10.1002/hc/20498.
- Batsanov, S.S. Van der Waals Radii of Elements / S.S. Batsanov // Inorganic Materials. -2001. - V. 37, Is. 9. - P. 871-885.
- Maslowsky, E. Vibrational Spectra of Organometallic Compaunds / E. Maslowsky. - New York, London, Sydney, Toronto: A Wiley-Interscience Publication, 1977. - 528 p.
- Synthetic, Spectroscopic and Structural Aspects of Triphenylantimony (V) Complexes with Internally functionalized Oximes: Crystal and Molecular Structure of [Ph3Sb(ON=C(Me)C5H4N-2}2] / A. Gupta, R.K. Sharma, R. Bohra et al. // Polyhedron. - 2002. - V. 21. - P. 2387-2392.


