Исследование связи параметров иммунной системы с эффективностью неоадъювантной химиотерапии у больных раком молочной железы
Автор: Стахеева М.Н., Кухарев Я.В., Гарбуков Е.Ю., Литвяков Н.В., Бабышкина Н.Н., Медюхина А.А., Дорошенко А.В., Кокорина Ю.А., Слонимская Е.М., Кологривова Е.Н., Чердынцева Н.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3-1 т.23, 2008 года.
Бесплатный доступ
Целью работы явилось определение особенностей динамики параметров иммунной системы (ИС) у больных раком молочной железы (РМЖ) с различной эффективностью неоадъювантной химиотерапии (НАХТ). В исследование включены 209 больных РМЖ, получавших лечение в НИИ онкологии ТНЦ СО РАМН. В плане комбинированного лечения пациентам проводилась НАХТ по различным схемам, ее эффективность оценивалась по критериям ВОЗ. Пациенты разделены на 2 группы: с объективным ответом опухоли на химиотерапию (полная или частичная регрессия первичной опухоли) и с отсутствием ответа (стабилизация или прогрессирование). До начала лечения и после НАХТ определяли показатели ИС периферической крови, включая продукцию цитокинов. Высокие показатели эффективности НАХТ сопряжены с выраженной реактивностью ИС в условиях повреждающего воздействия, тогда как при отсутствии противоопухолевого эффекта ИС характеризовалась ригидностью. Наличие различий в исходных параметрах ИС у больных с разной эффективностью НАХТ свидетельствует об актуальности поиска информа тивных маркеров ИС, которые могли бы служить в качестве дополнительных предсказательных критериев эффективности предоперационной химиотерапии.
Иммунная система, рак молочной железы, химиотерапия
Короткий адрес: https://sciup.org/14918875
IDR: 14918875 | УДК: 618.19-006.6:615.28:612.017.1
Текст научной статьи Исследование связи параметров иммунной системы с эффективностью неоадъювантной химиотерапии у больных раком молочной железы
E-mail: StakheyevaM@oncology.tomsk.ru.
ИССЛЕДОВАНИЕ СВЯЗИ ПАРАМЕТРОВ
ИММУННОЙ СИСТЕМЫ С
ЭФФЕКТИВНОСТЬЮ НЕОАДЪЮВАНТНОЙ
ХИМИОТЕРАПИИ У БОЛЬНЫХ РАКОМ
МОЛОЧНОЙ ЖЕЛЕЗЫ
-
* ГУ НИИ онкологии Томского научного центра СО РАМН;
-
* * ГОУ ВПО Сибирский государственный медицинский университет Росздрава, г. Томск
Известно, что злокачественная трансформация клеток происходит в результате нарушения механизмов внутриклеточного контроля генетического постоянства, включающих гены пролиферации, апопто- за, а также другие гены, поддерживающие стабильность генома. Однако только в случае преодоления и внеклеточного контроля, который осуществляет иммунная система (ИС), опухоль может прогрессировать и уничтожить организм хозяина, причем в этот процесс активно вовлекается микроокружение – клетки стромы и иммунной системы. Получены экспериментальные и клинические доказательства, что иммунная система в различных ситуациях в зависимости от условий, определяющих особенности опухоли и ее микроокружения, способна вести себя по-разному, а именно – элиминировать трансформированные клоны, препятствовать или способствовать прогрессии возникшей опухоли [1, 2].
Иммунная система играет важную роль в контроле так называемой «остаточной» опухоли, то есть опухолевых клеток, оставшихся в организме после операции, на элиминацию которых направлены послеоперационные цитостатические воздействия – лучевая и лекарственная терапия. В последние годы выявлены механизмы участия эффекторов врожденного и адаптивного иммунитета в элиминации клеток опухоли, а также представлено много сведений о вовлечении ИС в контроль ее прогрессии при противоопухолевой лучевой и химиотерапии (ХТ) [3, 4]. Рассматриваются два основных пути участия ИС в противоопухолевом действии при цитостатических воздействиях. Первый – под влиянием лучевой или химиотерапии опухолевые клетки становятся иммуногенными, вследствие чего может быть инициирован специфический иммунный ответ. Второй – некоторые лекарственные препараты могут повышать противоопухолевый потенциал ИС посредством транзиторной лимфопении, отмены иммуносупрессии прямой или непрямой активации эффекторных клеток [5].
В настоящее время выявлен ряд механизмов инициации неспецифических эффекторов или адаптивного иммунного ответа против клеток опухоли, поврежденных в результате воздействия химиопрепаратов или облучения. Показано, что индукция сигнального пути в ответ на повреждение ДНК в опухолевой клетке приводит к экспрессии NKG2D лигандов, которые распознаются натуральными кил-лерными клетками, гамма-дельта Т-лимфоцитами, активированными CD8+ Т-лимфоцитами, несущими специфический рецептор [6]. Иммуноадьювант-ные свойства многих широко применяемых в современной онкологии препаратов (циклофосфан, антрациклиновые антибиотики, 5-фторурацил, так-саны) опосредуются сигналами от стрессированных (с наличием ДНК-повреждения) или умирающих (в результате некроза или апоптоза) клеток, которые активируют поглощение антигена и созревание антиген-презентирующих дендритных клеток и повышают чувствительность опухолевых клеток к цитотоксическому действию эффекторов ИС. Индукция лимфопении приводит к активации гомеостатических механизмов стимуляции опухоль-реактивных Т-лимфоцитов, при этом может наблюдаться эради-кация Т-регуляторных CD4+ CD25+ -лимфоцитов супрессоров, в частности, под влиянием циклофос-фана [7, 8]. Показана роль «Toll-like» рецепторов на дендритных клетках (TLR4, TLR9), для которых выявлен специфичный лиганд, экспрессирующийся на мембранах опухолевых клеток в поздней фазе апоптоза (high mobility group box 1 protein – HMGB1), в представлении стрессированных опухолевых клеток цитотоксическим лимфоидным эффекторам. Есть данные о том, что дефект TLR4 в результате генетического полиморфизма ассоциирован с уменьшением эффективности ХТ у больных раком молочной железы [9]. Все вышесказанное дает основания считать, что врожденные дефекты (за счет генетического полиморфизма) или нарушения ИС в результате иммунопатологии, старения, или терапевтических воздействий, могут существенно влиять на эффективность противоопухолевой терапии.
Неоадъювантная химиотерапия (НАХТ) широко используется при лечении больных раком молочной железы, позволяя перевести местно-распространенные процессы в операбельные, увеличить количество органосохранных оперативных вмешательств, оценить чувствительность опухоли к химиотерапии и прогнозировать отдалённый исход [10]. Вопрос о возможности стимуляции эффективного противоопухо-40
левого иммунитета под влиянием НАХТ остается открытым и находится на стадии накопления клинического материала и изучения механизмов индукции иммуно-опосредованного ответа против опухоли в условиях цитостатических воздействий. Выявление параметров иммунной системы больных, ассоциированных с различной эффективностью НАХТ, может быть полезным в плане определения маркеров, дающих дополнительную информацию о способности организма отвечать на химиотерапию и о вкладе ИС в этот процесс.
Цель проводимого исследования заключалась в определении особенностей динамики параметров иммунной системы у больных раком молочной железы с различной эффективностью неоадьювантной химиотерапии.
МАТЕРИАЛ И МЕТОДЫ
В исследование включены 209 больных раком молочной железы, T1-4N0-2M0 стадии опухолевого процесса (средний возраст 50,8±1,1 лет), находившихся на лечении в НИИ онкологии Томского научного центра СО РАМН, и 37 относительно здоровых женщин сопоставимого возраста (группа контроля). В плане комбинированного лечения всем больным проводилось 2-4 курса НАХТ по схемам FAC (фторурацил, адриамицин, циклофосфан), CAF (циклофосфан, адриамицин, фторурацил), CMF (циклофосфан, метотрексат, фторурацил), а также использовались схемы с применением ксело-ды. Эффективность НАХТ оценивалась по критериям ВОЗ (клинически, по данным УЗИ и маммографии). В зависимости от полученной эффективности лечения были сформированы 2 группы пациентов: в первую группу вошла 61 пациентка, у которых после проведения НАХТ зарегистрирована полная или частичная регрессия первичной опухоли (объективный ответ опухоли на химиотерапию), вторую группу составили 66 больных со стабилизацией либо прогрессированием опухолевого процесса (отсутствие объективного ответа) на фоне лечения.
До начала лечения и после НАХТ определяли количественные и качественные характеристики параметров иммунной системы. Субпопуляционный состав лимфоцитов крови оценивали иммуноцитохимическим методом с использованием моноклональных антител к антигенным детерминантам CD3, CD4, CD8, CD16, CD72, CD25, CD95 (Novocastra Lab LTd, Англия). Продукцию цитокинов ИЛ-1, ИЛ-2, ИЛ-4, ФНО-альфа, ИФН-гамма (спонтанную и стимулированную митогенами) мононуклеарными клетками периферической крови (МНПК) оценивали с использованием наборов для иммуноферментного анализа (ООО «Цитокин», Санкт-Петербург, Россия). Функциональная активность нейтрофильных гранулоцитов оценивалась в тесте восстановления нитро-синего тетразолия [11], подсчитывали фагоцитарный резерв как разницу показателей в стимулированном
(частицами опсонизированного зимозана) и спонтанном вариантах [12]. Содержание иммуноглобулинов классов А, М, G в сыворотке крови определяли с использованием наборов для иммуноферментного анализа (ЗАО «Вектор-Бэст», Кольцово, Россия).
Различия средних значений признаков в группах оценивали с использованием непараметрических критериев Манна-Уитни для независимых выборок и Вилкоксона – для связанных выборок. Гипотеза о различиях средних значений показателей в сравниваемых группах принималась при уровне значимости р<0,05 [13].
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Оценка исходного уровня параметров иммунного статуса пациентов, разделенных на 2 подгруппы на основании ответа опухоли на предоперационную терапию, в сравнении с показателями здоровых доноров (ЗД) выявила однонаправленные изменения в функционировании иммунной системы на фоне опухолевого роста: отмечены признаки угнетения функциональной активности Т-клеточного звена, о чем свидетельствует уменьшение пролиферативной активности лимфоцитов при стимуляции фитогемагглютинином (ФГА); р<0,05, В-клеточного звена, на что указывает снижение способности клеток к спонтанной и стимулированной продукции одного из ключевых регуляторных цитокинов IL-4 (р<0,05) . Со стороны показателей врождённого иммунитета как в первой, так и во второй группе отмечены признаки усиления активности фагоцитарного звена, а именно, достоверно повышенные в сравнении со ЗД значения, характеризующие фагоцитарный резерв нейтрофилов крови (р<0,05).
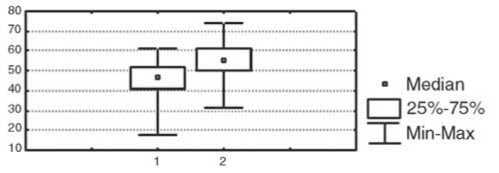
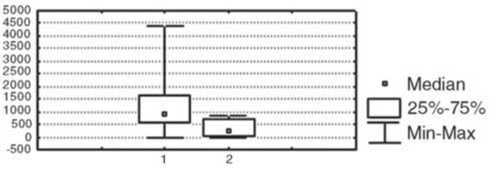
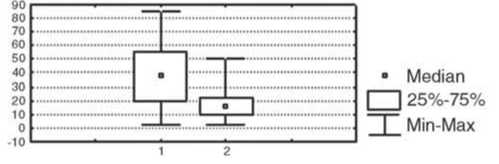
При сравнении показателей иммунной системы в вышеуказанных группах было выявлено, что у пациенток с выраженной эффективностью НАХТ (полная и частичная регрессия опухоли) до лечения ре- гистрировалось более низкое абсолютное количество Т-клеток (CD3+-лимфоциты); р<0,05, более высокий уровень фагоцитарного резерва полиморфноядерных нейтрофилов (р<0,05), более выраженная способность мононуклеаров периферической крови к продукции провоспалительного цитокина TNF-a (р<0,05) и противовоспалительного цитокина IL-10 (р<0,05), чем в группе пациентов, у которых не наблюдалось объективного ответа опухоли на химиотерапию (рис. 1).
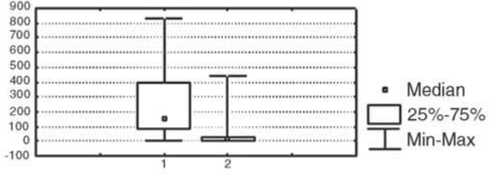
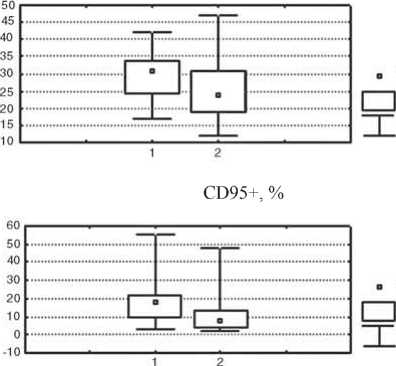
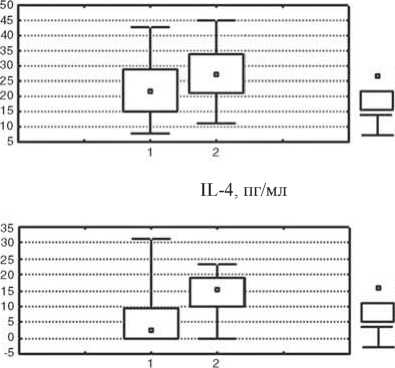
Изменение показателей иммунного статуса у больных после проведения предоперационной химиотерапии отражает реакцию иммунной системы на достаточно агрессивное воздействие цитостатических препаратов. После НАХТ у больных первой группы зарегистрировано статистически значимое в сравнении с исходным уровнем снижение относительного количества лимфоцитов и активированных клеток с повышенной готовностью к апоптозу, которые экспрессируют мембранные детерминанты CD95 (р<0,05), а также повышение уровня Т-цитотоксических лимфоцитов (CD8+-клетки); р<0,05 и интенсивности стимулированной секреции IL-4 в культуре МНПК (р<0,05); рис. 2. У пациенток с неэффективным результатом НАХТ (вторая группа) в динамике изменения параметров после НАХТ зарегистрировано достоверное снижение концентрации сывороточного IgM (р<0,05) и снижение фагоцитарного резерва (р<0,05); рис. 3, при этом не отмечено изменения параметров, характеризующих активность клеточного звена иммунитета и регуляторных цитокинов.
Различия иммунологических параметров после лечения в двух сравниваемых группах заключались в более высоком уровне продукции ИЛ-10 (р<0,05) и показателей фагоцитарного резерва (р<0,05) у пациенток с положительным эффектом НАХТ (рис. 4).
Зарегистрированные изменения показателей ИС
CD3+, %
TNF-α, пг/мл
Фагоцитарный резерв, %
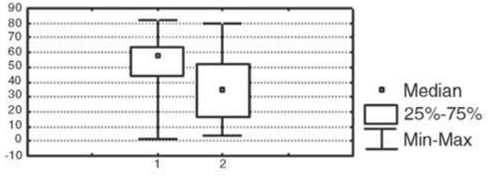
Рис.1. Исходный уровень иммунологических показателей в группах у больных с различной эффективностью НАХТ.
Условные обозначения: 1 – группа с объективным ответом опухоли на НАХТ, 2 – группа с отсутствием объективного ответа опухоли на НАХТ
IL-10, пг/мл
Лимфоциты, %
Median
Median 25%-75%
CD8+, %
Median
Median
25%-75%
Рис. 2. Изменение показателей системы иммунитета у больных РМЖ с объективным ответом на НАХТ по сравнению с исходным уровнем.
Условные обозначения: здесь и в рис. 3: 1 – показатели системы иммунитета до начала НАХТ, 2 – показатели после НАХТ
IgM, мг/л Фагоцитарный резерв, %
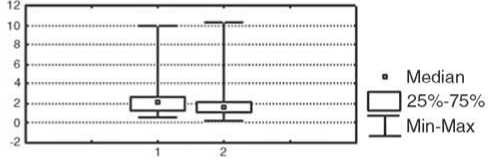
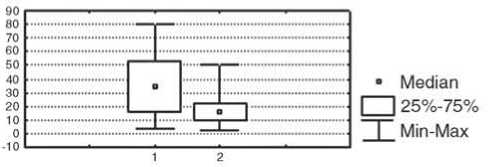
Рис. 3. Изменение показателей системы иммунитета у больных РМЖ без объективного ответа на НАХТ по сравнению с исходным уровнем
Фагоцитарный резерв, %
IL-10, пг/мл
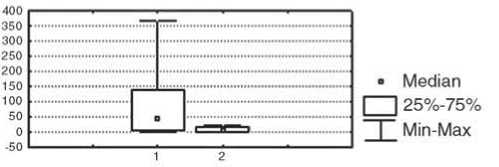
Рис. 4. Отличия иммунологических показателей у больных РМЖ с объективным ответом опухоли на НАХТ и без объективного ответа. Условные обозначения: 1 – группа с объективным ответом опухоли на НАХТ, 2 – группа с отсутствием объективного ответа опухоли на НАХТ
после проведения предоперационной химиотерапии свидетельствуют о возможном вкладе системы иммунитета в эффективность лечения в группе пациентов с хорошим терапевтическим результатом. Этот вклад может быть обусловлен более выраженной компенсаторной реакцией на лимфопению, которая подтверждается повышением процента цитотоксических Т-лимфоцитов (CD8+ -клеток). При этом важным является снижение относительного числа лимфоцитов с высоким проапоптотическим потенциалом (несущим СD95 молекулу), что свидетельствует о более высокой их резистентности к повреждающему воздействию химиопрепаратов.
Таким образом, в результате проведенных иссле- дований у больных РМЖ выявлены определенные ассоциации параметров системы иммунитета с разной противоопухолевой эффективностью НАХТ. Различные значения изучаемых показателей в сравниваемых группах пациентов отмечены как перед началом проведения терапии, так и после ее окончания.
Высокие показатели эффективности НАХТ (достижение полной и частичной регрессии опухоли) сопряжены с выраженной реактивностью ИС в условиях повреждающего воздействия, что проявляется более высокой резистентностью лимфоцитов крови к апоптозу, повышением уровня цитотоксических лимфоцитов и продукции цитокинов с противовоспалительной активностью. При отсутствии противоопухолевого эффекта (стабилизация либо прогрессирование процесса) ИС характеризовалась ригидностью, что проявлялось в отсутствии реакции со стороны клеточных эффекторов врожденного и адаптивного иммунитета и иммунорегуляторных цитокинов.
Наличие различий в исходных показателях (определенных до назначения лечения) системы иммунитета у больных с разной эффективностью НАХТ свидетельствует об актуальности дальнейших исследований для оценки информативности этих показателей в качестве дополнительных предсказательных критериев эффективности предоперационной химиотерапии.
Список литературы Исследование связи параметров иммунной системы с эффективностью неоадъювантной химиотерапии у больных раком молочной железы
- Swann J.B., Smyth M.J. Immune surveillance of tumors//The Journal of Clinical Investigation. -2007, Vol. 117, 5. -P. 1137-1147.
- Zitvogel L., Tesniere A. & Kroemer, G. Cancer despite immunosurveillance: immunoselection and immunosubversion//Nature Rev. Immunol. -2006, 6. -P. 715-727.
- Zitvogel L., Apetoh L., Ghiringhelli F. and Kroeme G. Immunological aspects of cancer Chemotherapy. Nature Reviews. Immunology. -2008. -Vol. 8, 1. -P. 59-73.
- Reits E.A. et al. Radiation modulates the peptide repertoire, enhances MHC class I expression, and induces successful antitumor immunotherapy//J. Exp. Med. -2006, 203. -P. 1259-1271.
- North R.J. Cyclophosphamide-facilitated adoptive immunotherapy of an established tumor depends on elimination of tumor-induced suppressor T cells//J. Exp. Med. -1982, 155. -P. 1063-1074.
- Xue W. et al. Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas//Nature. -2007, 445. -P. 656-660.
- Ghiringhelli F. et al. CD4+CD25+ regulatory T cells inhibit natural killer cell functions in a transforming growth factor-β-dependent manner//J. Exp. Med. -2005, 202. -P. 1075-1085.
- Ghiringhelli, F. et al. Metronomic cyclophosphamide regimen selectively depletes CD4+CD25+ regulatory T cells and restores T and NK effector functions in end stage cancer patients//Cancer Immunol. Immunother. -2007, 56. -P. 641-648.
- Apetoh L. et al. Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy//Nature Med. -2007, 13. -P. 1050-1059.
- Kaufmann M, Hortobagyi GN, Goldhirsch A, et al. Recommendations from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: an update//J Clin Oncol. -2006. -Vol. 24. P. 1940-1949.
- Нестерова И.В., Колесникова Н.В., Симбирцев А.С., Ломатидзе Л.В. Влияние длительного введения синтетического дипептида на функциональную активность нейтрофильных гранулоцитов в эксперименте in vivo//Иммунология, -1999, № 6, -С. 40-43, С. 60-62.
- Маянский А.Н., Пикуза О.И. Клинические аспекты фагоцитоза. -Казань, 1993. -192 с.
- Реброва О.Ю. Статистический анализ медицинских данных. -Медиа Сфера, -2003. -305 с.


