Исследование тканевой активности металлопротеиназ при гетерогенных формах аденомиоза
Автор: Леваков Сергей Александрович, Коробейников Алексей Петрович, Демура Т.А.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 3 (3), 2010 года.
Бесплатный доступ
Изучали ферментативную активность матриксных металлопротеиназ (ММР) 2 и 9 в операционном материале (ампутированные матки) по поводу диффузной и узловой формах аденомиоза у женщин в позднем репродуктивном периоде. Исследование проводили с использованием иммуногистохимического метода на парафиновых срезах. Результаты иммуногистохимической реакции оценивали полуколичественным методом в баллах по числу позитивно окрашенных клеток. Показано усиление активации и экспрессии желатиназ ММР2 и ММР9 при диффузной и узловой формах аденомиоза и различных степенях поражения миометрия. Также установлено, что при диффузной и узловой формах аденомиоза в строме и миометрии экспрессия желатиназы ММР9 была интенсивнее.
Матриксные металлопротеиназы, желатиназы, аденомиоз, миома матки, эндометрий
Короткий адрес: https://sciup.org/14338335
IDR: 14338335
Текст научной статьи Исследование тканевой активности металлопротеиназ при гетерогенных формах аденомиоза
Среди значительных достижений нашего времени особое место занимает открытие универсальной роли процессов протеолиза в регуляции различных сторон жизнедеятельности организма. Протеолитические ферменты являются одним из механизмов контроля функций органов и тканей. Эти ферменты имеют регуляторное значение для молекулярных механизмов тонких биологических процессов, таких как деление клеток, дифференцировка и морфогенез.
Семейство матриксных металлопротеиназ – это группа родственных по структуре цинк-содержащих эндопептидаз, разрушающих базальные мембраны и внеклеточ- ный матрикс при физиологических и патологических условиях [1].
В гинекологической практике одним из наиболее часто встречающихся заболеваний, связанных с перестройкой соединительной ткани, является эндометриоз [2]. Эктопический рост эндометрия при эндометриозе представляет собой инвазивное событие, при котором происходит деградация базальных мембран и экстрацеллюлярного матрикса. Роль желатиназ в патофизиологии эндометриоза еще недостаточно изучена. Некоторыми исследованиями установлено их участие в прогрессировании этого заболевания [3, 4].
Раннее показано, что экспрессия ММП-2 в эктопических тканях эндометрия значительно повышается по сравнению с нормальными тканями.
Форма генитального эндометриоза, когда гетеротопии эндометриоидной ткани обнаруживаются в миометрии, называется аденомиозом [5].
Аденомиоз представляет одну из наиболее острых проблем современной гинекологии, занимая третье место после воспалительных процессов и миомы матки. Отмечается рост этого заболевания в структуре гинекологической патологии [6].
Макроскопически аденомиоз проявляется увеличением тела матки и гиперплазией эндометрия. В зоне эндометриоза возможно также образование кистозных полостей с геморрагическим содержимым или формирование узловых элементов с преобладанием стромальной эндометриоидной ткани. Наиболее распространенными видами аденомиоза на данный момент являются диффузный и узловой.
На основании имеющихся сведений можно полагать, что в развитии и прогрессировании аденомиоза определенную роль играет измененная в силу различных обстоятельств протеолитическая активность тканей. Все изложенные факты позволили нам предположить, что при аденомиозе также возможно изменение тканевой активности матриксных металлопротеиназ (ММР-2 и ММР-9) [7].
Целью исследования явилось изучение тканевой активности матриксных металлопротеиназ (ММР-2 и ММР-9) при различных формах аденомиоза.
Материалы и методы
Исследование выполнено на операционном материале (ампутированные матки), полученном от 45 пациенток позднего репродуктивного возраста с верифицированным диагнозом диффузной и узловой форм аденомиоза. Средний возраст пациенток – 45,5 ± 3,3 года.
Контрольную группу составили 18 наблюдений – женщин позднего репродуктивного возраста (средний возраст – 43,5 ± 3,3
года) с миомой матки. Исследован операционный материал – удаленные матки. Во всех наблюдениях оценивали ферментативную активность ММР-2 и ММР-9, активность равнялась 0,35 и 1,05 соответственно.
Иммуногистохимическое исследование (ИГХ) выполнено на операционном материале от пациенток с аденомиозом, отобранном по результатам изучения морфологии. В исследование включены 20 пациенток преимущественно с узловой формой аденомиоза высокой степени активности и 25 больных – с диффузной формой аденомиоза.
В настоящей работе из всего многообразия ММР объектом для исследования выбраны ММР-9 и ММР-2. Это связанно с тем, что желатиназа ММР-9 имеет наибольшую протеолитическую активность в отношении разных типов коллагена (включая коллаген IV типа, ламинин и эластин), а также компонентов базальных мембран [8].
Послеоперационный материал окрашивался для иммуногистохимического метода.
Демаскировку антигенов для ИГХ проводили в микроволновой печи. Стекла погружали в цитратный буфер (рН 6,0) и нагревали в микроволновой печи в течение 15 мин при мощности 600 Вт.
После этого стекла остывали 20 мин при комнатной температуре. Остывшие стекла перемещали во влажные камеры (для предотвращения высыхания срезов) и инкубировали 15 мин с 3% раствором Н2О2. После обработки перекисью стекла ополаскивали в фосфатном буфере (рН 7,0-7,6). Далее стекла инкубировали с 1% раствором альбумина во влажных камерах в течение 30 мин. По окончании инкубации излишки альбумина аккуратно стряхивали со стекол и раскапывали первичные антитела. В качестве первичных антител использовали моноклональные антитела к ММП-2 и ММП-9 (Lab Vision, Ready-to-use 7 ml). Срезы инкубировали с первичными антителами 30 мин. Затем стекла отмывали в фосфатном буфере (рН 7,0-7,6) от первичных антител, не связавшихся с эпитопами, и обрабатывали вторичными антителами
(Ultra V HRP polymer KIT Lab Vision). Для визуализации места связывания антигена с антителом использовали метку – пероксидазу хрена в присутствии субстрата пероксида водорода и колориметрического реактива с 3,3-диаминобензидином (DAB sub-strate+chromogen Lab Vision). В результате образовывался нерастворимый в органических растворителях конечный продукт реакции, который обнаруживался в виде коричневого окрашивания. Для облегчения определения локализации антигенов в тканях проводили доокраску ядер гематоксилином. Ставили положительные контрольные реакции на срезах от фирмы-производителя антитела с известным распределением маркера и отрицательные контрольные реакции – на срезах исследуемых тканей без специфических первичных антител.
Результаты иммуногистохимической реакции оценивали полуколичественным методом в баллах по количеству позитивно окрашенных клеток. Оценку интенсивности реакции для ММП-2 и ММП-9 проводили по 6-балльной системе: 2 балла – до 20% окрашенных клеток; 4 балла – от 20 до 40% окрашенных клеток; 6 баллов – более 40% окрашенных клеток.
Результаты исследования и их обсуждение
Результаты иммуногистохимических реакций показали, что активность экспрессии ММР-2 в биоптатах миометрия в наблюдениях с диффузной формой аденомиоза достоверно отличалась (р < 0,03) от активности в эпителии (3,5 балла) и строме (2,4 балла). Активность ММР-2 при узловой форме была оценена в 3,1 балла в эпителии и 2,3 балла в строме. Аналогичная активность ММР-2 наблюдалась в эндотелии (4,1 балла) и в миометрии 1,1 балл, против 4,4 баллов в эндотелии и 1,3 баллов в миометриии (рис.1).
Активность экспрессии ММР-9 в эндотелии, в эпителии, в миометрии была выражена как при диффузной (в разной степени), так и при узловой формах во всех наблюдениях; средний балл составил 5,2, достовер-
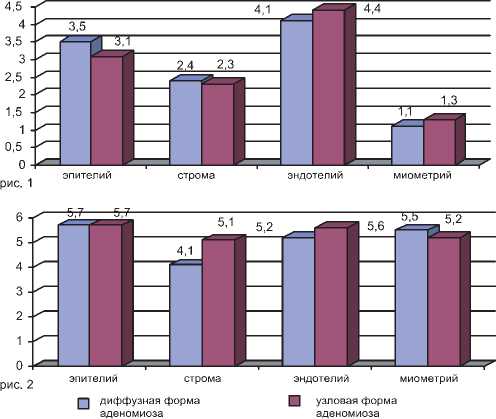
Рис. 1. Активность экспрессии ММР-2 в тканях матки при аденомиозе
Рис. 2. Активность экспрессии ММР-9 в тканях матки при аденомиозе ных различий не отмечено (р > 0,05). Уровень экспрессии ММР-9 был выше в строме биоптатов с узловым аденомиозом (5,1 ± 0,5 баллов), чем при диффузной форме (4,1 ± 0,7 баллов) и достоверно различались между собой (р < 0,02) (рис. 2).
Проведенное иммуногистохимическое исследование активности экспрессии протеолитических ферментов в тканях матки при различных формах и степенях аденомиоза свидетельствует о том, что ММР-2 и ММР-9 активно участвуют в патогенезе как при диффузных, так и узловых формах аденомиоза. Однако активность экспрессии ММР-9 была выше (р < 0,02) и в стромальном компоненте, и в миометрии при диффузной и узловой формах аденомиоза (табл. 1).
Заключение
По результатам проведенного иммуногистохимического исследования тканей матки можно сделать выводы, что усиление активности металлопротеиназ (ММР-2 и ММР-9) в тканях коррелирует с усилением патологической трансформации стромального компонента и миометрия.
Активация экспрессии желатиназ (ММР-2 и ММР-9) при диффузной и узловой формах аденомиоза и их различных степенях поражения миометрия достоверно не различались (р < 0,05). Следует
Тканевая активность матриксных металлопротеиназ в матке при различных формах аденомиоза в баллах, M±m
Таблица 1
|
Группы |
Эпителий |
Строма |
Эндотелий |
Миометрий |
||||
|
ММР-2 |
ММР-9 |
ММР-2 |
ММР-9 |
ММР-2 |
ММР-9 |
ММР-2 |
ММР-9 |
|
|
Диффузная форма аденомиоза (n=25) |
3,5 |
5,7 |
2,4 |
4,0 |
4,1 |
5,2 |
1,1 |
5,5 |
|
Узловая форма аденомиоза (n=20) |
3,1 |
5,7 |
2,7 |
5,1 |
4,4 |
5,6 |
1,3 |
5,2 |
|
Контрольная группа (n=18) |
0,35 |
1,05 |
0,35 |
1,05 |
0,35 |
1,05 |
– |
– |
отметить, что в строме и миометрии при диффузной и узловой формах аденомиоза экспрессия желатиназы ММР-9 была более выраженной и достоверно отличалась от экспрессии ММР-2: 5 и 2 балла соответственно (р < 0,02).
Таким образом, отработка кривой алгоритма активации экспрессии ММР-9 в биоптатах миометрия при различных формах аденомиоза может служить ранним маркером трансформации стромы и миометрия при аденомиозе.
Список литературы Исследование тканевой активности металлопротеиназ при гетерогенных формах аденомиоза
- Newby AC. Studying mechanisms underlying shedding of endothelial membrane proteins could help patients at risk for myocardial infarction//Cardiovasc Res. 2005 Jul 1;67(1):45.
- Баскаков В.П., Цвелев Ю.В. Кира Е.Ф. Эндометриоидная болезнь. СПб: ООО "Издательство НЛ", 2002. С 136-141.
- Борзенкова И.П. Экспрессия матриксных металлопротеиназ в эндометрии при генитальном эндометриозе//XXX Юбилейная итоговая конф. молодых учёных. 2008. С. 50-52.
- Стрижов Н.В., Сухих Г.Т., Соболева Г.М. и соавт. Сравнение сывороточной активности матриксной металлопротеиназы у больных с железистой и железистокистозной гиперплазиями эндометрия в перименопаузе//Проблемы репродукции. Спец. выпуск. 2008. С. 312-13.
- Адамян Л.В., Кулаков В.И. Эндометриозы. Руководство для врачей. М: Медицина, 1998. 380 с.
- Бурлев В.А., Лец Н.И. Роль брюшины в патогенезе наружного генитального эндометриоза: обзор литературы//Проблемы репродукции. 2000. № 1. С. 25-29.
- Волощук И.Н., Ромаданова Ю.А., Ищенко А.И., Бахвалова А.А. Молекулярнобиологические аспекты патогенеза аденомиоза//Архив патологии. 2007. № 3. С. 56-60.
- Newby AC. Matrix metalloproteinases regulate migration, proliferation, and death of vascular smooth muscle cells by degrading matrix and nonmatrix substrates//Cardiovasc Res. 2006 Feb 15;69(3):614-24.


