Исследование влияния ультразвуковой обработки в жидких средах различного состава на поверхностную микрофлору мясных полуфабрикатов
Автор: Мауль Д., Красникова Л.В., Громцев А.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Процессы и аппараты пищевых производств
Статья в выпуске: 3 (73), 2017 года.
Бесплатный доступ
Для предотвращения микробиологической порчи мясо и мясные продукты подвергают различным видам обработки. Однако эти методы не обеспечивают стерилизацию продукта, могут снижать его пищевую и биологическую ценность. В этой связи особую актуальность приобретает изучение инновационных методов, гарантирующих потребителю безопасные и минимально обработанные продукты. Большим потенциалом в этом отношении обладает применение молочнокислых бактерий (МКБ) и обработка ультразвуком (УЗ). Проведены исследования поверхностной микрофлоры мясных полуфабрикатов с целью подтверждения положительного влияния УЗ обработки в различных жидких средах на их микробиологическую стабильность. Исследования включали определение антагонистической активности штаммов бактерий рода Lactobacillus acidophilus по отношению к типичной микрофлоре охлажденных мясных полуфабрикатов. По результатам опытов отобран наиболее активный штамм ацидофильной палочки – штамм 7m13. Наименьшей антагонистической активностью обладал штамм 5e. Установлены следующие параметры режима УЗ обработки: мощность 350 Вт с экспозицией 2 мин, что позволяет избежать нежелательных денатурационных изменений белков мышечной ткани. Обработка опытных образцов включала следующие варианты: контроль (не подвергнутый обработке УЗ); образец 1 – обработанный в дистиллированной воде; образец 2 – обработанный в молочной сыворотке (МС); образец 3 – обработанный в ферментированной МС. В результате исследований было установлено, что штамм бактерий рода L. acidophilus 7m13 проявляет наиболее высокую антагонистическую активность по отношению к использованным тест-культурам бактерий. Качественный и количественный состав поверхностной микрофлоры опытных образцов непостоянен; менее чувствительны к обработке УЗ кокковые формы по сравнению с палочками и дрожжевыми клетками. Применение ферментированной МС при обработке УЗ позволяет получить наименьшую поверхностную обсемененность.
Мясные полуфабрикаты, микробиологическая стабильность, обработка ультразвуком, молочнокислые бактерии, антагонистическая активность
Короткий адрес: https://sciup.org/140229858
IDR: 140229858 | DOI: 10.20914/2310-1202-2017-3-19-25
Текст научной статьи Исследование влияния ультразвуковой обработки в жидких средах различного состава на поверхностную микрофлору мясных полуфабрикатов
Обеспечение микробиологической стабильности мяса и мясопродуктов на всех стадиях технологического процесса производства и реализации является важной задачей для производителей. Решение этой задачи связано с подавлением развития устойчивой к физическим и химическим факторам посторонней микрофлоры [1, 2].
Для предотвращения микробиологической порчи мясо и мясные продукты подвергают различным видам обработки, основным из которых является действие температур – низких (охлаждение, замораживание) или высоких (пастеризация, стерилизация). Однако, эти методы обеспечивают либо замедление микробиологических процессов, но не стерилизацию продукта, либо снижают его пищевую и биологическую ценность [1-3].
В этой связи особую актуальность приобретает изучение инновационных методов, гарантирующих потребителю безопасные и минимально обработанные продукты. Большим потенциалом в этом отношении обладает применение молочнокислых бактерий (МКБ) и обработка ультразвуком (УЗ) [3-13].
Антагонистическая активность МКБ против многих патогенных, условно-патогенных бактерий и микроорганизмов порчи пищевых продуктов обусловлена, в первую очередь, продуцированием молочной кислоты, снижающей рН среды до значений, неблагоприятных для многих групп микроорганизмов. Особый интерес представляет продуцирование некоторыми штаммами Lactobacillus acidophilus ( L. acidophilus )специфических полипептидов – бактериоцинов – различающихся по силе и спектру антибиотического действия, также рядом других свойств, что делает их перспективными для использования в пищевой промышленности. Результат антагонистического воздействия может проявляться в виде замедления или остановки роста тест-микроба, гибели и даже лизисе его клеток [4, 6-9, 14].
Широкое же применение УЗ в пищевых технологиях как нетеплового метода стерилизации и инактивации микроорганизмов связано, в первую очередь, с явлением кавитации, сопряженным с бактерицидным эффектом при достижении определенной пороговой интенсивности. Однако, ниже пороговой интенсивности не только не наступает разрушение жизнеспособных микроорганизмов, а наблюдается стимуляция роста их числа. [3, 5, 10-12].
Облучение УЗ приводит к нарушению механической целостности (разрыв клеточных стенок, мембран и других цитоплазматических структур) и внутренних процессов жизнедеятельности (изменение равновесной концентрации веществ вне и внутри клетки, инактивация ферментов и коагуляция белков) клеток микроорганизмов, что ведет к их гибели. При длительном воздействии УЗ нормальная жизнедеятельность клетки может не восстановиться даже по прошествии нескольких дней после прекращения воздействия УЗ [5, 10].
В связи с вышесказанным, целью настоящей работы явилось исследование влияния УЗ-обработки в различных жидких средах на поверхностную микрофлору мясных полуфабрикатов (МП).
Достижение указанной цели осуществлялось путем решения следующих задач:
-
• подбор штаммов МКБ, обладающих антагонистической активностью;
-
• подбор режима УЗ обработки МП;
-
• исследование качественного и количественного состава поверхностной микрофлоры до и после обработки, в процессе хранения МП;
-
• изучение влияния состава жидкой среды на поверхностную микрофлору МП.
-
1.1 Материалы и методы исследования
На первой стадии эксперимента провели отбор штаммов МКБ, обладающих антагонистической активностью. Антагонистические свойства оценивали в условиях in vitro методом лунок [14]. В работе были использованы штаммы бактерий рода L. acidophilus из коллекции лаборатории микробиологии СПб НИУ ИТМО: 5e, 7m13, H, H3, 42 .
В качестве тест-культур использовали культуры типичных для охлажденных МП микроорганизмов: Escherichia coli ( E. coli ), Pseudomonas fluorescens ( Ps. fluorescens ) и Proteus vulgaris ( P. vulgaris ) [1, 2]
Культуры ацидофильных палочек вносили в стерилизованную молочную сыворотку (МС) и термостатировали при 37 °С в течение суток. Суточные бульонные тест-культуры засевали газоном на слое агара (2,5 % МПА), после впитывания пробочным сверлом вырезали лунки диаметром 5 мм, в которые помещали по 2 капли МС с суточной культурой исследуемых штаммов L. acidophilus . Чашки Петри выдерживали в холодильнике в течение 1 ч, затем в термостате при температуре 37 ºС (чашку Петри с газоном Ps. fluorescens оставляли при комнатной температуре) в течение 24 ч и измеряли зону отсутствия роста тест-штаммов вокруг лунок в мм.
Далее провели подбор режима УЗ обработки с учетом явления кавитации, проявляющимся при распространении УЗ колебаний в жидкости.Кавитация – процесс образования и схлопывания в жидкой среде полостей, заполненных паром самой жидкости. Вследствие перепадов давления (попеременные сжатия и разряжения) наблюдаются локальные повышения температуры, нежелательные для натуральных МП (тепловая денатурация белков) [10].
Принимая во внимание объем емкости, в которой проводили обработку (500 мл), и температуру начала денатурации основного белка мышечной ткани миозина (40 ºС), установлены следующие параметры режима обработки: мощность 350 Вт (70 % от номинальной) с экспозицией 2 мин. Температура образцов мяса в процессе обработки лежала в пределах 37 ± 2 °С.
В качестве генератора УЗ применялся аппарат ультразвуковой технологический «Волна-М» УЗТА-1/22-ОРв ОМ с потребляемой мощностью до 1000 Вт и частотой 20000 Гц. Принцип его действия основан на использовании свойств УЗ колебаний высокой интенсивности в жидких и жидкодисперсных средах. Экспериментальная установка представлена на рисунке 1.

Рисунок 1. Экспериментальная установка для обработки УЗ
Figure 1. Experimental installation for ultrasonic treatment
На третьей стадии эксперимента изучали влияние УЗ обработки в жидких средах различного состава на поверхностную микрофлору МП. В качестве объекта исследований был выбран гуляш свиной – это мелкокусковой МП, представляющий собой кусочки мякоти массой 20-40 г с массовой долей жира до 20 %.
Для установления влияния УЗ обработки на поверхностную микрофлору МП подсчитывали число клеток микроорганизмов на 1 см2 в фиксированных окрашенных препаратах-отпечатках в 10 полях зрения до обработки и после 2 и 6 суток хранения при температуре 4 ± 2 °С. Образцы изучали с использованием оптического микроскопа «Биомед 6ПР3», оснащенного цифровой окуляр-камерой при суммарном увеличении окуляра и объектива х1000.
Обработку образцов мяса УЗ проводили в следующих жидких средах:
-
• контроль (не подвергнутый обработке УЗ);
-
• образец 1 – дистиллированная вода (рН = 6,59);
-
• образец 2 – стерилизованная МС (рН = 5,08);
-
• образец 3 – ферментированная стерилизованная МС (рН = 4,76).
-
1.2 Полученные результаты и их обсуждение
Результаты определения антагонистической активности штаммов L. acidophilus представлены в таблице 1.
Из полученных данных следует, что использованные штаммы бактерий рода L. acidophilus обладают схожей антагонистической активностью в отношении исследуемых санитарно-значимых микроорганизмов.
Высокая ингибирующая активность у всех штаммов ацидофильной палочки проявилась в отношении тест-культуры E. coli. При этом максимальная зона подавления соответствует штамму 7m13 – 18 мм, а минимальная зона штамму 5e – 11 мм.
Таблица 1.
Антагонистическая активность штаммов L. acidophilus по отношению к типичным для охлажденных МП микроорганизмам
Table 1.
Antagonistic activity of bacteria strains of L. acidophilus in relation to typical microflora representatives of chilled meat semi-finished products
|
Тест-культуры Test strains |
Размер зон ингибирования, мм Inhibition zone, mm |
||||
|
5e |
7m13 |
H |
H3 |
42 |
|
|
E. coli |
11 |
18 |
17 |
14 |
15 |
|
Ps. fluorescens |
13 |
16 |
10 |
13 |
12 |
|
P. vulgaris |
9 |
13 |
8 |
11 |
12 |
Низкая эффективность штаммов ацидофильной палочки проявилась в отношении P. vulgaris . Так, максимальная зона ингибирования соответствует штамму 7m13 – 13 мм, а минимальная зона штамму H – 8 мм.
Наименьшей антагонистической активностью обладал штамм 5e, проявивший самую низкую активность из всех штаммов в отношении E. coli и P. vulgaris с размером зон ингибирования 11 и 9 мм соответственно. В отношении же Ps. fluorescens им проявлена средняя активность по сравнению с остальными штаммами, о чем свидетельствует размер зоны угнетения – 13 мм.
Наибольшую антагонистическую активность проявил штамм 7m13 с размером зон ингибирования в отношении E. coli – 18 мм, Ps. fluorescens – 16 мм и P. vulgaris – 13 мм. В связи с полученными результатами этот штамм был выбран нами для ферментирования МС и применения в дальнейших исследованиях.
Результаты изучения влияния УЗ обработки в жидких средах различного состава на поверхностную микрофлору МП представлены на рисунке 2.
Числомикробныхклеток/см2, 103
The number of bacterial cells/sm2, 103
1,4
1,2
0,8
0,6
0,4
0,2
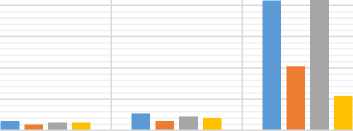
до обработки (before через 2 суток через 6 суток the treatment) хранения (after 2 хранения (after 6
days of storage) days of storage)
-
■ Контроль (control) ■ Образец 1 (sample 1) ■ Образец 2 (sample 2) ■ Образец 3 (sample 3)
Рисунок 2. Динамика численности микроорганизмов
-
Figure 2. Dynamics of microbial growth during storage
Основываясь на данных, приведенных на рисунке 2, следует отметить, что в течение первых 2 суток хранения число клеток микроорганизмов увеличилось незначительно для всех опытных образцов: контроль – число клеток увеличилось на 0,05*103, образец 1 – на 0,02*103, образец 2 – на 0,04*103, образец 3 – на 0,03*103. Очевидно, что такая задержка роста объясняется адаптацией микроорганизмов к новым условиям среды и проявлением бактерицидного эффекта обработки УЗ.
После 6 суток хранения наименьшей поверхностной обсемененностью обладал образец 3, обработанный УЗ в ферментированной штаммом L. acidophilus МС, наибольшей – образец 2, обработанный в чистой МС. Численность клеток микроорганизмов на 1 см2 составила 0,22*103 и 1,38*103 соответственно.
Низкую бактериальную обсемененность образца 3 можно объяснить проявлением синергетического эффекта за счет совместного применения штамма 7m13 ацидофильной палочки, синтезирующей различные антимикробные вещества, и УЗ, инактивировавшего микроорганизмы.
Значительное число клеток микроорганизмов на поверхности образца 2 объясняется наличием благоприятных условий за счет обработки в МС, являющейся хорошей питательной средой для развития посторонней микрофлоры (по сравнению с обработкой в воде) с более высоким значением рН (по сравнению с ферментированной МС).
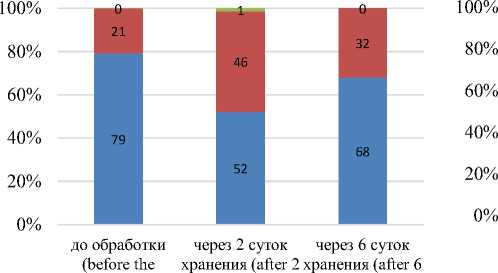
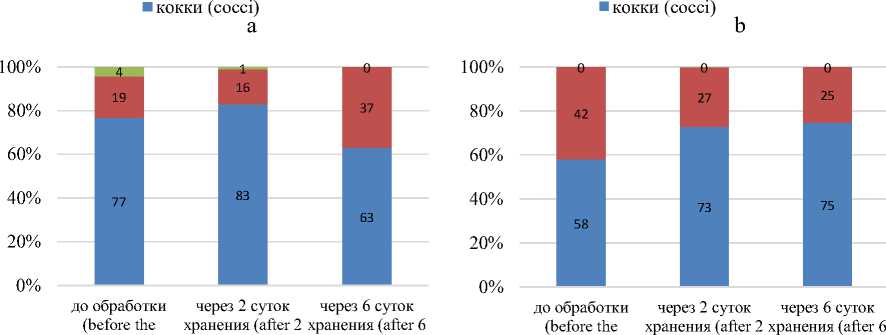
Учет микроорганизмов проводили раздельно, т.е. отдельно считали количество клеток кокков, палочек и дрожжей. Это позволило охарактеризовать микрофлору образцов также и с качественной стороны. Результаты подсчета представлены на рисунках 3 и 4.
Согласно приведенным на рисунке 3 данным поверхностная микрофлора МП во время хранения непостоянна: количественное соотношение всех групп микроорганизмов для всех опытных образцов менялось во времени. Преобладающей группой микроорганизмов на протяжении всего срока хранения являются кокковые формы, дрожжи и грамотрицательные палочки более чувствительны к воздействию УЗ. Так, через 6 суток хранения шаровидные формы составляют в контроле – 68 %, в образце 2 – 63 %, в образце 3 – 75 % от общего числа микробных клеток. Для образца 1 характерно незначительное преобладание палочек над кокками (52% к 48 %), что связано с меньшим содержанием необходимых питательных веществ в жидких средах при обработке (вода и МС).
Также, характерным для всех образцов является полное отсутствие дрожжевых клеток по окончании хранения несмотря на их присутствие после 2 суток хранения. Исключение составляет образец 3, обработанный в ферментированной МС, в составе поверхностной микрофлоры которого не было отмечено дрожжевых клеток ни до обработки, ни после 2 суток хранения.
до обработки (before the treatment)
treatment) days of storage) days of storage)
через 2 суток через 6 суток хранения (after 2 хранения (after 6 days of storage) days of storage)
■ дрожжи (yeast) ■ дрожжи (yeast)
■ палочки (rod-shaped bacteria) ■ палочки (rod-shaped bacteria)
treatment) days of storage) days of storage) treatment) days of storage) days of storage)
дрожжи (yeast)
палочки (rod-shaped bacteria) кокки (cocci)
■ дрожжи (yeast)
■ палочки (rod-shaped bacteria)
■ кокки (cocci)
c
d
Рисунок 3. Качественная и количественная характеристика поверхностной микрофлоры опытных образцов: a – контроль; b – образец 1; c – образец 2; d – образец 3
-
Figure 3. The quantitative and qualitative composition of the surface microflora of the check samples:a – control; b – sample 1; c – sample 2; d – sample 3
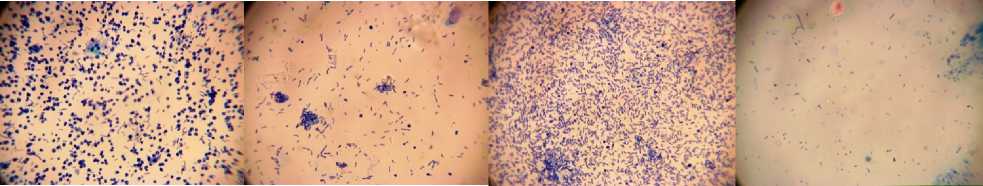
Приведенные на рисунке 4 микроскопические фотографии наглядно демонстрируют неоднородность поверхностной микрофлоры опытных образцов МП после 6 суток хранения.
Такая неоднородность связана, во-первых, с различием состава жидких сред, в которых проводилась обработка УЗ, и, во-вторых, с различной устойчивостью бактерий к действию УЗ.
a
b
c
d
Рисунок 4. Микроскопические фотографии фиксированных окрашенных препаратов-отпечатков поверхности экспериментальных образцов после 6 суток хранения:a – контроль; b – образец 1; c – образец 2; d – образец 3
Figure 4. Microscope photos of heat-fixed and stainedtouch smearsof surfaceof the check samples after 6 days of storage: a – control; b – sample 1; c – sample 2; d – sample 3
Выводы
Анализируя результаты исследований можно заключить следующее:
-
• в ходе проведенных исследований был отобран штамм бактерий рода L. acidophilus 7m13 , проявивший лучшую антагонистическую активность по отношению к использованным тест-культурам бактерий;
-
• установлены следующие параметры режима УЗ-обработки: мощность 350 Вт с экспозицией 2 мин, что не приводит к денатураци-онным изменениям белков мышечной ткани;
Список литературы Исследование влияния ультразвуковой обработки в жидких средах различного состава на поверхностную микрофлору мясных полуфабрикатов
- Мудрецова-Висс К.А., Дедюхина В.П., Масленникова Е.В. Основы микробиологии. Москва: ИНФРА-М, 2014. 354 с.
- Моисеева Е. Л. Микробиология мясных и молочных продуктов при холодильном хранении. Москва: Агропромиздат, 1988. 222 с.
- Awad T. S., Moharram H. A., Shaltout O. E., Asker D. et al. Applications of ultrasound in analysis, processing and quality control of food:a review//Food Research International. 2012. V. 48. P. 410-427. URL: https://www.researchgate.net/publication/234095122.
- Iulietto M. F., Sechi P., Borgogni E., Cenci-Goga B. T. Meat spoilage: a critical review of a neglected alteration due to ropy slime producing bacteria//ItalianJournalofAnimalScience. 2015. V. 284. P. 316-326. URL: http://www.tandfonline.com/loi/tjas20.
- Антушева Т.И. Некоторые особенности влияния ультразвука на микроорганизмы//Живые и биокосные системы. 2013. № 4. URL: http://www.jbks.ru/archive/issue-4/article-11.
- Егоров Н. С. Основы учения об антибиотиках. Москва: Изд-во МГУНаука, 2004. 528 с.
- Иркитова А. Н., Каган Я. Р., Сергеева И.Я. Свойства, экологические аспекты и практическое значение ацидофильной палочки. 3. Антагонистическая активность//Актуальные проблемы техники и технологии переработки молока: сб. науч. трудов с международным участием. 2011. Вып. 8. С. 216-222. URL: http://pandia.ru/text/78/006/86066.php.
- Китаевская С. В., Пономарев В. Я. Роль молочнокислых бактерий в обеспечении биобезопасности ферментированных мясопродуктов//Вестник казанского технологического университета. 2014. № 21 (17). С. 248-250.URL: https://elibrary.ru/download/elibrary_22528814_61123177.pdf.
- Соловьева И. В.,Точилина А. Г., Белова И.В., Новикова Н. А и др. Биологические свойства лактобацилл. Перспективы использования в лабораториях Роспотребнадзора экспресс-методов амплификации нуклеиновых кислот (МАНК) при контроле качества пищевых продуктов, БАД к пище, лекарственных форм, содержащих лактобациллы//Журнал МедиАль. 2014. №2 (12). С. 29-44.URL: http://cyberleninka.ru/article/n/biologicheskie-svoystva-laktobatsill-perspektivy-ispolzovaniya-v-laboratoriyah-rospotrebnadzora-ekspress-metodov-amplifikatsii.
- Хмелев В. Н. и др. Применение ультразвука высокой интенсивности в промышленности. Бийск, 2010. 203 c.
- ?nver A. Applications of ultrasound in food processing//Green Chemistry & Technology Letters. 2016. V 2. № 3. P. 121-126. URL: http://www.giapjournals.com/index.php/gctl/article/view/333.
- Dolatowski Z. J., Stadnik J., Stasiak D. M. Applications of ultrasound in food technology.ActaSci.Pol. Technol. Aliment. 2007. № 6(3). P. 88-99. URL: http://www.food.actapol.net/pub/8_3_2007.pdf.
- Ercan S., Soysal ?. Use of ultrasound in food preservation. NaturalScience. 2013. № 5. P. 5-13.URL: http://file.scirp.org/pdf/NS_2013081414335165.pdf.
- Иркитова А. Н., Каган Я. Р., Соколова Г. Г. Сравнительный анализ методов определения антагонистической активности молочнокислых бактерий//Известия АлтГУ.2012. №3-1. С. 41-44. URL: http://cyberleninka.ru/article/n/sravnitelnyy-analiz-metodov-opredeleniya-antagonisticheskoy-aktivnosti-molochnokislyh-bakteriy.


