Исследование воздействия хлорида кадмия на некоторые маркерные ферменты печени экспериментальных животных
Автор: Смолянкин Д.А., Валова Я.В., Каримов Д.О., Байгильдин С.С., Фазлыева А.С., Каримов Д.Д., Хуснутдинова Н.Ю., Репина Э.Ф., Ахмадеев А.Р., Гизатуллина А.А.
Журнал: Juvenis scientia @jscientia
Рубрика: Оригинальные исследования
Статья в выпуске: 6 т.9, 2023 года.
Бесплатный доступ
Введение. Кадмий (Cd) - один из наиболее мощных и опасных поллютантов. Воздействие Cd связано с полиорганным повреждением как у животных, так и у человека. Механизм токсичности Cd заключается в нарушении антиоксидантной системы (АОС) организма, что приводит к трансформации функциональной целостности печени. Степень повреждения органа-мишени может быть исследована путём измерения концентрации ключевых индикаторных показателей гепатоцеллюлярной травмы. Цель работы - оценить изменения активности ферментов-маркеров гепатотоксичности в сыворотке крови лабораторных животных после перорального воздействия водного раствора хлорида кадмия (CdCl2) в условиях субхронической модели эксперимента с периодом ремиссии.
Тяжёлые металлы, кадмий, печень, биохимические исследования, экспериментальные животные
Короткий адрес: https://sciup.org/14129341
IDR: 14129341 | DOI: 10.32415/jscientia_2023_9_6_30-41
Текст научной статьи Исследование воздействия хлорида кадмия на некоторые маркерные ферменты печени экспериментальных животных
В связи с быстрым ростом численности населения планеты антропогенное загрязнение окружающей среды тяжёлыми металлами является ключевым фактором в формировании большинства экологических проблем [1–3]. Наряду с пестицидами, ядохимикатами, фармацевтическими препаратами и новыми химическими веществами тяжёлые металлы при трансформации в биосфере создают постоянно нарастающий «химический прессинг» [4, 5]. В последние годы тяжёлые металлы относят к приоритетным экотоксикантам, так как их присутствие выявлено в составе практически всех природных сред. Кроме того, тяжёлые металлы включаются в пищевые цепи и депонируются в организме животных и человека, даже в незначительных количествах оказывая влияние на процессы жизнедеятельности биологических систем. В основе токсического действия тяжёлых металлов на живой организм лежит повреждение клеток и их органелл, сопровождающееся функциональными, либо структурно-функциональными изменениями [6].
Кадмий (Cd) является одним из наиболее мощных и опасных тяжёлых металлов. Производство, потребление и выбросы кадмия в атмосферу, наземную и водную среду постоянно увеличиваются ввиду его широкого применения в различных антропогенных и промышленных видах деятельности [7, 8]. Cd не выводится из организма и не разлагается; оказывает выраженное кумулятивное действие на ткани по причине длительного биологического периода полураспада (20 лет) [9, 10]. Воздействие Cd связано с полиорганным повреждением, прежде всего, поражением печени, почек, головного мозга, лёгких, сердца, костного мозга, как у животных, так и у человека [11].
Печень играет важную роль в сохранении гомеостатического равновесия в живых организмах [12]. Ведущую роль гепатоцитов в регуляции состава внутри- и внеклеточных жидкостей, активности и направленности метаболических процессов определяет тот факт, что печень является основным органом депонирования токсических элементов. Поэтому кадмий, попадая в биосистемы, накапливается в органе-мишени, инициируя изме- нение морфофункционального состояния клеток печени [13, 14]. Моделирование повреждений печени является важным направлением токсикологии в диагностическом, терапевтическом и других аспектах, поскольку позволяет оценить глубину повреждения органа-мишени и открывает возможности для разработки критериев ранней диагностики гепатопатологических состояний.
Один из механизмов токсичности Cd заключается в нарушении антиоксидантной системы организма, что способствует окислительному стрессу и перекисному окислению липидов, приводящим к изменению биохимических функций печени [15–17]. Предполагается, что кадмий обладает способностью связываться с SH-группами белковых молекул и таким образом ингибировать каталитическую активность ключевых ферментных систем, влияя на многие процессы, протекающие в живом организме. Кроме того, кадмий может замещать многие минеральные элементы (кальций, цинк, железо и т.д.) в составе большинства энзимов, что отражается на химических свойствах и метаболизме, а также взаимодействовать с компонентами клеточных мембран, нарушая структуру. Повреждающее воздействие кадмия приводит к формированию существенных отклонений от нормы в составе крови живых систем [18].
Изменение активности ряда ферментов считается высокочувствительным индикатором отдельных заболеваний, поражений органов и тканей [19]. В частности, по мнению ряда исследователей, критерии диагностики заболеваний печени токсической природы должны основываться на изучении ранних биохимических, функциональных сдвигов, предшествующих выявлению отчётливых клинических симптомов [20–22]. Маркеры гепатотоксичности позволяют оценить степень влияния хронической интоксикации кадмием и сделать вывод о функциональной целостности печени [23– 25]. Так аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) являются чувствительными индикаторами повреждения гепатоцитов, вызванного токсикантами. Лактатдегидрогеназа (ЛДГ) представляет собой фермент, играющий важную роль в общем метаболизме организма и оказывающий существенное влияние на окис- лительно-восстановительный потенциал клетки [26]. Изменение активности щелочной фосфатазы (ЩФ), показателя холестаза, указывает на мембраноповреждающий эффект гепатотоксиканта. При воздействии кадмия на орган-мишень в результате нарушения метаболических процессов на уровне клетки и субклеточных структур происходит изменение целостности гепатоцитов, в результате чего отмечается выброс данных энзимов в межклеточное пространство [27, 28].
Выбор продолжительности эксперимента при рассмотрении токсических свойств анализируемого вещества определяется задачами исследования. Как правило, токсикологический потенциал химических веществ изучается в следующей последовательности: острый эксперимент → подострый эксперимент → субхронический эксперимент → хронический эксперимент.
Исследования воздействия токсичных металлов на организм в отделе токсикологии и генетики с экспериментальной клиникой лабораторных животных ФБУН «Уфимский НИИ медицины труда и экологии человека» проводятся в течение нескольких лет. Ранее, в ходе экспериментов острого и подострого характера по изучению токсического влияния хлорида кадмия на живые системы, нами были установлены безвредные, токсические, летальные дозы вещества; определены допустимые условия воздействия, оптимальные суточные дозы для проведения субхронических и хронических исследований.
В научной литературе, в большинстве случаев, отражены данные о биохимических показателях в отношении линейных животных в зависимости от линий, возраста, пола, свободы от патогенной флоры и др., в то время как у беспородных такого рода сведения носят ограниченный характер. Кроме того, недостаточно изучены процессы восстановления функциональной целостности органов-мишеней после прекращения поступления кадмия в организм (так называемая стадия ремиссии) с многообразными адаптивными механизмами живых систем.
В связи с вышеизложенным основная цель настоящей работы заключалась в оценке изменений активности ферментов-маркеров гепатотоксично- сти, в частности, АСТ, АЛТ, ЛДГ и ЩФ в сыворотке крови лабораторных животных после перорального воздействия водного раствора хлорида кадмия (CdCl2) в условиях субхронической модели эксперимента с периодом ремиссии.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на 40 белых аутбред-ных крысах со средней массой тела 200 г. Животные содержались в стандартных условиях экспериментальной клиники лабораторных животных ФБУН «Уфимский НИИ медицины труда и экологии человека», характеризующихся постоянством комнатной температуры (20–25 °C) и уровня влажности (30–70%), с 12-часовым искусственным освещением (с 08:00 до 20:00). В начале эксперимента животные методом случайной выборки были разделены на 4 группы по 10 особей (5 самцов и 5 самок) в каждой: контрольная группа (К) и 3 экспериментальные группы. Для оценки токсического действия поллютанта животным экспериментальных групп 1–3 ежедневно в течение 3 месяцев перорально вводили водный раствор хлорида кадмия. Условия содержания и кормления были одинаковы для всех групп животных. Дизайн исследования представлен в таблице 1.
Дизайн исследования
Таблица 1
|
Группа |
Контрольное вещество, токсикант |
Доза вводимого вещества, мкг/кг |
|
Контроль |
Дистиллированная вода |
Эквиобъемно |
|
1 |
CdCl2 |
1 |
|
2 |
CdCl2 |
10 |
|
3 |
CdCl2 |
100 |
По окончании введения токсиканта животные проходили стадию ремиссии в течении 1 месяца. В данный период крысы имели свободный доступ к корму и питьевой воде в течение суток, пероральные манипуляции были прекращены. Далее
Методы определения биохимических показателей в эксперименте
Таблица 2
|
№ |
Биохимический показатель |
Метод определения |
|
1 |
АСТ |
Кинетический УФ без пиридоксальфосфата (IFCC) |
|
2 |
АЛТ |
Кинетический УФ без пиридоксальфосфата (IFCC) |
|
3 |
ЛДГ |
Кинетический УФ |
|
4 |
ЩФ |
Кинетический (DGKC) |
Изменения биохимических показателей у экспериментальных животных в зависимости от дозы воздействия хлорида кадмия
Таблица 3
|
Показатели |
Группа животных |
|||
|
Контроль |
1 |
2 |
3 |
|
|
АСТ, Ед/л |
154,75 [119,38; 173,4] |
225,7 [179,78; 288,1]* |
186 [160,25; 221,45] |
170,3 [134,23; 227,2] |
|
АЛТ, Ед/л |
51,05 [42,6; 58,18] |
56,05 [52,4; 69,68] |
60,3 [46,15; 64,3] |
48,5 [44,9; 52,95] |
|
ЛДГ, Ед/л |
1470 [1268,5; 1746] |
1603 [1531,5; 1636,25] |
1507,5 [1224,5; 1556,75] |
1559 [1095,5; 1798,5] |
|
ЩФ, Ед/л |
216,7 [151,75; 243,25] |
163,2 [153,4; 199,38] |
135,45 [122,1; 192,5] |
96,6 [59,55; 141,75]* |
Примечание: * — статистически значимая разница между животными группы К- и 1, 2, 3; р<0,05
животные выводились из эксперимента с помощью углекислого газа, после чего производился забор образцов крови для биохимических исследований. Оценивали функциональное состояние печени, что включало определение активности в сыворотке крови АСТ, АЛТ, ЛДГ, ЩФ.
Все манипуляции осуществляли, соблюдая правила, изложенные в «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Strasbourg, 1986).
Уровни биохимических показателей были проанализированы с помощью наборов реагентов «Вектор-Бест» (г. Новосибирск, Россия) (таблица 2) на анализаторе «Stat Fax 3300» («Awareness Technology», США) в соответствии с инструкциями производителя.
Статистический анализ осуществляли с использованием программного обеспечения IBM SPSS
Statistics 21 (IBM, США). Анализ экспериментальных данных проводили с помощью H-критерия Краскала–Уоллиса для попарного сравнения групп. Результаты выражали в виде Me [Q1; Q3], где Me — медиана, Q1–1-й квартиль, Q3–3-й квартиль. Критический уровень значимости (p) принят равным 0,05.
РЕЗУЛЬТАТЫ
Результаты проведённых биохимических исследований представлены в таблице 3.
Уровень активности АСТ в сыворотке крови лабораторных крыс между группами статистически значимо отличался (H=11,18; р=0,011) (рис. 1). При пероральном введении хлорида кадмия в экспериментальной группе 1 наблюдалось увеличение активности фермента на 45,9% относительно контроля (р=0,006). В группах 2 и 3 было отмечено повышение активности трансаминазы на 20,2% и 10,1%, соответственно.
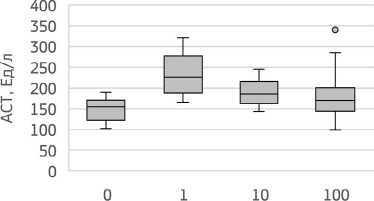
Доза CdCl2, мкг/кг
Рисунок 1. Изменение активности АСТ в зависимости от дозы воздействия хлорида кадмия в условиях субхронической модели эксперимента с периодом ремиссии
Идентичное явление представляло собой повышение концентрации АЛТ в опытных группах животных 1 и 2 — на 9,8% и 18,1%, соответственно, относительно отрицательного контроля. Однако, эти изменения не достигали уровня статистической значимости (H=6,36; р=0,095). В то же время, в группе 3 было выявлено некоторое понижение содержания фермента, а именно на 5,0% (рис. 2).
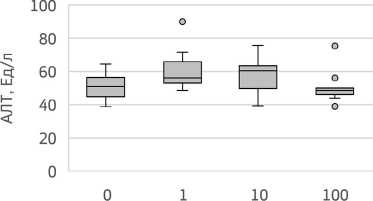
Доза CdCl2, мкг/кг
Рисунок 2. Изменение активности АЛТ в зависимости от дозы воздействия хлорида кадмия в условиях субхронической модели эксперимента с периодом ремиссии
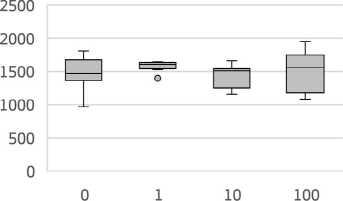
В настоящем исследовании определялось увеличение активности ЛДГ на 9,1% в группе 1, на 2,6% и 6,1% в группах 2 и 3, соответственно, относительного контрольной группы (рис. 3).
При анализе медианных значений активности ЩФ в экспериментальных группах установлены различия, статистически значимые по сравнению
Доза CdCl2, мкг/кг
Рисунок 3. Изменение активности ЛДГ в зависимости от дозы воздействия хлорида кадмия в условиях субхронической модели эксперимента с периодом ремиссии с контролем (H=15,55; р=0,001) (рис. 4). Выявлено дозозависимое уменьшение уровня активности ЩФ в группах животных 1, 2 и 3 относительно контроля, на 24,7%, 37,5% и 55,4% (р=0,002), соответственно.
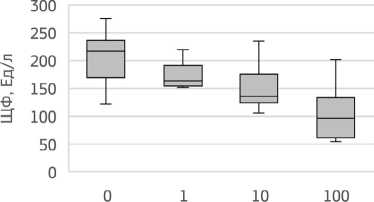
Доза CdCl2, мкг/кг
Рисунок 4. Изменение активности ЩФ в зависимости от дозы воздействия хлорида кадмия в условиях субхронической модели эксперимента с периодом ремиссии
ОБСУЖДЕНИЕ
Характерно, что для оценки степени нарушения функционально-метаболического статуса органов-мишеней при интоксикации тяжёлыми металлами экспериментальных животных традиционно регистрируются изменения активности ключевых ферментов-маркеров. Так, при диагностике патологии печени наиболее часто определяют уровень аминотрансфераз. Данные каталитические белки характеризуются специфическим распределением в клетке: АСТ сосредоточена в основном в митохондриях, а АЛТ — в цитоплазме [29, 30].
Согласно полученным данным, можно предположить, что при субхроническом воздействии CdCl2 на экспериментальных животных происходит разрушение клеточных мембран гепатоцитов, в том числе уже при низкой дозе токсиканта (1 мкг/кг). В то же время, благодаря высокой реакционной способности, тяжёлые металлы способны ингибировать ферментативную активность, вызывая нарушения биосинтетических процессов [31]. Результаты согласуются с ранее опубликованными выводами [32, 33].
ЛДГ является цинксодержащим ферментом и отражает степень выраженности внутритканевой гипоксии [34]. На наш взгляд, индуцированный ионами Cd2+ рост концентрации лактатдегидрогеназы в крови экспериментальных животных свидетельствует о повышении доли бескислородного гликолиза. Известно, что данный процесс сопровождается увеличением концентрации продуктов гликолитических реакций — молочной и пировиноградной кислоты, а также развитием некомпенсированного метаболического ацидоза.
В совокупности с тенденцией к повышению активности аминотрансфераз и ЛДГ снижение концентрации ЩФ в группах крыс, подвергшихся пероральному воздействию хлорида кадмия, может указывать на повреждение печени, нарушение секреторной функции органа-мишени и свидетельствовать о патологических процессах в гепатоцитах.
Существует общее мнение, что окислительный стресс, воспаление и апоптоз играют решающую роль в патогенезе кадмий-индуцированной гепатотоксичности [35]. Негативное действие кадмия заключается в окислительном повреждении клеточных органелл за счёт выработки активных форм кислорода (АФК), таких как пероксиды и гидрок-сид-ионы. В то же время окислительный стресс при внутриклеточном накоплении тяжёлого металла приводит к формированию гепатоцеллюлярной травмы, включающей вытеснение активных окислительно-восстановительных металлов, истощение окислительно-восстановительных поглотителей, ингибирование антиоксидантных ферментов и цепи переноса электронов, а также поврежде- ние митохондрий [36]. Помимо этого, токсическое действие ионов Cd2+, с высоким сродством к цистеину, обусловлено их связыванием с биологическими молекулами, имеющими в составе тиоловые группы, такими как металлотионеины и восстановленный глутатион [37, 38]. Данные негативные изменения способствуют нарушению структуры фосфолипидов биологических мембран и приводят к повреждениям белков и ДНК. Далее, на фоне нарушения баланса процессов репарации АФК-опосредованный стресс индуцирует апоптоз или некроз поражённых клеток печени [39].
ЗАКЛЮЧЕНИЕ
Таким образом, кадмий является высокотоксичным тяжёлым металлом, который может вызывать значительные изменения в биохимических параметрах крови, так как способен генерировать свободные радикалы с достаточно высокой скоростью, чтобы подавлять естественную систему антиоксидантной защиты организма. В ходе нашего исследования показано, что в условиях субхронической модели эксперимента с периодом ремиссии кадмий, обладая выраженным гепатотоксическим действием, индуцирует повреждение печени. Установлено, что пероральное введение лабораторным животным водного раствора CdCl2 даже при минимальной дозе (1 мкг/кг) сопряжено с изменением проницаемости клеточных мембран гепатоцитов и нарушением биосинтетических процессов в печени, что проявляется значительным повышением активности АСТ, АЛТ, ЛДГ и дозозависимым снижением ЩФ в сыворотке крови. Полученные в настоящей работе результаты расширяют традиционные представления о различных механизмах действия тяжёлых металлов на биоэнергетический метаболизм клеток органов-мишеней.
Финансирование: Работа проведена за счёт средств субсидии на выполнение государственного задания в рамках отраслевой научноисследовательской программы Роспотребнадзора на 2021–2025 гг. «Научное обоснование национальной системы обеспечения санитарноэпидемиологического благополучия, управления рисками здоровью и повышения качества жизни населения России», п. 6.1.9 «Экспериментальное обоснование высокочувствительных маркеров воздействия токсичных металлов на организм и разработка мер профилактики», регистрационный номер: 121062100057–1.
Соответствие принципам этики. Согласно выписке из протокола заседания биоэтической комиссии ФБУН «Уфимский НИИ медицины труда и экологии человека», от 03.04.2023 № 01–04, проведённые исследования выполнены в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS N 123), директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22.09.2010 г. о защите животных, использующихся для научных целей, и могут быть опубликованы.
Список литературы Исследование воздействия хлорида кадмия на некоторые маркерные ферменты печени экспериментальных животных
- Брин В.Б., Митциев А.К., Митциев К.Г. Способ коррекции нефротоксического действия кадмия в эксперименте // Вестник новых медицинских технологий. 2011. Т. 18. № 2. С. 194-195. [Brin VB, Mittsiev AK, Mittsiev KG. A method for correcting the nephrotoxic effect of cadmium in an experiment. Bulletin of new medical technologies. 2011;18(2):194-195. (in Russ.)]. EDN: OCYHQL
- Almeer RS, Alarifi S, Alkahtani S, et al. The potential hepatoprotective effect of royal jelly against cadmium chloride-induced hepatotoxicity in mice is mediated by suppression of oxidative stress and upregulation of Nrf2 expression. Biomed Pharmacother. 2018;106(2):1490-1498. DOI: 10.1016/j.biopha.2018.07.089
- Baskaran R, Priya LB, Sathish Kumar V, Padma VV. Tinospora cordifolia extract prevents cadmium-induced oxidative stress and hepatotoxicity in experimental rats. J Ayurveda Integr Med. 2018;9(4):252-257. DOI: 10.1016/j.jaim.2017.07.005
- Пухаева Е.Г., Скупневский С.В., Руруа Ф.К., и др. Антимутагенный эффект имунофана при сочетанном воздействии ионов Cd (II), Pb (II) и антибиотика цефтриаксона // Экология человека. 2019. Т. 1. № 7. С. 49-58. [Pukhaeva EG, Skupnevsky SV, Rurua FK, et al. Antimutagenic effect of imunofan under the combined effect of Cd (II), Pb (II) ions and the antibiotic ceftriaxone. Human Ecology. 2019;1(7):49-58. (in Russ)]. DOI: 10.33396/1728-0869-2019-7-49-58. EDN: NBKLSP
- Скупневский С.В., Чопикашвили Л.В., Пухаева Е.Г., и др. Изучение прооксидантных свойств цианидных комплексов цинка (II) в эксперименте // Владикавказский медико-биологический вестник. 2015. Т. 21. № 32. С. 23-27. [Skupnevsky SV, Chopikashvili LV, Pukhaeva EG, et al. Experimental study of the prooxidant properties of zinc (II) cyanide complexes. Vladikavkaz Medical Biological Bulletin. 2015;21(32):23-27. (in Russ)]. DOI: 10.12737/18434 EDN: VRXXQJ
- Ochilov KR. Studying The Effect Of Heavy Metal Salts On Biochemical Processes Of Rat Liver Mitochondria. Journal of Pharmaceutical Negative Results. 2022;1(2):1637-1640. DOI: 10.47750/pnr.2022.13.S07.230
- Gong ZG, Wang XY, Wang JH, et al. Trehalose prevents cadmium-induced hepatotoxicity by blocking Nrf2 pathway, restoring autophagy and inhibiting apoptosis. J Inorg Biochem. 2019;192:62-71. DOI: 10.1016/j.jinorgbio.2018.12.008
- Liu X, Tian G, Jiang D, et al. Cadmium (Cd) distribution and contamination in Chinese paddy soils on national scale. Environmental science and pollution research. 2016;23(1):17941-17952. DOI: 10.1007/s11356-016-6968-7
- Wang X, Wang T, Pan T, et al. Senna alexandrina extract supplementation reverses hepatic oxidative, inflammatory, and apoptotic effects of cadmium chloride administration in rats. Environmental Science and Pollution Research. 2020;27(1):5981-5992. DOI: 10.1007/s11356-019-07117-3
- Elkhadragy MF, Kassab RB, Metwally D, et al. Protective effects of Fragaria ananassa methanolic extract in a rat model of cadmium chloride-induced neurotoxicity. Biosci Rep. 2018;38(6):BSR20180861. DOI: 10.1042/BSR20180861
- Soliman HS, Korany EM, El-Sayed EK, et al. Nephroprotective effect of Physalis peruviana L. calyx extract and its butanolic fraction against cadmium chloride toxicity in rats and molecular docking of isolated compounds. BMC Complementary Medicine and Therapies. 2023;23(1):21. DOI: 10.1186/s12906-023-03845-9
- Unsal V, Dalkıran T, Çiçek M, et al. The Role of Natural Antioxidants Against Reactive Oxygen Species Produced by Cadmium Toxicity: A Review. Adv Pharm Bull. 2020;10(2):184-202. DOI: 10.34172/apb.2020.023
- Ткаченко Е.А., Дерхо М.А. Влияние кадмия на белковый спектр крови организма лабораторных мышей // АПК России. 2015. Т. 72. № 2. С. 167-170. [Tkachenko EA, Derkho MA. Influence of cadmium on the protein spectrum of the blood of the body of laboratory mice. APK of Russia. 2015;72(2):167-170. (in Russ.)]. EDN: TYHYZF
- Ткаченко Е.А., Дерхо М.А. Оценка антитоксического действия альфа-токоферола и наночастиц серебра при кадмиевом токсикозе // Известия Оренбургского государственного аграрного университета. 2016. Т. 58. № 2. С. 182-185. [Tkachenko EA, Derkho MA. Evaluation of the antitoxic effect of alpha-tocopherol and silver nanoparticles in cadmium toxicosis. Proceedings of the Orenburg State Agrarian University. 2016;58(2):182-185. (in Russ.)].
- Anadozie SO, Adewale OB, Akawa OB, et al. Protective effect of aqueous fruit extract of Mondia whitei against cadmium-induced hepatotoxicity in rats. Journal of Herbmed Pharmacology. 2023;12(1):159-167. DOI: 10.34172/jhp.2023.16
- Ramadan OI, Amr IMI, Mahmoud ME, et al. Effect of Selenium and Olive Oilon Hepatotoxicity Induced by Cadmium chloride in Adult Male Albino Rats (Structural, Biochemical and Immunohistochemical Study). Annals of the Romanian Society for Cell Biology. 2019;23(2):128-141.
- Mallya R, Chatterjee PK, Vinodini NA, et al. Moringa oleifera leafextract: Beneficial effects on cadmium induced toxicities-A review. Journal of Clinical and Diagnostic Research: JCDR. 2017;11(4):CE01-CE04. DOI: 10.7860/JCDR /2017/21796.9671
- Adams SV, Passarelli MN, Newcomb PA. Cadmium exposure and cancer mortality in the Third National Health and Nutrition Examination Survey cohort. Occupational and environmental medicine. 2012;69(2):153-156. DOI: 10.1136/oemed-2011-100111
- Jadhav SH, Sarkar SN, Patil RD, et al. Effects of subchronic exposure via drinking water to a mixture of eight water-contaminating metals: a biochemical and histopathological study in male rats. Arch Environ Contam Toxicol. 2007;53(4):667-677. DOI: 10.1007/s00244-007-0031-0
- Кирьяков В.А., Павловская Н.А., Сааркоппель Л.М., и др. Изучение окислительного метаболизма в профпатологии (обзор литературы) // Медицина труда и промышленная экология. 2004. Т. 4. № 4. С. 22-25. [Kiryakov VA, Pavlovskaya NA, Saarkoppel LM, et al. Study of oxidative metabolism in vocational power (Review of literature). Labor medicine and industrial ecology. 2004;4(4):22-25. (in Russ.)]. EDN: OWBNJP
- Мышкин В.А., Бакиров А.Б., Репина Э.Ф. Окислительный стресс как фактор риска вторичных повреждений печени химическими веществами // Здравоохранение Российской Федерации. 2011. Т. 4. № 4. С. 32-33. [Myshkin VA, Bakirov AB, Repina EF. Oxidative stress as a risk factor for secondary damage to the liver with chemicals. Healthcare of the Russian Federation. 2011;4(4):32-33. (in Russ.)]. EDN: OFVJYB
- Тимашева Г.В., Кузьмина Л.П., Каримова Л.К., и др. Роль лабораторных исследований в диагностике ранних метаболических нарушений у работников нефтехимического производства // Медицина труда и промышленная экология. 2013. Т. 3. № 3. С. 15-20. [Timasheva GV, Kuzmina LP, Karimova LK, et al. The role of laboratory research in the diagnosis of early metabolic disorders among petrochemical production workers. Labor medicine and industrial ecology. 2013;3(3):15-20. (in Russ.)]. EDN: QIUTND
- Shati AA. Effects of Origanum majorana L. on cadmium induced hepatotoxicity and nephrotoxicity in albino rats. Saudi Med J. 2011;32(8):797-805
- Olajide JE, Sanni M, Achimugu OJ, et al. Effect of methanol extract of Trema orientalis leaf on some biochemical and histopathological indices of wistar albino rats with cadmium-induced-hepatotoxicity. Scientific African. 2020;10(1):e00568. DOI: 10.1016/j.sciaf.2020.e00568
- Okutu JB, Enebrayi ON. Аmeliorative effect of allium sativum and justicia carnea extracts co-administration on acute cadmium chloride-induced changes on liver function parameters of albino rats. World J. Pharm Life Sci. 2022;4(1):11-24
- Khan AA, Allemailem KS, Alhumaydhi FA, et al. The Biochemical and Clinical Perspectives of Lactate Dehydrogenase: An Enzyme of Active Metabolism. Endocr Metab Immune Disord Drug Targets. 2020;20(6):855-868. DOI: 10.2174/1871530320666191230141110
- Toppo R, Roy BK, Gora RH, et al. Hepatoprotective activity of Moringa oleifera against cadmium toxicity in rats. Vet World. 2015;8(4): 537-540. DOI: 10.14202/vetworld.2015.537-540
- Poosa M, Vanapatla SR. Protective effect of Antigonon leptopus (Hook et. Arn) in cadmium induced hepatotoxicity and nephrotoxicity in rats. Clinical Phytoscience. 2020;6(1):1. DOI: 10.1186/s40816-020-00181-0
- Голобородько Г.Н., Дерхо М.А., Середа Т.И. Особенности действия пищевых добавок на организм животных в модельной системе лабораторных крыс // АПК России. 2015. Т. 74. № 1. С. 168-172. [Goloborodko GN, Derkho MA, Sereda TI. Features of the action of food additives on the animal organism in the model system of laboratory rats. APK of Russia. 2015;74(1):168-172. (in Russ.)]. EDN: VKBAPH
- Пастушкова Е.В., Мычаков Д.С., Чугунова О.В. Некоторые аспекты и факторы питания и здоровья человека // Здоровье и образование в ХХI веке. 2016. Т. 18. № 4. С. 67-72. [Pastushkova EV, Mychakov DS, Chugunova OV. Some aspects and factors of nutrition and human health. Health and education in the XXI century. 2016;18(4):67-72. (in Russ.)].
- Pandey G, Jain GC. A review on toxic effects of aluminium exposure on male reproductive system and probable mechanisms of toxicity. International journal of toxicology and applied pharmacology. 2013;3(3):48-57.
- Hamza RZ, Al-Eisa RA, El-Shenawy NS. Possible ameliorative effects of the royal jelly on hepatotoxicity and oxidative stress induced by molybdenum nanoparticles and/or cadmium chloride in male rats. Biology. 2022;11(3):450. DOI: 10.3390/biology11030450
- Sobańska Z, Zapór L, Szparaga M, et al. Biological effects of molybdenum compounds in nanosized forms under in vitro and in vivo conditions. Int. J. Occup. Med. Environ. Health. 2020;33(1):1-19. DOI: 10.13075/ijomeh.1896.01411
- Дудакова Ю.С., Бабушкина И.В., Понукалин А.Н., и др. Биологическое действие высокодисперсных порошков металлов на ферменты сыворотки крови мышей // Известия высших учебных заведений. Северо-Кавказский регион. Естественные науки. 2010. Т. 1. № 2. С. 84-88. [Dudakova YS, Babushkina IV, Ponukalin AN, et al. Biological effect of highly dispersed metal powders on mouse blood serum enzymes. Izvestia of higher educational institutions. North Caucasian region. Natural Sciences. 2010;1(2):84-88. (in Russ.)].
- Kandemir FM, Caglayan C, Darendelioğlu E, et al. Modulatory effects of carvacrol against cadmium-induced hepatotoxicity and nephrotoxicity by molecular targeting regulation. Life Sciences. 2021;277(1):119610. DOI: 10.1016 /j.lfs.2021.119610
- El Shater AERA, Ali RA. Effect of Selenium and Bee Pollen Against Immunotoxicity and Hepatotoxicity Induced by Cadmium in Male Albino Rats. Egyptian Academic Journal of Biological Sciences. Physiology and Molecular Biology. 2019;11(2):1-19. DOI: 10.21608/eajbsc.2019.28688
- Ben-Abdallah S, Sefi M, Soudani N, et al. Potential antioxidant effects of Narcissus tazetta phenolic compounds against cadmium chloride-induced hepatotoxicity in Swiss albino mice. Environ Sci Pollut Res. 2021;28(1):66193-66205. DOI: 10.21203/rs.3.rs-159980/v1
- Matovic V, Buha A, Dukic-Cosic D, et al. Insight into the oxidative stress induced by lead and / or cadmium in blood, liver and kidneys. Food Chem Toxicol. 2015;78(1):130-140. DOI: 10.1016 /j.fct.2015.02.011
- Genchi G, Sinicropi MS, Lauria G, et al. The effects of cadmium toxicity. Int J Environ Res Public Health. 2020;17(11):3782. DOI: 10.3390/ijerph17113782


