Исследованиегетероперехода Cu / Cu4RbCl3I2 при высоких потенциалах
Автор: Остапенко Г.И., Соломин Б.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая физика и электроника
Статья в выпуске: 1 т.5, 2003 года.
Бесплатный доступ
Исследования проведены потенциостатическим методом. Показано, что на гетеропереходе при потенциалах. > 8.10 mV протекает электрохимическая реакция осаждения-растворения меди взависимости от знака потенциала.. В интервале 10 mV 120 mV скорость реакции лимитируется переносом заряда при плотности тока обмена 2,7 мА/см2 и анодном коэффициенте переноса около 0,45.
Короткий адрес: https://sciup.org/148197731
IDR: 148197731 | УДК: 537.9+541.12/13
Текст научной статьи Исследованиегетероперехода Cu / Cu4RbCl3I2 при высоких потенциалах
Суперионные проводники, в том числе и Cu4RbCl3I2 с высокой ионной проводимостью по ионам Cu+, широко применяются при разработке различных устройств твердофазной электроники, таких как су-перконденсаторы-ионисторы, интеграторы дискретного действия, элементы памяти и т.д. [1]. Существенным элементом таких устройств является гетеропереход Cu/ Cu4RbCl3I2, через который происходит перенос как электронов, так и ионов Cu+. Причем в последнем случае происходит электрохимическое осаждение-растворение меди на медном электроде взависимости от полярно сти тока.
В настоящее время накоплены достаточно обширные экспериментальные данные о кинетике электрохимических процессов на медном электроде в медьпроводящих суперионных проводниках. Однако интерпретация этих результатов противоречива. Например, в работе [2] показано, что при потенциалах более чем 30 мВ лимитирующей стадией являются кристаллизационные эффекты, но в работе [3] утверждается, что электрокристаллизация не может быть лимитирующей стадией.
В то же время известно, что Cu+ - проводящие суперионные проводники вс егда содержат примесь Cu2+ [4] вследствие химической нестабильности Cu+. Причем Cu2+ в структуре кристалла можно представить как Cu+ с локализованной на нем дыркой [5]. Поэтому в таких ионных проводниках наряду с электродной реакцией осаждения-растворения в ионной подсистеме:
Cu0 ‒ e ↔ Cu+ (1) может иметь место реакция в электронной подсистеме [4]:
Cu+ ‒ e ↔ Cu2+ или 0 ‒ е ↔ h•, где h• - дырка.
Поверхно сть меди, как правило, покрыта слоем Cu2O, препятствующим протеканию реакции (1) при потенциалах менее 10 мВ [6]. Поэтому при этих потенциалах на гетеропереходе протекает только реакция (2) генерации-рекомбинации дырок, кинетика которой исследована довольно подробно [6]. При более высоких потенциалах слой Cu2O разрушается и параллельно реакции (2) на гетеропереходе начинается реакция (1) [6].
Целью представляемой работы является исследование кинетики электрохимической реакции осаждения-растворения меди на гетеропереходе Cu/ RbCu4Cl3I2 при высоких потенциалах, т.к. именно кинетика электродных реакций определяет пути оптимизации разрабатываемых устройств твердофазной электроники.
Эксперимент
Суперионный проводник RbCu4Cl3I2 был приготовлен методом, приведенным в работе [6]. Поверхность пло ского медного электрода шлифовалась корундовыми порошками различной дисперсности, полировалась алмазной пастой до зеркального блеска, обезжиривалась этиловым спиртом, водной пастой CaO + MgO и промывалась водой. Затем электроды отжигались при 500oC и давлении 10-4 мм.рт.ст. в течение 6 часов и медленно охлаждались до комнатной температуры.
Ячейки типа
Cu / RbCu4Cl3I2 / Pt были приготовлены в атмосфере сухого воздуха (с использованием P2O5 в каче стве осушителя) прессованием порошка электролита под давлением 2,2x108 Па. Толщина слоя электролита составляла около 1 мм. Электрод сравнения из медной проволоки диаметром 0,2 мм был впрессован в середину электролита. Рабочий медный и платиновый контрэлектрод помещались на поверхности слоя электролита. Ячейки сжимались под нагрузкой около 3x106 Па в специальном патроне, отжигались при 160oC в течение 3 часов и медленно охлаждались до комнатной температуры.
Все электрохимические измерения проводились при 25oC с использованием потенциостат П-5848, как описано в работе [7]. Низкие токи измерялись с помощью микровольтпикоамперметра TR-1452 (Венгрия).
Результаты и дискуссия
Анодное растворение меди
На рис.1 приведены потенциостатичес-кие кривые анодного растворения меди при потенциалах, незначительно превышающих напряжение пробоя оксидной пленки на поверхности электрода. Эти кривые типичны для образования и разрастания центров растворения. Начальные участки кривых ток i ‒ время t описываются зависимостью i ^ t n , где показатель степени n опре-
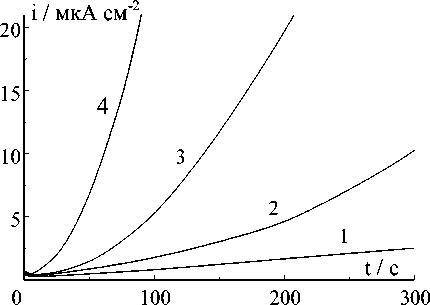
Рис.1. Потенциостатические кривые анодного растворения меди при небольших потенциалах, мВ: 1 ě 15; 2 ě 18; 3 ě 20; 4 ě 22
деляет закономерно сть образования и разрастания центров [8]. Величину n можно определить из наклона прямых на рис.2. Как видно на рис.3, с повышением потенциала n растет примерно от 1 до 2. При анодном растворении возможно только двухмерно е разрастание центров [9]. Следовательно, при сравнительно низких потенциалах и небольших временах, ток изменяется по закону [8]:
i - пqN0 V11, где: q есть количество электричества в растворяющемся слое, N0 есть количество мгновенно образовавшихся центров растворения, V1 есть скорость движения фронта растворения параллельно поверхности электрода. По-видимому, при более высоких потенциалах наряду с мгновенно обра-
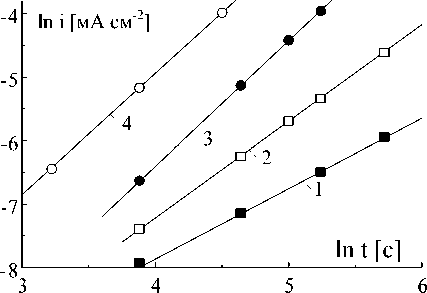
Рис.2. Потенциостатические кривые из рис.1 в логарифмических координатах
2.0
1.5
1.0
A lni[ieAni-2] ∆lnt[c]
ϕ / мВ
20 22
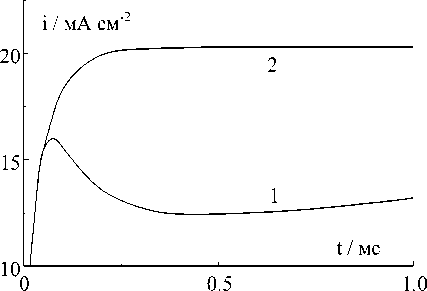
Рис.5. Потенциостатические кривые анодного растворения меди при высоких потенциалах, мВ:
1 ě 100; 2 ě 120
Рис.3. Наклон n = ∆lni/∆lnt прямых из рис.2
зовавшимися центрами растворения начинают возникать новые центры со скоростью А и поэтому закон изменения тока от времени стремится к квадратичному [8]:
i = πqV12At2. (3)
На рис.5 изображены потенциостати-ческие кривые при еще более высоких потенциалах. На этих кривых первоначальный бросок тока обусловлен, по-видимому, релаксацией неосновных носителей заряда (атомных дефектов кристаллической решетки) и здесь мы не будем его принимать во внимание. Видно, что с повышением потенциала зависимость тока от времени становится менее выраженной, а при 120 мВ и более, как это следует из рис.5, эта зависимость вообще исчезает (на рис.5 сглаженный фронт нарастания тока при включении обусловлен быстродействием потенциостата). Следовательно, при потенциалах более 120 мВ процесс анодного растворения меди
контролируется замедленным переносом заряда. Действительно, на рис.6 видно, что при этих потенциалах вольт-амперная характеристика (ВАХ) описывается уравнением [9]:
ie
ln = lni + α ϕ e 0 kT
1 - expkT ϕ
при плотно сти тока обмена i 0 = 2,7 мА/см2 и анодном коэффициенте переноса α а ≈ 0,45.
На рис.6 также приведена анодная ВАХ из работы [3], в которой исследуется медный электрод без покрывающей оксидной пленки. Видно, что различие более существенно при низких потенциалах, когда процесс растворения меди определяется, по-видимому, в основном наличием или отсутствием пленки окислов на поверхности
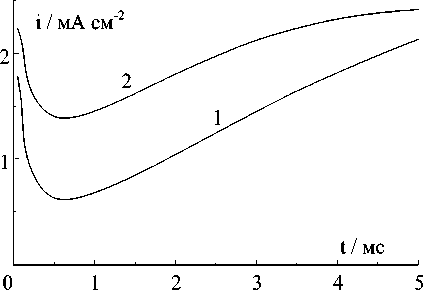
Рис.4. Потенциостатические кривые анодного растворения меди при средних потенциалах, мВ:
1 ě 40; 2 ě 50
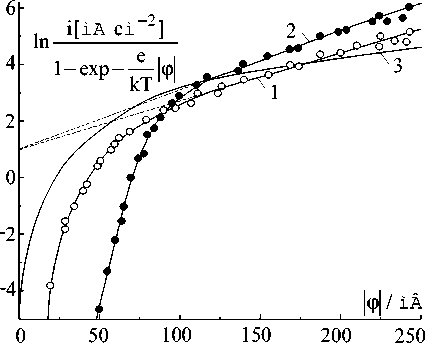
Рис.6. Вольтамперные характеристики медного электрода: 1 ě анодная, 2 ě катодная, 3 ě анодная из работы [3]
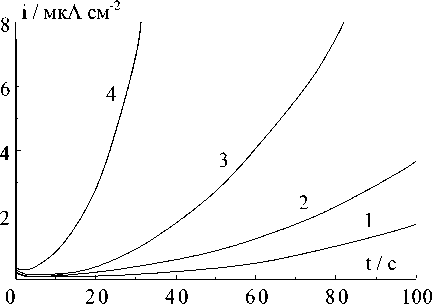
Рис.7. Потенциостатические кривые катодного осаждения меди при небольших потенциалах, мВ: 1 - (-10); 2 - (-11,5); 3 - (-13); 4 - (-14,5)
электрода, т.е. методикой подготовки электрода. При высоких потенциалах, когда пленка полностью разрушается, различия ВАХ незначительны.
Катодное осаждение меди
На рис.7 приведены потенциостатичес-кие кривые для катодного осаждения меди при невысоких потенциалах и коротких временах. Из этих кривых в логарифмических координатах (рис.8) следует, что величина показателя степени n , которая определяет закон изменения тока со временем, составляет 1,9 ± 0,1. Следовательно, осаждение меди может определяться прогрессирующим образованием и двухмерным разрастанием центров кристаллизации в соответствии с (3) или мгновенным образованием и трехмерных разрастанием центров [8]:
i = e ρ V 2 V 2 π N 0 t 2 , (5) m 0 1
где ρ - плотно сть осадка, m 0 ‒ его атомная масса и V 2 ‒ скоро сть роста игл и дендритов.
Известно, что обратимый и инертный электроды в суперионных проводниках ведут себя идентично при катодном осаждении [10]. Известно [11], что при осаждении меди на медь наблюдается рост игл и дендритов. Эти факты предполагают, что осаждение меди на медь происходит согласно (5) при мгновенном образовании и трехмерном разрастании зародышей, т.е. игл и дендритов.
При образовании и трехмерном разрастании центров и при времени, стремящемся к нулю [8]:
i t → 0 = e ρ V 3 , (6) m 0
где V 3 ‒ скоро сть роста толщины основы электрода. При до статочно длительных временах [8]:
eρ it→∞ = V2. (7) m0
Как видно на рис.7, при небольших потенциалах токи it → 0 ≈ 0. Следовательно, толщина основы электрода не увеличивается, но на его поверхности интенсивно растут иглы и дендриты. Однако эти токи появляются и увеличиваются при повышении потенциала (рис.9). На рис.10 приведена зависимость V 2 и V 3, рассчитанных по (6) и (7), от потенциала. Из этого рисунка следует, что скорость роста игл и дендри-
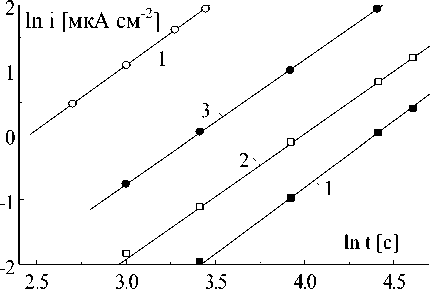
Рис.8. Потенциостатические кривые из рис.7 в логарифмических координатах
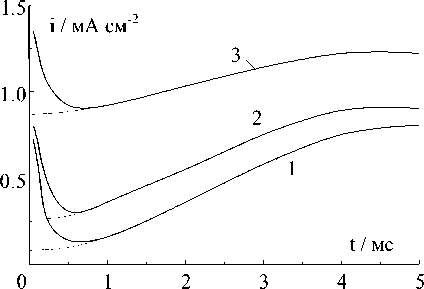
Рис.9. Потенциостатические кривые катодного осаждения меди при средних потенциалах, мВ: 1 - (-60); 2 - (-65); 3 - (-70)
-
-6h X
'о
S_
И ■• s в•
-
-8 . - V 2
-
в - V3■
■ ϕ / мВ
-10
-
-80 -70-60
Рис.10. Зависимость скорости роста игл и дендритов (V2) и скорости роста толщины осадка (V3) меди от потенциала тов намного превышает скорость роста основы электрода при сравнительно низких потенциалах. С повышением потенциала разность скоростей сокращается, и они сравниваются при потенциалах более 80…100 мВ. Следовательно, при этих потенциалах и выше иглы и дендриты практически не растут, а увеличивается толщина основы электрода.
Количество центров кристаллизации растет при увеличении потенциала [9]. При некотором значении потенциала наступит состояние, при котором дальнейшее увеличение количества центров станет невозможным, т.к. каждый атом на поверхности электрода будет таким центром. Поэтому растворение должно контролироваться замедленным переносом заряда при потенциалах выше указанного. Действительно, на рис. 6 видно, что ВАХ процесса осаждения меди при потенциалах выше 120 мВ описывается (4) при i 0 = 2,7 мА/см2 и катодном коэффициенте переноса α к ≈ 0,55.
Катодная и анодная ВАХ сильно различаются при потенциалах ниже 100 мВ (рис.6), т.е. наблюдается их значительная асимметрия. Это обусловлено, по-видимо-му, различным механизмом кристаллизации, т.к. при анодном растворении имеет место двухмерное разрастание центров растворения, а при катодном осаждении ‒ преимущественно трехмерный рост игл и дендритов.
Выводы
При потенциалах ϕ < 8…10 mV на гетеропереходе Cu/Cu4RbCl3I2 происходит реакция генерации-рекомбинации дырок в электронной подсистеме. При потенциалах ϕ > 8…10 mV происходит электрический пробой слоя Cu2O на поверхности медного электрода, реакция в ионной подсистеме деблокируется и начинается осаждение-растворение меди.
При 10 mV < ϕ < 100 mV скорость осаждения-растворения меди лимитируется образованием и разрастанием центров кристаллизации или растворения меди. При ϕ > 120 mV скорость реакции лимитируется переносом заряда при плотности тока обмена 2,7 мА/см2 и анодном коэффициенте переноса α a ≈ 0,45.
Работа выполнена в рамках Федеральной целевой программы “Го сударственная поддержка интеграции высшего образования и фундаментальной науки”, проект № Б-0107.


